Número Atual: Abril-Junho 2022 - Volume 6 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Imunologia da tuberculose: uma revisão narrativa da literatura
Tuberculosis immunology: a narrative literature review
Ana Cristina Favre Paes Barreto Alves1; Alex Isidoro Ferreira Prado2; Iukary Takenami3
DOI: 10.5935/2526-5393.20220024
1. Universidade Federal do Vale do São Francisco, Graduação em Medicina - Paulo Afonso, BA, Brasil
2. Universidade de São Paulo, Hospital das Clínicas da Faculdade de Medicina (HCFMUSP). Centro de Doenças Raras e da Imunidade do Hospital 9 de Julho - São Paulo, SP, Brasil
3. Universidade Federal do Vale do São Francisco, Laboratório de Estudos Aplicados à Saúde - Paulo Afonso, BA, Brasil
Endereço para correspondência:
Iukary Takenami E-mail:
iukary.takenami@univasf.edu.br
Submetido em: 14/01/2022
Aceito em: 24/04/2022
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A resposta imune desenvolvida pelo hospedeiro contra o Mycobacterium tuberculosis é considerada de natureza complexa e multifacetada. Esta interação bacilo-hospedeiro resulta, na maioria das vezes, em uma infecção latente assintomática, podendo ou não evoluir para a forma ativa da tuberculose (TB). O presente estudo objetivou atualizar e sumarizar o conhecimento científico acerca dos mecanismos imunológicos associados à infecção e sua progressão para a TB ativa. Trata-se de uma revisão narrativa, realizada a partir do levantamento bibliográfico de artigos científicos indexados nas bases de dados PubMed/MEDLINE e SciELO, nos últimos 20 anos. Nas últimas décadas, a caracterização de linfócitos Tγδ, MAIT, iNKT e outra células T CD1 restritas proporcionaram um maior entendimento do papel da imunidade inata na infecção pelo bacilo. A migração de linfócitos T CD4+ produtores de IFN-g, TNF-α e de outras moléculas solúveis, promove o recrutamento e formação do granuloma, estrutura que beneficia tanto o hospedeiro quanto o bacilo. Eventualmente, um desequilíbrio nesta complexa rede de interação, resulta em uma resposta inflamatória exacerbada que contribui para o desenvolvimento de um granuloma necrótico. Por fim, a exaustão da resposta imune local frente à contínua exposição ao bacilo, associada ao perfil anti-inflamatório dos linfócitos Th2 e linfócitos Treg, favorecem a inativação funcional e, consequentemente, o desenvolvimento da doença ativa. A resposta imunológica é crucial para o desenvolvimento da infecção por M. tuberculosis. Portanto, estudos que possibilitem uma maior compreensão sobre a interação bacilo-hospedeiro podem viabilizar o desenvolvimento de novos métodos diagnósticos, estratégias terapêuticas e, sobretudo, avanços no desenvolvimento de imunobiológicos.
Descritores: Tuberculose, Mycobacterium tuberculosis, imunidade, granuloma.
INTRODUÇÃO
A tuberculose (TB) é uma doença crônica infectocontagiosa causada pelo bacilo Mycobacterium tuberculosis que acomete, preferencialmente, o pulmão. Sequências conhecidas do genoma da micobactéria já foram identificadas em múmias egípcias, comprovando a existência da doença em civilizações antigas1. Ainda que a TB represente uma doença milenar, na atualidade, continua a ser um grave problema de saúde pública no Brasil e no mundo, sobretudo após a realocação de recursos humanos e financeiros do controle da TB para o enfrentamento da crise sanitária causada pela doença do coronavírus 2019 (COVID-19)2.
A TB acometeu, em 2020, em torno de 9,9 milhões de indivíduos no mundo e foi responsável por pouco mais de 1,5 milhões de óbitos, o que representa uma variação de 7,5% a mais em comparação aos óbitos registrados em 2019, ano anterior à pandemia da COVID-192,3. Ainda no ano de 2020, o Brasil registrou aproximadamente 67,2 mil casos de TB e 4,5 mil óbitos4, sendo considerado o país com o maior número de casos absolutos nas Américas e um dos 30 países com a maior carga da doença3. Tais dados reforçam a necessidade de reestruturar as políticas públicas de modo a permitir um planejamento estratégico mais efetivo no enfrentamento à TB em meio à pandemia da COVID-19.
A história natural da doença está intimamente relacionada aos determinantes biopsicossociais, imunogenética do hospedeiro e virulência do bacilo5,6. Fatores que promovem uma intensa e complexa relação bacilo-hospedeiro e que podem culminar no desenvolvimento de três desfechos clínicos: (1) clearance e controle da infecção na porta de entrada por meio de uma resposta imune inata eficaz, mesmo antes de iniciar a resposta imune adaptativa; (2) estabelecimento de uma infecção latente por M. tuberculosis (ILTB), ou (3) desenvolvimento da doença ativa. Na ILTB o M. tuberculosis encontra-se em estado de latência (dormência), nos lobos pulmonares, dentro de uma estrutura tecidual denominada granuloma. Nestes casos, o hospedeiro controla, mas não elimina o bacilo, permanecendo assintomático e representando potenciais reservatórios de M. tuberculosis1,3. Segundo estimativas da Organização Mundial da Saúde, um quarto da população mundial está infectada e em risco de desenvolver a doença ativa por meio da reativação desses bacilos dormentes3.
Diante dessa perspectiva, diversas questões emergem dessa discussão com o intuito de esclarecer os fenômenos envolvidos na imunologia da TB. Que eventos iniciais permitem o controle da infecção? Por que algumas pessoas são infectadas e outras não, mesmo quando expostas igualmente ao bacilo? O bacilo é capaz de modular a resposta do hospedeiro? Quais fatores contribuem para o estabelecimento da ILTB e progressão para a doença ativa? Assim, considerando a necessidade de fomentar a educação continuada dos profissionais da saúde com estratégias de detecção precoce da doença e, para melhoria das políticas públicas relacionadas à prevenção e tratamento, o objetivo do estudo foi sumarizar o conhecimento científico atual à luz dos mecanismos imunológicos já descritos com relação à infecção e ao desenvolvimento da TB ativa, enfatizando a interação bacilo-hospedeiro.
METODOLOGIA
Realizou-se uma revisão narrativa, de caráter descritivo com abordagem qualitativa, com o objetivo de conhecer o "estado da arte" dos aspectos imunológicos da TB, mas sem a necessidade de estabelecer uma metodologia replicável em nível de reprodução de dados. Embora esse tipo de revisão não utilize métodos explícitos e sistemáticos, apresenta um papel fundamental na educação continuada e atualização do conhecimento sobre a temática proposta7.
Foram recuperados artigos científicos indexados nas bases de dados na National Library of Medicine/ Medical Literature Analysis and Retrievel System Online (PubMed/MEDLINE) e no Scientific Electronic Library Online (SciELO), durante o mês de outubro e novembro de 2021, usando os seguintes descritores em ciências da saúde (DeCS): "tuberculosis", "Mycobacterium tuberculosis infection", "immunity", "immune response" e "granuloma" combinados por meio do operador booleano AND. Posteriormente, mediante necessidade de complementação teórica, fontes de literatura cinzenta e a busca manual em listas de referências dos artigos selecionados, foram também consultadas.
Como critério de inclusão, utilizou-se artigos publicados no idioma inglês ou português, disponíveis na íntegra, que abordassem a temática proposta em formato de artigos originais e/ou revisões, tendo como período de referência os últimos 20 anos. Os critérios de exclusão adotados foram: teses, monografias, dissertações e/ou cartas ao editor. Por fim, os artigos foram revisados criticamente e selecionados conforme o seu grau de relevância em relação ao objeto de estudo desta revisão. Em seguida os dados foram sistematizados nas seguintes categorias: "Da exposição à infecção", "Contribuições da imunidade inata: novos e velhos paradigmas", "Modulação da imunidade adquirida e formação do granuloma - uma defesa do hospedeiro?", "O que esperar da imunidade humoral?" e, por fim, "Desenvolvimento da doença ativa: mecanismos regulatórios e o dano tecidual".
RESULTADOS E DISCUSSÃO
Da exposição à infecção
A transmissão do M. tuberculosis ocorre de pessoa para pessoa principalmente por meio de gotículas contaminadas, conhecidas como "gotículas de Flügge", as quais são eliminadas pelo nariz ou pela boca quando um paciente bacilífero fala, espirra ou tosse. Essas gotículas rapidamente secam e transformam-se em partículas menores, que permanecem suspensas no ambiente por horas, podendo ser facilmente inaladas por um hospedeiro suscetível. Por sua vez, estas micropartículas, também conhecidas como "núcleo Wells", contêm um a dois bacilos que são capazes de alcançar os segmentos distantes da árvore brônquica, principalmente os lobos inferiores dos pulmões, onde se multiplicam e provocam a chamada TB primária ou primoinfecção8-10.
Embora a transmissão do bacilo seja, classicamente, associada à produção de aerossóis infecciosos após a tosse, um estudo recente demonstrou que a "respiração das marés" elimina mais bacilos por partícula do que a própria tosse11. De modo semelhante, foi possível identificar a presença do M. tuberculosis por meio da técnica reação em cadeia da polimerase em aerossóis liberados por pacientes que não relataram tosse12. Em conjunto, os resultados sugerem que a transmissão sem tosse é possível na TB pulmonar e que, portanto, outros sinais e sintomas devem ser valorizados na investigação diagnóstica individualizada.
Uma vez exposto ao bacilo, o curso da infecção é variável e diretamente associado às condições ambientais (ventilação e iluminação), imunogenética do hospedeiro, enfermidades coexistentes, estado nutricional, virulência da cepa infectante, entre outros5,13. Nesse contexto, é plausível considerar que nem todas as micropartículas que atingem os alvéolos pulmonares resultam em uma infecção sustentada. As múltiplas estratégias da resposta imune inata poderiam atuar no clearance de uma infecção incipiente por M. tuberculosis. Ademais, há evidências de que tais mecanismos podem ser aprimorados através da exposição repetida ou por um estímulo não relacionado (proteção-cruzada)14,15, fenômeno conhecido como "imunidade treinada" e que poderia explicar o clearance inicial e a ausência de infecção mesmo após à exposição ao bacilo.
A primeira linha de defesa do hospedeiro compreende os tecidos linfoides associados à superfície mucosa do trato respiratório. As células epiteliais da mucosa desempenham um papel crucial na proteção contra o M. tuberculosis, pois produzem muitos tipos de substâncias antimicrobianas e atuam como barreiras físicas que limitam a entrada do bacilo no espaço alveolar. Eventualmente, em um segundo momento, macrófagos alveolares exercem um papel importante no reconhecimento, fagocitose e liberação de citocinas pró-inflamatórias que resultam na eliminação do M. tuberculosis14,16,17.
Embora não haja evidências científicas suficientes, a eficácia destes mecanismos poderia estar associada ao motivo pelo qual alguns indivíduos são expostos ao bacilo, mas não apresentam nenhuma evidência de sensibilização imunológica pela prova tuberculínica (PT) e/ou pelos ensaios de liberação de interferon-gama, do inglês interferon-gamma release assays (IGRAs)15 (Figura 1A). Ainda que novos estudos sejam necessários para melhor caracterizar as peculiaridades do hospedeiro associados à resistência ao M. tuberculosis, não há modelos de estudos capazes de discernir o clearance inicial da não exposição, já que um resultado de PT ou IGRA negativo pode refletir qualquer uma das situações.
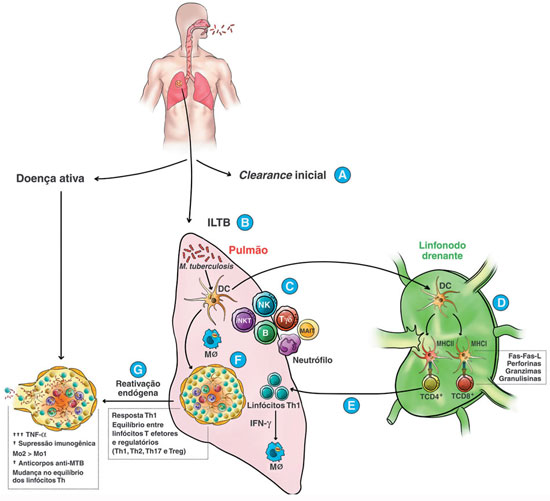
Figura 1
Representação esquemática dos aspectos imunológicos associados à infecção por Mycobacterium tuberculosise seus desfechos
B = linfócitos B, DC = células dendríticas, ILTB = infecção latente da tuberculosa, iNKT = células T natural killer invariantes (iNKT), MAIT = células T invariantes de mucosa, MHCI = complexo principal de histocompatibilidade classe I, MHCII = complexo principal de histocompatibilidade classe II, MØ = macrófagos, NK = natural killer, T = linfócitos T.
Contribuições da imunidade inata: novos e velhos paradigmas
Em 10 a 30% dos casos, a imunidade contra o M. tuberculosis é insuficiente na esterilização completa do bacilo e, portanto, requer do hospedeiro o desenvolvimento de uma resposta inflamatória crônica granulomatosa (Figura 1B). Assim, no estágio inicial da infecção, macrófagos alveolares, do tipo M1, em referência à via de ativação clássica, fagocitam o bacilo por meio de receptores de reconhecimento padrão (PRR) que se ligam a estruturas evolutivamente conservadas e denominadas padrões moleculares associados a patógenos (PAMP)16,18.
Os PRR mais estudados na infecção por M. tuberculosis correspondem aos receptores do tipo Toll, do inglês toll-like receptors (TLR). O bacilo é inicialmente reconhecido pelo TLR4, TLR9 e pelos heterodímeros TLR2/1 e TLR2/6, que interagem com a proteína adaptadora fator de diferenciação mieloide 88 (MyD88) e o domínio do receptor toll-interleucina 1 (TIR) contendo a proteína adaptadora (TIRAP), capazes de ativar macrófagos e células dendríticas (DC). Além disso, os TLR desempenham um papel integral na ativação das vias de sinalização de citocinas pró-inflamatórias e outros mediadores inflamatórios, conduzido pela ativação de fatores de transcrição como o fator nuclear kappa B (NF-κB)10,16,19,20. A observação de polimorfismo dos genes TLR tem sido associada à suscetibilidade à TB21, demonstrando que estes receptores desempenham um papel na regulação da expressão de citocinas inflamatórias produzidas por estas células fagocíticas.
Embora os TLR representem os principais receptores no reconhecimento inicial do M. tuberculosis, outros receptores do tipo-domínio de oligomerização ligante de nucleotídeo (NLR), lectinas tipo-C, receptores scavenger, entre outros, estão envolvidos no reconhecimento de diferentes ligantes micobacterianos. Ademais, além da fagocitose, os receptores são responsáveis pela ativação de outros mecanismos celulares, como a autofagia, apoptose e piroptose/montagem do inflamassoma, contribuindo com a modulação da resposta imune inata durante a infecção do M. tuberculosis14,20,22,23.
Estes mecanismos iniciais de fagocitose permitem a eliminação do bacilo, por meio da ação de enzimas lisossômicas e formação de radicais livres, no interior dos fagolisossomos. No entanto, cepas virulentas de M. tuberculosis conseguem, por vezes, escapar da defesa do hospedeiro e persistirem viáveis dentro dos lisossomos dos macrófagos e/ou das DC. Isso ocorre por causa dos mecanismos de escape que, embora sejam pouco conhecidos, estão relacionados à: (1) inibição da produção de citocinas como IL-12 e IFN-γ pelo alvo antigênico secretado primariamente de 6kDa, do inglês early secreted antigenic target-6kDa (ESAT-6); (2) inibição da fusão do fagossomo-lisossomo e, eventualmente, escape do M. tuberculosis dos fagossomos de macrófagos e/ou DC para o citoplasma; (3) inibição da apoptose de macrófagos infectados por meio do aumento da produção de IL-10 e redução na secreção de TNF-α16,24,25.
O estudo dos chamados erros inatos da imunidade (EII) reforça o que se conhece sobre a importância das citocinas descritas acima. Pacientes com a chamada suscetibilidade mendeliana à micobacterioses, do inglês mendelian susceptibility to mycobacterial disease (MSMD), possuem defeitos nas vias regulatórias do eixo IL-12/IFN-γ e seus receptores, culminando na predisposição infecciosa à patógenos intracelulares. O defeito mais comum é o IL-12Rb1, que acomete em média 60% dos pacientes com diagnóstico de MSMD26.
Os bacilos que sobrevivem às defesas fagocíticas primárias do hospedeiro são capazes de se multiplicar exponencialmente no interior destes macrófagos e/ou de DC, induzindo a produção de uma variedade de quimiocinas (CCL2, CCL3, CCL5, CXCL8, CXCL10) e citocinas (IL-1β, IL-6, TNF-α, IL-12, IL-23, IL-17, IFN-γ) capazes de recrutar e ativar distintas populações de leucócitos para o sítio infeccioso27.
A CXCL8 (IL-8) é antiapoptótica e pró-angiogênica e, em tecidos infectados com M. tuberculosis, pode ter efeitos imunológicos adicionais na quimiotaxia. Isto é, está associada à formação do granuloma tuberculoso, uma vez que esta quimiocina atua por meio da quimiotaxia no recrutamento de neutrófilos e morte do bacilo por macrófagos28. De modo semelhante, a CCL2 ou proteína quimiotática de monócitos-1 (MCP-1), CCL3 ou proteína inflamatória de macrófagos 1 alfa (MIP-1a), a CCL5 ou células T expressa e secretada normalmente (RANTES), e a CXCL10 ou proteína 10 induzida por interferon-gama (IP-10), são também quimiocinas que desempenham um papel importante na quimiotaxia, ativação de monócitos e linfócitos T e, consequentemente, formação de granuloma10,14,16,29. Estudos de expressão gênica têm demonstrado que após infecção pelo bacilo, monócitos regulam positivamente a transcrição destas quimiocinas29, sugerindo um papel potencial na prospecção de biomarcadores para a infecção.
A IL-1β, conjuntamente com o TNF-α, são citocinas que durante o processo inflamatório aumentam a expressão das moléculas de adesão endotelial, promovendo a agregação de outras células inflamatórias ao endotélio ativado. Ademais, ativam macrófagos e/ou DC, ajudando-os a controlar a replicação micobacteriana e inibem diretamente o crescimento intracelular do M. tuberculosis10,14,30. A subunidade IL-12p80 aumenta a produção de IFN-γ em células natural killer (NK) e a expansão de linfócitos T CD4+ helper 1 (Th1) antígeno-específicos, além de manter a ativação e proliferação de linfócitos, o que induz uma resposta celular predominantemente pró-inflamatória10,25. A IL-6 também é uma citocina pró-inflamatória que atua regulando negativamente as vias p38 e JNK envolvidas no processo de autofagia e contribui para a geração de linfócitos T CD4+ helper 17 (Th17) em condições inflamatórias, regulando e promovendo o equilíbrio entre Th17 e linfócitos T reguladores CD4+CD25+FoxP3+ (Treg)10,14,31.
Existem especulações interessantes acerca de pacientes portadores de síndromes autoinflamatórias como a Febre familiar do Mediterrâneo (FFM) que corroboram com a importância das citocinas inflamatórias na patogênese da TB. Estudos realizados por alguns grupos da Turquia aventam a hipótese de que uma vantagem evolutiva nestes pacientes os tornaria menos suscetível ao desenvolvimento da infecção pelo bacilo. Isso seria justificado, pelo menos em parte, pelo processo inflamatório crônico exagerado com liberação de citocinas pró-inflamatórias como a IL-1β e que provavelmente seria responsável por destruir patógenos intracelulares por um processo conhecido como piroptose pela ativação das vias do inflamassoma32.
Além destas citocinas e quimiocinas, destacam-se também as células NK através de sua capacidade citolítica. Embora as NK pertençam à imunidade inata, seus mecanismos são semelhantes aos utilizados pelos linfócitos T CD8+, também denominados de linfócitos T citotóxicos (CTL). Contudo, ao contrário dos linfócitos T CD8+, não apresentam o receptor de linfócitos T (TCRαβ) convencional para o reconhecimento de antígenos associados à molécula de histocompatibilidade principal (MHC) classe I, consequentemente, não são restritos ao MHC16,20. Adicionalmente, as células NK têm sido relacionadas a uma importante fonte de IFN-γ e podem também promover a proliferação de linfócitos Tγδ, produzindo TNF-α, GM-CSF e IL-1220,33.
Novas linhas de evidência sugerem que linfócitos T não convencionais, como os associados às células T invariantes de mucosa (MAIT), linfócitos Tγδ, células T natural killer invariantes (iNKT) e outras células T CD1 restritas, também estão envolvidas na defesa do hospedeiro contra o bacilo14,20,30 (Figura 1C). Ao contrário das células NK, o mecanismo efetor das iNKT e das outras células T CD1 restritas é dependente da via de reconhecimento de antígenos lipídicos e glicolipídicos apresentados pela molécula CD1d e CD1a/CD1b/ ou CD1c, respectivamente. Assim, o M. tuberculosis pode ser reconhecido tanto pelas iNKT, quanto pelas células T CD1 restritas34. Uma vez que a parede celular do bacilo é rica e possui uma grande variedade de lipídios, é possível hipotetizar que estas células são imprescindíveis no controle do bacilo, pois respondem rapidamente à micobactéria no estágio inicial da infecção.
As células MAIT expressam predominantemente o correceptor CD8 (CD8+) e também respondem de forma rápida e efetiva ao M. tuberculosis, antes mesmo que a resposta clássica de linfócitos T se estabeleça14. Um outro subgrupo de linfócitos que também possui um TCR distinto dos clássicos receptores presentes nos linfócitos T, são os linfócitos Tγδ, capazes de reconhecer pequenos antígenos de fosfato orgânico e alquilamidas. Ademais, apresentam-se como principal fonte de IL-17 no pulmão durante a infecção por M. tuberculosis30. Em conjunto, embora os estudos indiquem que estas células T não convencionais (MAIT, linfócitos Tγδ, iNKT e outras células T CD1 restritas), possam ter um papel promissor na patogênese da TB, a exata função e/ou mecanismos de ativação destas pelo hospedeiro durante o processo infeccioso ainda não foram totalmente esclarecidos e requer estudos mais detalhados. Por outro lado, estas células apresentam um possível potencial terapêutico a ser explorado, conforme o seu papel na imunomodulação da TB.
Uma outra estratégia da imunidade inata evidenciada na TB refere-se à capacidade dos neutrófilos ativados por M. tuberculosis formarem redes extracelulares complexas compostas por DNA e várias outras proteínas citosólicas e granulares biologicamente ativas. Esse mecanismo, do inglês neutrophil extracelular traps (NETs), auxilia o hospedeiro na defesa inata contra o bacilo e desempenha um importante papel na interação entre neutrófilos e macrófagos na fase inicial da infecção por M. tuberculosis. No entanto, sua formação é dependente de fatores como fagocitose, produção de espécies reativas de oxigênio e secreção significativa de citocinas como TNF-α, IL-6, IL-1ß e IL-1035. Em conjunto, a identificação e descobertas destes "novos" subconjuntos de células e/ou dos mecanismos efetores do hospedeiro têm suscitado o interesse e novas perspectivas no estudo da imunidade inata nos últimos 10 anos, até então menos explorada que a imunidade adquirida.
Modulação da imunidade adquirida e formação do granuloma - uma defesa do hospedeiro?
Uma vez que a resposta imune inata não é suficientemente capaz de destruir o M. tuberculosis, outras células, como monócitos e linfócitos, são direcionadas ao sítio de infecção para o desenvolvimento de uma resposta mais efetiva e formação do granuloma. Peptídeos oriundos da proteólise do M. tuberculosis, presentes nas vesículas apoptóticas dos macrófagos M1 e DC, ditas células apresentadoras de antígenos profissionais (APC), se ligam à molécula de MHC classe II, formando o complexo peptídeo-MHC II na superfície da APC e migram em direção ao linfonodo regional drenante onde apresentam aos linfócitos T naïve, também conhecidos como linfócitos T helper tipo 0 (Th0) (Figura 1D)19.
O reconhecimento do complexo peptídeo-MHC II associado aos sinais coestimulatórios dados pelas APC induz a expressão de fatores de transcrição, como o T-bet e o RORgt, que promovem a expansão clonal e diferenciação em linfócitos efetores Th1 e Th17, respectivamente. Assim, os linfócitos T CD4+, sobretudo as subpopulações Th1 e Th17, representam as principais populações efetoras que migram para o sítio primário da infecção, ampliando a resposta imune e mediando a proteção durante a infecção por M. tuberculosis14,16,31.
A resposta imune mediada por linfócitos Th1 M. tuberculosis-específico está associada à produção de citocinas pró-inflamatórias, tais como IL-1ß, IL-2, IL-12, TNF-α e, principalmente, IFN-γ (Figura 1E). Por sua vez, linfócitos Th17 produzem IL-17 que possui um papel inicial na secreção de IFN-γ, o qual estimula o recrutamento de linfócitos Th114,16,31. Ademais, em modelo animal, respostas de linfócitos Th17 precedem uma forte resposta Th1 nos pulmões, sugerindo que estas células são importantes no recrutamento de linfócitos Th1 para o sítio infeccioso e posterior formação do granuloma27.
O IFN-γ é classicamente descrito na literatura como a citocina chave no controle da infecção. Contudo, estudos em modelo animal e humano indicam que a produção desta citocina isolada não é suficiente para conferir proteção ao hospedeiro10,19,30,36. A citocina é bem conhecida pela sua capacidade de ativar macrófagos, estimular a fagocitose, a maturação do fagossomo, a produção de intermediários reativos de oxigênio e nitrogênio, e a apresentação de antígenos, buscando eliminar ou restringir a multiplicação micobacteriana intracelular31. Não apenas linfócitos T CD4+ do perfil Th1, mas também linfócitos T CD8+ e células NK produzem IFN-γ em resposta à IL-12 produzida pelas APC14.
A resposta mediada por linfócitos T CD8+ é normalmente de menor magnitude do que as dos linfócitos T CD4+. A ativação das CTL ocorre via peptídeo-MHC I por meio do mecanismo de apresentação cruzada pelas DC após absorção de vesículas apoptóticas, oriundas de macrófagos e neutrófilos infectados e contendo antígenos do bacilo. A atuação destas células pode ocorrer por três vias diferentes: (1) exocitose de grânulos citotóxicos contendo perforinas, granulisinas e granzimas que causam a lise e apoptose de macrófagos e DC infectadas; (2) interação das proteínas de superfície FasL e Fas que resultam na morte da célula-alvo infectada com M. tuberculosis, e (3) produção de IFN-γ e TNF-α por estas células, ampliando os efeitos microbicidas8,16,30,36.
No tecido, a interação célula-célula ajuda a conter/isolar a infecção por meio da formação de uma barreira imune e física conhecida como granuloma, resultado da estimulação crônica de células/citocinas (hipersensibilidade tardia) e da incapacidade do sistema imune destruir o bacilo. A arquitetura do granuloma caracteriza-se por massas de tecido cronicamente inflamados, formado por bacilos vivos ou mortos, circundados por macrófagos e células epitelioides que tornam-se gigantes e multinucleadas, envoltos por um halo de linfócitos T CD4+ e T CD8+, plasmócitos e fibroblastos (Figura 1F)37. Ademais, destaca-se o papel das citocinas pró-inflamatórias e quimiocinas na formação e estabilidade do granuloma, em especial o TNF-α.
Já é sabido que o TNF-α possui um papel crítico em relação à resposta do hospedeiro à infecção, pois influencia a migração de leucócitos até o foco infeccioso, promovendo a formação do granuloma capaz de conter a multiplicação e prevenir a disseminação do bacilo. Embora outras citocinas e quimiocinas influenciem o recrutamento de leucócitos, o TNF-α parece ter um papel preponderante na manutenção da integridade estrutural do granuloma. Esses achados foram posteriormente validados pela observação da reativação endógena em pacientes ILTB que fizeram uso de inibidores de TNF-α no tratamento de doenças imunomediadas, como a artrite reumatoide, doença de Crohn, e EII com desregulação imune, como a deficiência de adenosina deaminase tipo 2 (DADA2)38-40.
De modo semelhante, pessoas que vivem com HIV (PVHIV) com contagem de linfócitos T CD4+ inferior a 350 células/mm3 apresentam igual importância, pois o risco de reativação da TB entre aqueles com ILTB é consideravelmente alto. O HIV possui tropismo por linfócitos T CD4+, portanto, a intensa replicação viral compromete a imunidade celular e a estrutura organizacional do granuloma no hospedeiro. Esse cenário de coinfecção TB/HIV não só impacta na reativação e desenvolvimento da doença ativa entre aqueles com ILTB, como também aumenta a taxa de mortalidade e letalidade da TB, características que fomentam a testagem oportuna para HIV em pacientes TB e vice-versa8,14,30. Além disso, vale ressaltar que polimorfismos no gene CARD8 - responsável por controle da inflamação e das vias apoptóticas - em PVHIV aumentam exponencialmente a chance de infecção ativa por descontrole do inflamassoma e morte celular exagerada41. Portanto, a capacidade do sistema imunológico do hospedeiro em conter o bacilo envolve uma rede complexa de genes e diferentes subpopulações de linfócitos, citocinas, entre outros mediadores inflamatórios, responsáveis pela formação e manutenção do granuloma, sobretudo, os linfócitos T CD4+ e o TNF-α.
Embora a formação do granuloma seja tradicionalmente considerada necessária para limitar a infecção, os mecanismos que regulam a dinâmica, o comportamento e a manutenção das células só foram compreendidos com os últimos avanços no uso de microscopia intravital, a qual têm permitido uma análise mais acurada e detalhada sobre a formação do granuloma. Novas descobertas sugerem que a micobactéria beneficia-se com a formação da estrutura tecidual. Utilizando o modelo experimental zebrafish, Davis e Ramakrishnan42 demonstraram que na infecção pelo M. marinum (e presumivelmente, M. tuberculosis), os macrófagos são altamente móveis e que o granuloma inicial beneficia o bacilo, pois permite o recrutamento de macrófagos não infectados para o local de infecção, fornecendo um ambiente constante de células renováveis e suscetíveis à entrada do bacilo. Mais recentemente, avanços no que tange a criação de modelos de granuloma in vitro, também têm proporcionado o uso desta técnica no estudo da biologia do granuloma43. Ainda que incipiente, o modelo experimental para estudo é factível e deverá ser utilizado sob a perspectiva de uma abordagem translacional correlacionando a experimentação in vivo com os estudos clínicos.
Com o passar dos anos, esse complexo torna-se estável, com áreas de fibrose ou até de calcificação (cicatrização) e, embora haja controle da infecção, os bacilos podem permanecer viáveis no interior dessas lesões por muitos anos (tuberculose primária). Nestes casos, observa-se também a produção do fator transformador de crescimento beta (TGF-β), o qual participa ativamente na indução da fibrose37. A formação do granuloma é, portanto, conhecida como nódulo primário ou nódulo de Ghon, geralmente localizado nos lobos médio e inferior dos pulmões, ocorrendo na maioria das vezes em crianças. Por sua vez, a sua associação com um nódulo linfático é comumente visualizada através de radiografia de tórax e é denominada complexo de Ghon, essas características resultam na condição de ILTB que representa um equilíbrio "bem-sucedido" na interação bacilo-hospedeiro, com bloqueio da multiplicação bacilar e da expansão da lesão8,37,44.
Posto isso, a ILTB é definida, unicamente, por meio de evidências de sensibilização imunológica. Na PT, células efetoras e de memória, previamente sensibilizadas, migram até o local de inoculação do derivado proteico purificado (PPD) e desenvolvem uma forte resposta de hipersensibilidade tardia, com formação de endurecimento cutâneo igual ou superior a 5 mm. Contudo, a reação cutânea só é visível após 48 a 72h da aplicação, via intradérmica, do PPD. Por sua vez, nas versões mais recentes de IGRA, o sangue total do hospedeiro e, consequentemente, as células previamente expostas ao M. tuberculosis, são cultivadas com um pool de antígenos (ESAT.6, CPF-10 e TB7.7) por um período de 24h. Por consequência, induzem a produção de IFN-γ, citocina que é mensurada por meio de um ensaio imunoenzimático e que se apresenta com níveis iguais ou superiores a 0,35 UI/mL. Em ambos os casos, a sensibilização imunológica é observada, aproximadamente, duas a três semanas após a exposição a uma fonte bacilífera, momento a partir do qual os resultados dos testes serão positivos45. Embora os testes apresentem elevada sensibilidade e especificidade para identificar a exposição ao M. tuberculosis, nenhum deles distingue a infecção latente da ativa.
O que esperar da imunidade humoral?
Embora a imunidade contra TB seja primariamente mediada por uma resposta celular, o papel da resposta humoral por meio da participação de linfócitos B produtores de anticorpos anti-M. tuberculosis ainda não está claro16,19,36. Inúmeros estudos têm demonstrado elevados níveis séricos de anticorpos em resposta a estruturas presentes no M. tuberculosis em indivíduos com a forma latente e, mais frequentemente, em pacientes com a doença ativa, de modo que títulos mais elevados de anticorpos se correlacionam com a doença ativa e/ou gravidade da doença46,47. Não obstante, pacientes com a doença ativa e com elevados níveis de produção de anticorpos anti-M. tuberculosis apresentam ausência da resposta imune celular específica (anergia) ao PPD48,49, assim como ocorre nas formas clínicas mais avançadas da hanseníase.
Sabe-se que os anticorpos, ao revestir o M. tuberculosis, podem promover (1) o processo de opsonização por meio de células fagocíticas que possuem receptores para as porções Fc dos anticorpos, (2) a citotoxicidade celular dependente de anticorpos (ADCC) por meio de células NK que também reconhecem a porção Fc dos anticorpos, (3) ativação do sistema complemento, (4) regulação imunológica na inflamação, e (5) eliminação e neutralização de bacilos no meio extracelular50. Contudo, como é o caso de muitas bactérias intracelulares, o M. tuberculosis é capaz de evadir os efeitos antimicobacterianos mediados pelos anticorpos uma vez que conseguem sobreviver no interior dos macrófagos alveolares e/ou DC.
Apesar de pouco se falar sobre a função do linfócito B na TB, alguns estudos avaliaram as subpopulações destas células revelando resultados interessantes. A presença de linfócitos B atípicos (CD21-CD27- ou CD27-IgD-), além de linfócitos ativados (CD27+IgD-) estavam aumentados em comparação com controle saudáveis. No entanto, apresentaram uma reduzida proliferação associada a uma produção deficiente de citocinas e anticorpos. Estas funções se normalizaram após o tratamento adequado com antituberculostáticos. Outros estudos corroboraram com o achado acima mostrando que a micobactéria suprime ou esgota as funções efetoras dos linfócitos B. Por sua vez, linfócitos de memória (CD19+IgM+/-CD27++), plasmoblastos (CD19+IgM+/-CD138+CD27+), plasmoblastos de memória (CD19+IgM+/-CD138+CD27++), bem como linfócitos de zona marginal circulante (CD19+CD27-CD23-) estavam significativamente aumentados nos pacientes com diagnóstico de TB em comparação com aqueles já tratados, apresentando-se como um potencial biomarcador de resposta ao tratamento51.
Outro subtipo importante e recém descrito na literatura de linfócito B, referem-se aos linfócitos B regulatórios (CD19+CD1d+CD5+), os quais estariam aumentados na TB ativa com cavitação e nas formas mais graves da doença. Curiosamente, um outro fenótipo celular de linfócitos B regulatórios, também conhecidos como linfócitos B killer (CD19+ CD5+IgM+FasL+) estão aumentados nos pacientes com a doença ativa, mas com níveis muito maiores na ILTB com normalização após tratamento e nova elevação após estímulo in vitro com BCG51, resultados que sugerem um potencial papel protetor na infecção contra a micobactéria, com necessidade de mais estudos confirmatórios.
Não obstante, um estudo publicado por Lu e cols.50 mostrou que indivíduos com a forma latente e ativa da doença apresentam anticorpos anti-M. tuberculosis distintos. Dessa forma, indivíduos com ILTB exibem um perfil funcional único, uma ligação seletiva à isoforma FcγRIII e um distinto padrão de glicosilação, características que parecem contribuir para o controle da infecção. Diante desses achados é possível considerar que (1) quantidades elevadas de anticorpos anti-M. tuberculosis não necessariamente são capazes de fornecer uma resposta satisfatória, e (2) a imunidade contra o bacilo em indivíduos com ILTB parecer estar associada a um perfil de anticorpos funcionais, independente da sua quantidade, e com a geração de linfócitos B regulatórios nestes indivíduos. Embora a importância dos anticorpos seja atualmente incerta e possa diferir de hospedeiro para hospedeiro, o fato de que os anticorpos têm a capacidade de modular e potencializar a imunidade do hospedeiro (opsonização, ativação do sistema complemento, inflamação, etc.) sugere que este braço do sistema imune adaptativo pode contribuir para o resultado da infecção por M. tuberculosis e, portanto, não deve ser ignorado.
Desenvolvimento da doença ativa: mecanismos regulatórios e o dano tecidual
Eventualmente, cerca de 5-10% dos indivíduos infectados, isto é, com ILTB, desenvolve a doença ativa nos dois primeiros anos3,18. Esta reativação endógena ocorre, principalmente, em pacientes com algum grau de imunossupressão - condição que pode levar ao rompimento do granuloma e à disseminação de bacilos viáveis (Figura 1G). Os principais fatores de risco e populações vulneráveis estabelecidos na literatura são tabagismo, alcoolismo, uso de drogas ilícitas, diabetes mellitus, crianças desnutridas, idosos, PVHIV, outras doenças crônicas e exposição a micobactérias ambientais3,52. Nestes casos, além do desenvolvimento da doença pulmonar ativa, os pacientes apresentam maior probabilidade de progressão para formas graves e disseminadas, sendo este último resultado da disseminação do bacilo, por meio da via hematogênica, linfohematogênica, contiguidade ou intracanalicular, para outros órgãos e tecidos como os rins, pele, sistema geniturinário, sistema nervoso central, ossos, entre outros14,53.
Considerando a influência multifatorial no resultado da infecção por M. tuberculosis, as generalizações na imunopatologia da TB ativa aqui apresentadas podem ser limitadas. Em indivíduos imunocomprometidos e em crianças, a ausência de uma resposta imune celular efetiva facilita a multiplicação do bacilo e promove o desenvolvimento da doença. Já em adultos imunocompetentes, a exacerbação da imunidade celular é responsável pelo dano tecidual e disseminação do bacilo, conforme pode ser visto em PVHIV quando apresentam a chamada Síndrome inflamatória de reconstituição imune. Uma vez que os mecanismos de desenvolvimento da doença são heterogêneos, este trabalho se propôs a focar nos casos de desenvolvimento da TB pulmonar ativa em indivíduos imunocompetentes.
Posto isso, na maioria das vezes, a reativação ocorre na fase adulta e resulta em um desequilíbrio da complexa rede de interação bacilo-hospedeiro, que suscita neste último um processo necrótico na área central do granuloma, conhecido como necrose caseosa. As lesões necróticas são semelhantes a um queijo, pois possuem aspecto homogêneo, branco, rico em proteínas e gorduras devido ao metabolismo bacilar37, e, ao atingirem os vasos sanguíneos, levam à ocorrência de expectoração com hemoptoicos, achados que caracterizam as cavitações (cavernas) brônquicas da TB secundária (pós-primária) e que simbolizam o sintoma clássico da TB pulmonar: tosse produtiva acompanhada de escarros hemoptoicos. Nestes casos, a formação de cavidades pode medir de alguns centímetros, sobretudo nos segmentos pulmonares apicais posteriores, até áreas extensas. A TB, dita secundária, é, portanto, consequência da reativação de um foco primário ou, na maioria dos casos, por meio de um novo contato com pacientes bacilíferos (reinfecção exógena)44.
Embora a resposta inflamatória mediada por linfócitos Th1 seja a principal responsável pela proteção contra a infecção por M. tuberculosis, é também capaz de provocar a exacerbação de uma resposta inflamatória danosa ao hospedeiro, e que resulta no desenvolvimento da doença ativa e no processo de formação de cavidades. Nesse contexto, fatores derivados do hospedeiro, como o excesso de TNF-α, a degranulação das células fagocíticas com a liberação de proteinases, nucleases e lipases, favorecem a liquefação do cáseo com a formação de cavidades nos centros dos granulomas e, portanto a perda da arquitetura do tecido pulmonar27. Além disso, pacientes com TB apresentam uma produção excessiva de citocinas como IL-1, IL-2 e IFN-γ, associados a um aumento da síntese hepática e dos níveis séricos de proteínas de fase aguda, como a proteína C-reativa, velocidade de hemossedimentação e proteína amiloide A sérica, caracterizando um clássico estado hiperinflamatório54. Diferindo desses resultados, pacientes com TB hospitalizados apresentam uma diminuição da resposta Th1, muito provavelmente devido à exaustão da resposta imune local e/ou sistêmica. Dessa forma, linfócitos T antígeno-específicos reduzem a capacidade de proliferar e produzir mediadores inflamatórios. Alguns estudos ainda têm demonstrado que os níveis de IFN-γ são menores em pacientes TB quando comparado com os indivíduos com ILTB55. Por sua vez, Bertholet e cols.56 e Peresi e cols.54 também mostraram que ao longo do tratamento há um aumento nos níveis de IFNγ-, sugerindo uma possível restauração da resposta imune específica. Essas observações são apoiadas por casos de TB pulmonar em que pacientes imunocomprometidos, mas com a doença avançada, mostram-se anérgicos à PT48. Diante dos resultados, é plausível considerar que não se trata de dados divergentes, mas de diferentes estágios da doença em que a resposta inflamatória exacerbada, muito provavelmente, precede a exaustão do sistema imune.
Curiosamente, um estudo realizado por Berry e cols.57 mostrou que transcritos de genes induzidos por IFN tipo I, mais frequentemente associado às infecções virais, são capazes de discriminar TB pulmonar ativa de indivíduos saudáveis, pacientes com outras doenças respiratórias crônicas e a maioria dos indivíduos com ILTB. Desde então, inúmeros estudos têm demonstrado que níveis elevados de IFN tipo I resultam em uma carga bacilar aumentada e exacerbação da doença em modelos experimentais da TB53,58-60.
Por outro lado, a hipersensibilidade celular estimula no hospedeiro mecanismos importantes capazes de regular e prevenir os efeitos nocivos da inflamação, os quais podem invariavelmente reduzir a imunidade protetora e contribuir com a supressão celular. Linfócitos T CD4+ helper 2 (Th2) e/ou linfócitos Treg secretam citocinas anti-inflamatórias, como IL-4, IL-10 e TGF-β, e interagem diretamente com outras células por meio de moléculas inibitórias como CTLA-4 e PD-1, que estão presentes na superfície celular30.
Mais recentemente, estudos têm demonstrado que, durante o desenvolvimento da doença ativa, observa-se a diferenciação e polarização de macrófagos M1 para o perfil M2, que está diretamente relacionada à evasão do M. tuberculosis14. Normalmente, os macrófagos M1 são os principais efetores da resposta do hospedeiro contra a micobactéria e produzem citocinas imunoestimulantes. Em contraste, os macrófagos com fenótipo M2, ativados alternativamente, possuem baixa capacidade de promover apresentação de antígenos e são induzidos por IL-4, IL-13, IL-10 e TGF-β, citocinas que suprimem a resposta de linfócitos Th120. Logo, pode-se concluir que o fenótipo M1 é pró-inflamatório e atua no controle inicial da infecção por M. tuberculosis, enquanto o M2 pode ser induzido através do microambiente anti-inflamatório promovido pelos linfócitos Th2 e por Treg na doença ativa. Por fim, a qualidade da resposta imunológica associada ao diagnóstico precoce e tratamento adequado podem promover a regressão da lesão com cicatrização e fibrose. Do contrário, quanto maior morosidade no manejo terapêutico, maior será o processo destrutivo, inviabilizando a reparação tecidual no parênquima afetado44.
CONCLUSÃO
A resposta imune desenvolvida pelo hospedeiro afeta diretamente o curso da infecção por M. tuberculosis. Apesar dos consideráveis avanços na área, a compreensão da resistência natural ao bacilo ainda é incerta. Da mesma forma, a contribuição das diferentes subpopulações dos linfócitos B e dos anticorpos ainda precisa ser elucidada. Por outro lado, a infecção assintomática latente é um modelo associado ao desenvolvimento de uma resposta imune inata e adquirida em que participam inúmeros mediadores solúveis (citocinas e quimiocinas), células (macrófagos, neutrófilos, NK) e diversas subpopulações de linfócitos convencionais (T CD4+ perfil Th1, linfócitos Th17, linfócitos T CD8+) e não convencionais (linfócitos Tγδ, MAIT, iNKT e outras células T CD1 restritas).
Esta complexa interação bacilo-hospedeiro permite a formação do granuloma, estrutura tecidual capaz de conter a multiplicação e disseminação do bacilo, levando frequentemente à cicatrização. Por vezes, condições imunológicas desfavoráveis, que promovam um ambiente de inflamação exacerbada e/ou supressão de células e mediadores solúveis que orquestram o granuloma, contribuem para o desenvolvimento da imunopatologia. Não obstante, na tentativa de prevenir o dano tecidual, linfócitos T CD4+ perfil Th2, linfócitos Treg e macrófagos do tipo M2, também favorecem a progressão da TB pulmonar, por meio da produção de citocinas que suprimem a resposta imune inflamatória necessária para a formação e manutenção do granuloma.
Ainda que diferentes mediadores solúveis e células desempenhem um papel primordial para o hospedeiro na defesa e na contenção da infecção por M. tuberculosis, ainda não está claro quais são mais efetivos na prevenção da TB, pois existem diferentes vias envolvidas no desencadeamento de uma resposta imunológica protetora bem-sucedida. Assim, novos estudos são necessários, visto que o conhecimento acerca da imunologia da TB é de grande importância para o desenvolvimento de novos correlatos de infecção e/ou doença, que sejam utilizados para construção de novos métodos diagnósticos e estratégias terapêuticas, sobretudo na atual era dos imunobiológicos.
REFERÊNCIAS
1. Donoghue HD. Insights gained from ancient biomolecules into past and present tuberculosis - a personal perspective. Int J Infect Dis. 2017;56:176-80.
2. WHO. Global Tuberculosis Report 2020 [Internet]. Disponível em: https://apps.who.int/iris/handle/10665/336069 . Acessado em: 12/01/2022.
3. WHO. Global Tuberculosis Report 2021 [Internet]. Disponível em: https://apps.who.int/iris/handle/10665/346387 . Acessado em: 12/01/2022.
4. Brasil. Ministério da Saúde. Boletim Epidemiológico Especial Tuberculose [Internet]. Disponível em: https://www.gov.br/saude/pt-br/media/pdf/2021/marco/24/boletim-tuberculose-2021_24.03#:~:text=Em%202020%2C%20o%20Brasil%20registrou,óbitos%20por%20100%20mil%20habitantes . Acessado em: 12/01/2022.
5. Coelho Filho JC, Takenami I, Arruda S. Revisiting the Rich's formula: an update about granulomas in human tuberculosis. Braz J Infect Dis. 2013;17:234-8.
6. Pedrazzoli D, Boccia D, Dodd PJ, Lönnroth K, Dowdy DW, Siroka A, et al. Modelling the social and structural determinants of tuberculosis: opportunities and challenges. Int J Tuberc Lung Dis. 2017;21(9):957-64.
7. Rother ET. Revisão sistemática X revisão narrativa. Acta paul enferm. 2007;20:v-vi.
8. Mack U, Migliori GB, Sester M, Rieder HL, Ehlers S, Goletti D, et al.; C. Lange; TBNET. LTBI: latent tuberculosis infection or lasting immune responses to M. tuberculosis? A TBNET consensus statement. Eur Respir J. 2009;33(5):956-73.
9. Nardell EA. Wells Revisited: Infectious Particles vs. Quanta of Mycobacterium tuberculosis Infection - Don't Get Them Confused. Mycobact Dis. 2016;06(05).
10. Zuñiga J, Torres-García D, Santos-Mendoza T, Rodriguez-Reyna TS, Granados J, Yunis EJ. Cellular and humoral mechanisms involved in the control of tuberculosis. Clin Dev Immunol. 2012;2012:193923.
11. Dinkele R, Gessner S, McKerry A, Leonard B, Seldon R, Koch AS, et al. Capture and visualization of live Mycobacterium tuberculosis bacilli from tuberculosis patient bioaerosols. PLoS Pathog. 2021;17(2):e1009262.
12. Patterson B, Wood R. Is cough really necessary for TB transmission? Tuberculosis (Edinb). 2019;117:31-5.
13. Dubé JY, Fava VM, Schurr E, Behr MA. Underwhelming or Misunderstood? Genetic Variability of Pattern Recognition Receptors in Immune Responses and Resistance to Mycobacterium tuberculosis. Front Immunol. 2021;12:714808.
14. Ferluga J, Yasmin H, Al-Ahdal MN, Bhakta S, Kishore U. Natural and trained innate immunity against Mycobacterium tuberculosis. Immunobiology. 2020;225(3):151951.
15. Verrall AJ, Netea MG, Alisjahbana B, Hill PC, van Crevel R. Early clearance of Mycobacterium tuberculosis: a new frontier in prevention. Immunology. 2014;141(4):506-13.
16. de Martino M, Lodi L, Galli L, Chiappini E. Immune Response to Mycobacterium tuberculosis: A Narrative Review. Front Pediatr. 2019;7:350.
17. Li W, Deng G, Li M, Liu X, Wang Y. Roles of Mucosal Immunity against Mycobacterium tuberculosis Infection. Tuberc Res Treat. 2012;2012:791728.
18. Brasil. Ministério da Saúde. Manual de Recomendações para o Controle da Tuberculose no Brasil [Internet]; 2018. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/manual_recomendacoes_controle_tuberculose_brasil_2_ed.pdf . Acessado em: 12/01/2022.
19. Cooper AM. Cell-mediated immune responses in tuberculosis. Annu Rev Immunol. 2009;27:393-422.
20. Liu CH, Liu H, Ge B. Innate immunity in tuberculosis: host defense vs pathogen evasion. Cell Mol Immunol. 2017;14(12):963-75.
21. Zhou Y, Zhang M. Associations between genetic polymorphisms of TLRs and susceptibility to tuberculosis: A meta-analysis. Innate Immun. 2020;26(2):75-83.
22. Killick KE, Ní Cheallaigh C, O'Farrelly C, Hokamp K, MacHugh DE, Harris J. Receptor-mediated recognition of mycobacterial pathogens. Cell Microbiol. 2013;15(9):1484-95.
23. Lerner TR, Borel S, Gutierrez MG. The innate immune response in human tuberculosis. Cell Microbiol. 2015;17(9):1277-85.
24. Jamwal SV, Mehrotra P, Singh A, Siddiqui Z, Basu A, Rao KVS. Mycobacterial escape from macrophage phagosomes to the cytoplasm represents an alternate adaptation mechanism. Sci Rep. 2016;6:23089.
25. Moutinho ILD. Tuberculose: aspectos imunológicos na infecção e na doença. Rev méd Minas Gerais. 2011;21(1):42-8.
26. Bustamante J. Mendelian susceptibility to mycobacterial disease: recent discoveries. Hum Genet. 2020;139(6-7):993-1000.
27. Flynn JL, Chan J, Lin PL. Macrophages and control of granulomatous inflammation in tuberculosis. Mucosal Immunol. 2011;4(3):271-8.
28. O'Kane CM, Boyle JJ, Horncastle DE, Elkington PT, Friedland JS. Monocyte-Dependent Fibroblast CXCL8 Secretion Occurs in Tuberculosis and Limits Survival of Mycobacteria within Macrophages. J Immunol. 2007;178(6):3767-76.
29. Méndez-Samperio P. Expression and regulation of chemokines in mycobacterial infection. J Infect. 2008;57(5):374-84.
30. Nunes-Alves C, Booty MG, Carpenter SM, Jayaraman P, Rothchild AC, Behar SM. In search of a new paradigm for protective immunity to TB. Nat Rev Microbiol. 2014;12(4):289-99.
31. Lyadova IV, Panteleev AV. Th1 and Th17 Cells in Tuberculosis: Protection, Pathology, and Biomarkers. Mediators Inflamm. 2015;2015:854507.
32. Ozen S, Balci B, Ozkara S, Ozcan A, Yilmaz E, Besbas N, et al. Is there a heterozygote advantage for familial Mediterranean fever carriers against tuberculosis infections: speculations remain? Clin Exp Rheumatol. 2002;20(4 Suppl 26):S57-8.
33. Allen M, Bailey C, Cahatol I, Dodge L, Yim J, Kassissa C, et al. Mechanisms of Control of Mycobacterium tuberculosis by NK Cells: Role of Glutathione. Front Immunol. 2015;6:508. doi: 10.3389/fimmu.2015.00508.
34. Paquin-Proulx D, Costa PR, Terrassani Silveira CG, Marmorato MP, Cerqueira NB, Sutton MS, et al. Latent Mycobacterium tuberculosis Infection Is Associated With a Higher Frequency of Mucosal-Associated Invariant T and Invariant Natural Killer T Cells. Front Immunol. 2018;9:1394.
35. Braian C, Hogea V, Stendahl O. Mycobacterium tuberculosis - induced neutrophil extracellular traps activate human macrophages. J Innate Immun. 2013;5(6):591-602.
36. Walzl G, Ronacher K, Hanekom W, Scriba TJ, Zumla A. Immunological biomarkers of tuberculosis. Nat Rev Immunol. 2011;11(5):343-54.
37. Santos AFS dos, Lima AF de. Tuberculose pulmonar e a formação do granuloma: uma revisão de literatura. Ciências Biológicas e da Saúde UNIT. 2017;4(2):111-24.
38. Anton C, Machado FD, Ramirez JM, Bernardi RM, Palominos PE, Brenol CV, et al. Infecção latente por tuberculose em pacientes com doenças reumatológicas. J Bras Pneumol. 2019;45(2):e20190023.
39. Harris J, Keane J. How tumour necrosis factor blockers interfere with tuberculosis immunity. Clin Exp Immunol. 2010;161(1):1-9.
40. Sharma A, Naidu G, Sharma V, Jha S, Dhooria A, Dhir V, et al. Deficiency of Adenosine Deaminase 2 in Adults and Children: Experience From India. Arthritis Rheumatol. 2021;73(2):276-85.
41. Pontillo A, Carvalho MS, Kamada AJ, Moura R, Schindler HC, Duarte AJ, et al. Susceptibility to Mycobacterium tuberculosis infection in HIV-positive patients is associated with CARD8 genetic variant. J Acquir Immune Defic Syndr. 2013;63(2):147-51.
42. Davis JM, Ramakrishnan L. The role of the granuloma in expansion and dissemination of early tuberculous infection. Cell. 2009;136(1):37-49.
43. Elkington P, Lerm M, Kapoor N, Mahon R, Pienaar E, Huh D, et al. In Vitro Granuloma Models of Tuberculosis: Potential and Challenges. J Infect Dis. 2019;219(12):1858-66.
44. Silva DR, Rabahi MF, Sant'Anna CC, Silva-Junior JLRD, Capone D, Bombarda S, et al. Diagnosis of tuberculosis: a consensus statement from the Brazilian Thoracic Association. J Bras Pneumol. 2021;47(2):e20210054.
45. Machado A Jr, Emodi K, Takenami I, Finkmoore BC, Barbosa T, Carvalho J, et al. Analysis of discordance between the tuberculin skin test and the interferon-gamma release assay. Int J Tuberc Lung Dis. 2009;13(4):446-53.
46. Jacobs AJ, Mongkolsapaya J, Screaton GR, McShane H, Wilkinson RJ. Antibodies and tuberculosis. Tuberculosis (Edinb). 2016;101:102-13.
47. Takenami I, de Oliveira CC, Petrilli JD, Machado A, Riley LW, Arruda S. Serum antiphospholipid antibody levels as biomarkers for diagnosis of pulmonary tuberculosis patients. Int J Tuberc Lung Dis. 2018;22(9):1063-70.
48. Encinales L, Zuñiga J, Granados-Montiel J, Yunis M, Granados J, Almeciga I, et al. Humoral immunity in tuberculin skin test anergy and its role in high-risk persons exposed to active tuberculosis. Mol Immunol. 2010;47(5):1066-73.
49. Scriba TJ, Coussens AK, Fletcher HA. Human Immunology of Tuberculosis. Microbiol Spectr. 2017;5(1).
50. Lu LL, Chung AW, Rosebrock TR, Ghebremichael M, Yu WH, Grace PS, et al. A Functional Role for Antibodies in Tuberculosis. Cell. 2016;167(2):433-443.e14.
51. Rijnink WF, Ottenhoff THM, Joosten SA. B-Cells and Antibodies as Contributors to Effector Immune Responses in Tuberculosis. Front Immunol. 2021;12:640168.
52. Young DB, Perkins MD, Duncan K, Barry CE. Confronting the scientific obstacles to global control of tuberculosis. J Clin Invest. 2008;118(4):1255-65.
53. O'Garra A, Redford PS, McNab FW, Bloom CI, Wilkinson RJ, Berry MPR. The immune response in tuberculosis. Annu Rev Immunol. 2013;31:475-527.
54. Peresi E, Silva SMUR, Calvi SA, Marcondes-Machado J. Citocinas e proteínas de fase aguda do soro como marcadores de regressão da resposta inflamatória ao tratamento da tuberculose pulmonar. J Bras Pneumol. 2008;34:942-9.
55. Hozumi H, Tsujimura K, Yamamura Y, Seto S, Uchijima M, Nagata T, et al. Immunogenicity of dormancy-related antigens in individuals infected with Mycobacterium tuberculosis in Japan. Int J Tuberc Lung Dis. 2013;17(6):818-24.
56. Bertholet S, Horne DJ, Laughlin EM, Savlov M, Tucakovic I, Coler RN, et al. Effect of chemotherapy on whole-blood cytokine responses to Mycobacterium tuberculosis antigens in a small cohort of patients with pulmonary tuberculosis. Clin Vaccine Immunol. 2011;18(8):1378-86.
57. Berry MP, Graham CM, McNab FW, Xu Z, Bloch SA, Oni T, et al. An interferon-inducible neutrophil-driven blood transcriptional signature in human tuberculosis. Nature. 2010;466(7309):973-7.
58. Dorhoi A, Yeremeev V, Nouailles G, Weiner J 3rd, Jörg S, Heinemann E, et al. Type I IFN signaling triggers immunopathology in tuberculosis-susceptible mice by modulating lung phagocyte dynamics. Eur J Immunol. 2014;44(8):2380-93.
59. McNab FW, Ewbank J, Howes A, Moreira-Teixeira L, Martirosyan A, Ghilardi N, et al. Type I IFN induces IL-10 production in an IL-27-independent manner and blocks responsiveness to IFN-γ for production of IL-12 and bacterial killing in Mycobacterium tuberculosis-infected macrophages. J Immunol. 2014;193(7):3600-12.
60. Ottenhoff TH, Dass RH, Yang N, Zhang MM, Wong HE, Sahiratmadja E, et al. Genome-wide expression profiling identifies type 1 interferon response pathways in active tuberculosis. PLoS One. 2012;7(9):e45839.



