Número Atual: Abril-Junho 2022 - Volume 6 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Alergia alimentar não IgE mediada: proctocolite induzida por proteínas alimentares - Atualização
Non-IgE mediated food allergy: food protein-induced allergic proctocolitis - An update
José Luiz Magalhães Rios1,2,3; Sandra Maria Epifânio Bastos Pinto1,4; Liziane Nunes de Castilho Santos1,4; Eliane Miranda da Silva1,5; Natalia Rocha do Amaral Estanislau1,6; Maria Fernanda Andrade Melo e Araujo Motta1,7; Flavia de Carvalho Loyola1,2
DOI: 10.5935/2526-5393.20220023
1. Associação Brasileira de Alergia e Imunologia - Regional Rio de Janeiro (ASBAI-RJ), Comissão de Alergia Alimentar - Rio de Janeiro, RJ, Brasil
2. Faculdade de Medicina de Petrópolis - Centro Universitário Arthur Sá Earp Neto - UNIFASE, Alergia e Imunologia - Petrópolis, RJ, Brasil
3. Hospital Central do Exército, Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
4. Instituto Nacional de Saúde da Mulher, da Criança e do Adolescente Fernandes Figueira IFF/FIOCRUZ, Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
5. Hospital Universitário Gaffree e Guinle - Universidade Federal do Estado do Rio de Janeiro (UNIRIO), Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
6. Hospital Universitário Pedro Ernesto - Universidade do Estado do Rio de Janeiro (UERJ), Pediatria - Rio de Janeiro, RJ, Brasil
7. Instituto de Puericultura e Pediatria Martagão Gesteira - IPPMG - Universidade Federal do Rio de Janeiro (UFRJ), Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
José Luiz Magalhães Rios
E-mail: jlrios.alergia@gmail.com
Submetido em: 23/01/2022
Aceito em: 01/03/2022
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
Nas últimas décadas observa-se aumento na prevalência mundial de alergia alimentar, que já acomete aproximadamente 6% das crianças, atribuído à interação entre fatores genéticos, ambientais e alterações na resposta imunológica e pode envolver reações mediadas por IgE, não mediadas e mistas. As formas não IgE mediadas decorrem de reação de hipersensibilidade tardia, mediada por linfócitos T e afetam prioritariamente o trato gastrointestinal, como a Síndrome da enterocolite induzida por proteína alimentar (FPIES), Síndrome da proctocolite alérgica induzida por proteína alimentar (FPIAP), Síndrome da enteropatia induzida por proteína alimentar (FPE) e doença celíaca. As características destas reações podem ser diferenciadas por sua apresentação clínica, gravidade, idade de início e história natural. Entre as reações alérgicas aos alimentos não IgE mediadas, a proctocolite alérgica é a mais frequente. Geralmente ocorre no primeiro ano de vida e apresenta excelente prognóstico. Embora costume ter um curso benigno, traz grande preocupação aos cuidadores por frequentemente cursar com quadro de hematoquezia exigindo diagnóstico diferencial adequado. O conhecimento e manejo da proctocolite alérgica é de suma importância para a prática médica em Alergia e Imunologia. Seu diagnóstico é baseado na história clínica seguindo-se dieta de exclusão, especialmente do leite de vaca, com subsequente provocação oral, que geralmente pode ser realizada no domicílio. O diagnóstico preciso é importante, para se evitar dietas de exclusão desnecessárias. Nesta revisão foram utilizados artigos publicados nos últimos anos, com busca realizada através da base PubMed envolvendo revisões, diagnóstico e tratamento de alergias não IgE mediadas, com foco em proctocolite alérgica.
Descritores: Hipersensibilidade alimentar, diarreia infantil, hemorragia gastrointestinal, hipersensibilidade ao leite, aleitamento materno.
INTRODUÇÃO
As reações alérgicas aos alimentos têm sido tema de intensa discussão e pesquisa entre os especialistas. Nas duas últimas décadas observou-se uma elevação da prevalência, com dados variando entre diversos estudos, provavelmente devido a diferenças na metodologia dos mesmos, incluindo diferentes definições de alergia alimentar (AA) e hábitos alimentares das áreas geográficas estudadas1. Sua ocorrência e expressão clínica dependem da interação entre fatores genéticos, ambientais e alterações na resposta imunológica. Acomete aproximadamente 6% das crianças, sendo mais comum em menores de 3 anos. Em adultos estima-se prevalência de 3,5%1,2. A história familiar associada de atopia ainda é o maior indicativo de risco para seu aparecimento. Recente estudo no Brasil verificou que entre os 604 pacientes com relato de AA, 4% tiveram diagnóstico confirmado de alergia alimentar3. Outro estudo no Brasil mostrou incidência de alergia à proteína do leite de vaca (APLV) de 2,2%, e prevalência de 5,4% em crianças com idade ≤ 24 meses4. O conhecimento e manejo desta condição se torna, portanto, de suma importância para a prática clínica em Alergia e Imunologia.
A alergia alimentar com manifestações gastrointestinais decorre da exposição contínua à proteína alimentar, que promove uma inflamação por mecanismos imunológicos distintos. Pode ter diferentes formas de apresentação, dependendo do mecanismo e do local predominantemente envolvido.
CLASSIFICAÇÃO
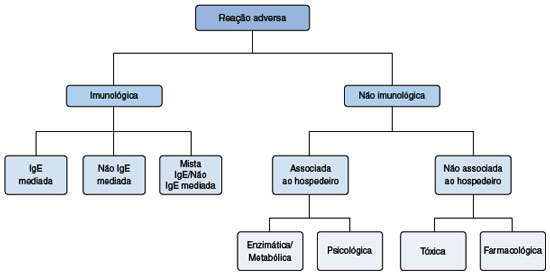
As reações alérgicas aos alimentos são respostas imunológicas exacerbadas à ingestão de alimentos que ocorrem em um hospedeiro suscetível5. Essas reações podem ser classificadas, de acordo com o tipo de resposta imune aos antígenos ingeridos, em mediadas por imunoglobulina E (IgE), não mediadas por IgE, e mistas6 (Figura 1).
As reações mediadas por IgE normalmente se manifestam por sintomas ocorridos pouco tempo após a ingesta do alimento, normalmente envolvendo a pele (urticária, angioedema), trato respiratório (tosse, sibilância, congestão nasal), sistema cardiovascular (hipotensão), podendo ainda se apresentar como quadro de anafilaxia1.
As reações mistas têm a participação do anticorpo IgE, linfócitos T e citocinas. Manifestam-se como gastropatias eosinofílicas (esofagite eosinofílica, gastrite eosinofílica, gastroenterite eosinofílica), dermatite atópica e asma7.
As reações alérgicas aos alimentos não mediadas por IgE ocorrem sem a participação da IgE específica e são decorrentes de uma reação de hipersensibilidade do tipo tardia, mediada por linfócitos T5,8. Se expressam por patologias que afetam diversos órgãos, como o trato gastrointestinal, como a Síndrome da enterocolite induzida por proteína alimentar (Food Protein Induced Enterocolitis Syndrome - FPIES), a Síndrome da proctocolite alérgica induzida por proteína alimentar (Food Protein Induced Allergic Proctocolitis - FPIAP), a Síndrome da enteropatia induzida por proteína alimentar (Food Protein Induced Enteropathy - FPE) e a doença celíaca. A pele pode ser acometida nos casos de dermatite de contato a alimentos e dermatite herpetiforme, além dos pulmões na Síndrome de Heiner ou hemossiderose pulmonar (Figura 2). A expressão dos sintomas e da gravidade depende do segmento do trato gastrointestinal afetado9. A doença celíaca e a anemia por deficiência de ferro induzida por alergia ao leite de vaca também são classificadas como reações não-IgE mediadas, mas não serão discutidas nesta revisão6.
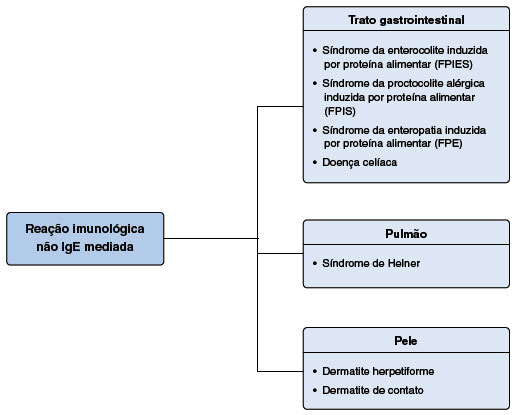
Figura 2
Reações adversas aos alimentos imunológicas não mediadas por IgE
Adaptado de Sampson HA8.
FORMAS DE APRESENTAÇÃO DAS ALERGIAS NÃO IGE MEDIADAS
As principais manifestações gastrointestinais da alergia alimentar não IgE mediada têm expressões clínicas semelhantes e sobrepostas, mas que podem ser diferenciadas com base em suas características clínicas típicas, gravidade, idade de início e história natural10.
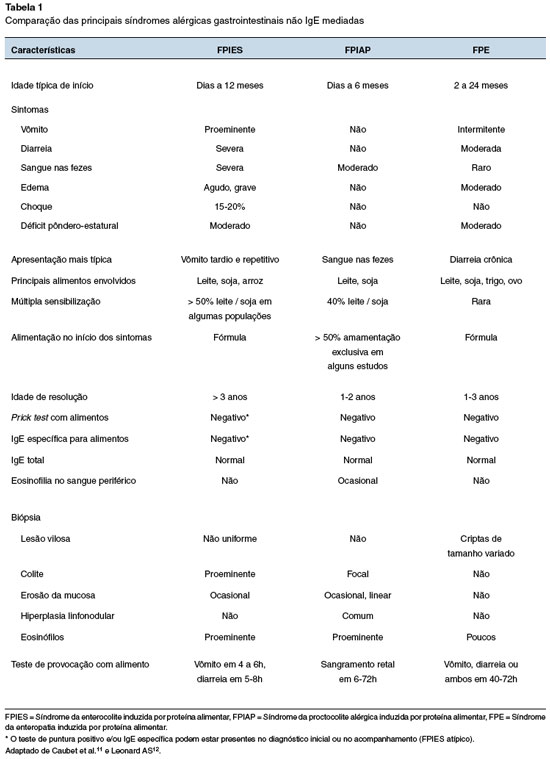
A Tabela 1 mostra um quadro comparativo entre as três principais formas de alergia alimentar não IgE mediadas: FPIES, FPIAP e FPE.
Síndrome da proctocolite induzida por proteína alimentar - FPIAP
A FPIAP, também denominada proctocolite alérgica, é uma forma de alergia alimentar não mediada por IgE, que surge nos primeiros seis meses de vida, sendo mais frequente entre a primeira e a quarta semanas após o nascimento13. Manifesta-se frequentemente com sangue e muco nas fezes em lactentes saudáveis. Mais raramente podem ocorrer vômito e diarreia. O início é geralmente insidioso, com um período latente prolongado após a introdução do alimento, embora raramente o início possa ser agudo, dentro de 12 horas após o primeiro contato14.
É uma condição benigna e transitória, que não interfere no crescimento da criança mesmo quando o alimento causal permanece na dieta e o sangramento continua, embora possa evoluir com anemia14.
Em 60% dos casos de hematoquezia no lactente a causa é a proctocolite alérgica15. Ela pode acometer crianças em aleitamento materno. Na verdade, aproximadamente 60% dos casos de proctocolite ocorre em lactentes em aleitamento materno16. O leite de vaca (LV) é o principal alimento causal, embora vários alimentos, como soja, ovo, trigo e outros, possam ser excretados no leite materno após a ingestão pela mãe e consequentemente possam ser considerados como possíveis agentes. Lactentes alimentados com fórmulas contendo LV ou soja também podem apresentar proctocolite alérgica; inclusive as fórmulas extensamente hidrolisadas de LV, que podem levar ao aparecimento de sintomas em até 10% dos casos16.
Síndrome da enterocolite induzida por proteína alimentar - FPIES
A FPIES ocorre predominantemente em lactentes entre 2 e 7 meses de idade, associada à introdução de fórmulas lácteas e alimentos sólidos11. Raramente ocorre em crianças alimentadas exclusivamente ao seio materno, em crianças maiores e adultos17. Em 65 a 80% dos casos a FPIES é causada por um único alimento, principalmente LV ou soja. Outros agentes envolvidos incluem ovo e cereais, particularmente arroz e aveia18.
A expressão clínica da FPIES é influenciada pelo protocolo de introdução de alimentos sólidos no lactente, frequência e tipo de alérgeno alimentar introduzido na dieta, nas diferentes regiões geográficas18.
A FPIES é dividida em dois fenótipos: agudo e crônico. A forma aguda é a mais comum e em geral ocorre pela ingestão acidental, ou reexposição ao alimento causal após período de dieta de restrição. Manifesta-se por vômitos incoercíveis, letargia e palidez, que iniciam-se 1 a 4 horas após a ingestão do alimento implicado19. Em 15% dos casos pode evoluir para sintomas sistêmicos graves que incluem hipotermia, hipotensão, podendo evoluir para choque hipovolêmico20. A diarreia pode ocorrer em 5 a 10 horas e frequentemente representa uma forma mais grave de FPIES. A forma aguda também é vista em crianças maiores ou adultos, quando o alimento causal não é um alimento básico e é consumido apenas ocasionalmente. Em adultos, geralmente está associada à ingestão de crustáceos12. Crianças com FPIES desencadeada pelas proteínas do LV e de soja, habitualmente tornam-se tolerantes por volta dos 2 a 3 anos de idade, ao passo que as formas desencadeadas por alimentos sólidos costumam ter evolução mais prolongada11,18.
A FPIES crônica é pouco frequente e se caracteriza pela persistência de sintomas, que apesar de serem menos intensos do que os da forma aguda, podem ser graves. Os sintomas mais relatados são êmese, diarreia (com ou sem sangue), letargia, desidratação, distensão abdominal e déficit de crescimento. Nestas situações deve-se buscar o diagnóstico diferencial com doenças inflamatórias intestinais12,19.
Síndrome de enteropatia induzida por proteína alimentar - FPE
A FPE é caracterizada por diarreia crônica e dor abdominal recorrente, que podem evoluir com perda de peso e atraso no crescimento em até 20% dos casos. Fezes com sangue geralmente estão ausentes, mas sangue oculto pode estar presente em 5% dos pacientes21. Tem início entre 2 e 9 meses de idade, associada à introdução de fórmula de LV, e menos frequentemente da soja, ovo e trigo. A FPE é um distúrbio transitório com resolução em torno de 1 a 3 anos de idade. A exclusão do alimento causal, seguido de reintrodução após 4-8 semanas, auxilia no diagnóstico22.
Cólica do lactente
A cólica infantil pode ser considerada uma doença de ordem funcional em bebês de 1 a 4 meses, que se manifesta com dor abdominal tipo cólica, entre 4 e 6 semanas de vida e regride por volta das 12 semanas23. É uma condição autolimitada, caracterizada por períodos recorrentes e prolongados de choro incessante24. Os paroxismos de choro ocorrem especialmente no final da tarde e início da noite, sem causa aparente. Recente revisão sistemática demonstrou taxa de prevalência variando de 2 a 73%, com mediana de 17,7%25. Menos de 5% dos lactentes com cólica e choro excessivo têm uma causa subjacente26.
A fisiopatologia da cólica infantil não é completamente compreendida, embora muitas hipóteses sejam propostas, como imaturidade intestinal, hipermotilidade, controle autonômico instável, alterações na microbiota intestinal, fatores relacionados ao sistema nervoso central, ciclo do sono e psicossociais (por exemplo, a ansiedade dos pais, que pode ser agravada por inexperiência e falta de apoio)27.
A presença da cólica infantil, em combinação com dermatite atópica, alteração das fezes, colite com sangramento retal, ou DRGE, pode estar relacionada à APLV em lactentes em aleitamento materno exclusivo28. A associação entre alergia alimentar e a cólica infantil ainda é controversa. Porém, há evidências que demonstram que as respostas alérgicas da mucosa podem alterar a motilidade intestinal e as vias nociceptivas, para causar hiperalgesia visceral28,29. A microbiota intestinal estimula a maturação do sistema imunológico, a aquisição de tolerância e o desenvolvimento e a função do sistema nervoso entérico [RHEE]. Estudos sugerem que uma microbiota intestinal aberrante possa afetar a função motora intestinal, a produção de gases e, assim, gerar dor abdominal30,31.
Na APLV o aumento na produção de citocinas pró-inflamatórias e compostos neurotóxicos afetam o sistema nervoso entérico e causam disfunção peristáltica e alteração da percepção de estímulos fisiológicos, como distensão intestinal e peristaltismo, que passam a ser percebidos como eventos dolorosos32.
Não há ensaios clínicos robustos que demonstrem a eficácia da dieta de restrição aos antígenos alimentares em lactentes com cólica33. Na presença de cólica mais grave, associada à presença de outros sintomas gastrointestinais e história pessoal de dermatite atópica, a dieta de exclusão terapêutica pode ser iniciada, de acordo com o tipo de alimentação11,28. Em lactentes alimentados com fórmulas à base do leite de vaca, estas podem ser substituídas por fórmulas com proteínas extensamente hidrolisadas do leite de vaca por duas semanas. Em caso de melhora clínica, a dieta de restrição deve ser continuada. Porém, na ausência de benefício após duas semanas, as restrições alimentares devem ser suspensas28. Em lactentes em amamentação, a eliminação do LV por duas a quatro semanas da dieta materna é recomendada22. Na presença de uma resposta clínica evidente, a dieta de restrição deve ser mantida10.
Refluxo gastroesofágico
O refluxo gastroesofágico (RGE) é definido como a passagem retrógrada e involuntária do conteúdo gástrico para o esôfago23. Em recém-nascidos a termo e pré-termo, o refluxo é usualmente um processo benigno, de natureza autolimitada e sem complicações. É considerado como parte da fisiologia e maturação gastrointestinal nessa fase da vida e, por isso, denominado de refluxo fisiológico. O pico de incidência do RGE fisiológico ocorre aos quatro meses de vida, e 95% dos lactentes já não regurgitam mais aos 12 a 14 meses de idade34. Quando o RGE está associado a outros sintomas clínicos ou complicações, como dificuldade de alimentação e deglutição, dificuldade em ganhar peso ou perda ponderal, deficiência de crescimento, anemia, hemorragia digestiva, manifestações respiratórias e otorrinolaringológicas, entre outras, passa a ser denominado de doença do refluxo gastroesofágico (DRGE)34.
A prevalência de RGE e da DRGE varia de acordo com a população, o desenho do estudo (transversal ou longitudinal) e os critérios diagnósticos (sinais/sintomas ou questionário validado). Estima-se que na idade de pico do RGE, em torno de 2-4 meses, as taxas de prevalência variem entre 67% e 87%35-37 e que sejam 21% entre 6 e 7 meses de idade36. Recente revisão sistemática demonstrou que em crianças de até 18 meses, os sintomas da DRGE estão presentes diariamente em 25% dos bebês, com redução na gradativa e desaparecimento quase completo dos sintomas aos 12 meses de idade38. No Brasil, Costa A.J.F. e cols. observaram que a prevalência de DRGE em 2004, era de 11,15% (89/798; IC 95%: 9,10-13,48), sendo maior nos dois primeiros trimestres de vida: 14,62% no primeiro e 13,76% no segundo39.
Diversas estruturas contribuem para a barreira antirrefluxo: o esfíncter esofágico inferior (EEI), o ângulo de His, o ligamento freno-esofágico, o diafragma crural e a roseta gástrica. A imaturidade dos mecanismos de barreira antirrefluxo próprias do período neonatal contribuem para maior incidência de RGE40. O mesmo está geralmente associado a relaxamentos transitórios do esfíncter esofágico inferior (EEI), sendo influenciado por fatores genéticos, ambientais, anatômicos, hormonais e neurogênicos41. O principal mecanismo responsável para evitar o desenvolvimento da DRGE é a manutenção da função adequada da barreira antirrefluxo localizada na junção esofagogástrica41. Dentre os mecanismos responsáveis pela disfunção da junção esofagogástrica estão os relaxamentos transitórios do EEI, a redução do tônus do EEI e a distorção anatômica na junção esofagogástrica40.
Os sintomas de RGE e DRGE ocorrem devido tanto ao volume, quanto ao conteúdo ácido do material refluído e, por algumas vezes, a distinção entre eles é difícil40,42. Na DRGE, o contato mais prolongado do ácido gástrico com a mucosa do esôfago intensifica o fluxo sanguíneo local e promove liberação de prostaglandina E2, que aumenta a permeabilidade da mucosa ao ácido, perpetuando o processo inflamatório e a presença de sintomas e complicações, como apneia, agravamento de quadro pulmonar, irritabilidade, alteração do sono, intolerância/má aceitação da dieta, estridor, desenvolvimento/ganho ponderal inadequados, postura anormal com arqueamento posterior, náuseas, hematêmese, aspiração de conteúdo gástrico para vias respiratórias40.
A DRGE pode estar associada à APLV, contudo, essa associação ainda não foi estabelecida. Entretanto, recente revisão narrativa verificou uma associação de APLV com DRGE em 16-56% dos casos suspeitos de DRGE, com persistência dos sintomas gastrointestinais até que houvesse exclusão do LV, independente do aleitamento materno ou fórmula43. Lactentes com APLV apresentam regurgitação e vômitos indistinguíveis daqueles associados ao RGE fisiológico ou DRGE, podendo a regurgitação ser a única manifestação. Esta similaridade de sintomas entre a APLV e RGE/DRGE dificulta na distinção da etiologia do quadro, principalmente na ausência de outros sinais de alergia, como dermatite atópica ou sangramento retal inexplicável nos primeiros meses de vida40.
A ausência de um sintoma específico e/ou um exame considerado padrão ouro para o diagnóstico de DRGE e APLV não mediada por IgE, além da sobreposição com outras condições funcionais e orgânicas e a resolução espontânea dos sintomas no primeiro ano de vida, tornam o diagnóstico e a discriminação entre APLV, RGE e DRGE um desafio44. Nos lactentes saudáveis com regurgitação ou naqueles que não respondem a dietas espessadas e terapia postural, a North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition (NASPGHAN) e a European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN) sugerem que nos lactentes em uso de fórmula de proteínas do LV, seja feita a substituição por fórmula extensamente hidrolisada, por 2 a 4 semanas; e para aqueles em amamentação, as mães devem ser orientadas a suspender a ingestão de proteína do LV pelo mesmo período. Se a melhora dos sintomas ocorrer após a eliminação do LV, a reintrodução do alérgeno é necessária para confirmação da alergia40.
Constipação intestinal
A constipação é frequentemente associada à consistência endurecida das fezes, ao aumento no intervalo entre as evacuações e à ocorrência de dor durante as evacuações45. É classificada como funcional na grande maioria dos casos e apenas em uma pequena proporção de pacientes pediátricos ocorre associada à alergia alimentar22.
Crianças que apresentam diminuição na frequência das evacuações nas primeiras semanas de vida ou após a introdução na dieta de produtos à base de LV devem ser investigadas para esta condição46. Nestes casos, a constipação geralmente está associada à presença de fezes endurecidas, além de esforço excessivo e prolongado na evacuação47.
A fisiopatologia da associação entre a alergia alimentar e a constipação intestinal ainda não foi totalmente esclarecida11. Apesar dos resultados dos estudos serem conflitantes, a alergia alimentar deve ser considerada no diagnóstico diferencial de crianças que apresentam constipação persistente e são resistentes ao tratamento convencional46.
O diagnóstico de constipação induzida por proteína alimentar em lactentes amamentados é baseado na melhora clínica durante a dieta de eliminação materna, seguida pela recorrência dos sintomas após a reintrodução do alimento suspeito22.
PROCTOCOLITE INDUZIDA POR PROTEÍNAS ALIMENTARES (FPIAP)
Epidemiologia
Entre as reações alérgicas aos alimentos não IgE mediadas, a proctocolite induzida por proteínas alimentares, mais conhecida como proctocolite alérgica, é a mais frequente, apesar de sua prevalência exata não ser bem estabelecida1,6. Geralmente ocorre no primeiro ano de vida e apresenta resolução nos primeiros anos48.
Embora costume ter um curso benigno, geralmente traz grande preocupação aos pais e responsáveis, e por isso merece uma atenção especial49. Em um estudo prospectivo, Martin V. e cols. observaram uma incidência acumulada de 17% ao longo de 3 anos48. Outros dados mostraram uma prevalência estimada variável, de 0,16% nos pacientes saudáveis a até 64% entre os pacientes com sangramento intestinal50-52. Estas grandes variações se devem às diferentes metodologias aplicadas entre os estudos.
Em pacientes em aleitamento materno, a maioria das reações estão relacionados ao LV, ovo e soja na dieta materna; porém, trigo, milho, maçã, peixe, carne e gergelim também já foram descritos52,53. Nos bebês alimentados com fórmula, leite e soja são os principais agentes causadores, porém fórmulas extensamente hidrolisadas foram descritas como causa de proctocolite em até 10% dos pacientes54.
Apesar de ser uma reação não IgE mediada, estudos apontam que cerca de 40-50% dos pacientes com proctocolite alérgica apresentam atopia, e em mais de 60% dos bebês se observa história familiar positiva para alergia48,52,55.
Fisiopatologia
O mecanismo fisiopatológico da proctocolite alérgica não é totalmente esclarecido, mas trata-se de uma reação não IgE mediada6,22,56.
Acredita-se que os principais fatores de risco relacionados possam ser a imaturidade do sistema imunológico inato e adaptativo, alteração da permeabilidade intestinal, susceptibilidade genética associada aos alimentos sensibilizantes e disbiose57,58.
A sensibilização a antígenos alimentares parece desempenhar um papel chave na proctocolite alérgica, associada a uma falha no mecanismo de tolerância. Alguns estudos demonstraram a participação de várias células no mecanismo de tolerância oral56,59. Pérez-Machado e cols., num estudo em crianças com alergia a múltiplos alimentos, demonstraram uma falha na produção de TGF-β pelas células reguladoras no intestino delgado60. Uma das hipóteses para este déficit na produção de TGF-β pelas células regulatórias Th3 e para o comprometimento do mecanismo de tolerância oral, seria uma resposta ineficaz da imunidade inata à microbiota do intestino61.
Outros estudos sugerem que uma alteração na composição do microbioma intestinal possa influenciar na tolerância imune pelas células T regulatórias (T-reg) e na sua homeostase. Wang J. e cols. demonstraram que estes defeitos podem comprometer diferentes vias, incluindo células Treg efetoras, defeito na expressão de CTLA4 e ICOS e menor produção de IL-10 pelas células Treg intestinais58.
Outra citocina chave no processo inflamatório intestinal seria o TNF-α. Estudos já demonstraram sua ação nas tight-junctions das células epiteliais intestinais, alterando assim a barreira intestinal e levando, consequentemente, ao aumento na permeabilidade62,63.
Histologicamente, biópsias do reto e intestino grosso de pacientes com proctocolite evidenciaram uma inflamação eosinofílica em diversas camadas48,56. Eosinófilos são células que envolvem tanto a imunidade inata quanto a adaptativa, devido a sua capacidade de interagir com células apresentadoras de antígenos e linfócitos e de produzir diversos mediadores e citocinas56. Rycyck A. e cols. demonstraram um aumento nas fezes de EDN (eosinophil-derived neurotoxin), o que até poderia representar um biomarcador nesta patologia64.
Apesar da proctocolite ser uma alergia não IgE-mediada, alguns autores evidenciaram a sensibilização a IgE num grupo minoritário de pacientes65,66.
Entretanto, são necessários maiores estudos para a melhor compreensão da patogênese e dos biomarcadores desta patologia, que permitiria melhor orientação terapêutica, avaliação quanto ao prognóstico e até mesmo quanto a diferentes tipos de fenótipos da proctocolite alérgica65,67.
Diagnóstico
O diagnóstico da proctocolite alérgica, assim como das alergias alimentares não IgE mediadas é baseado nas informações características da história clínica. Trata-se de um lactente geralmente eutrófico com adequado desenvolvimento pôndero-estatural e em ótimo estado geral, apresentando fezes com raias de sangue com ou sem muco associado13. O diagnóstico precoce associado a intervenção nutricional adequada permitirá que o bebê mantenha sua taxa de crescimento.
Os sintomas aparecem, na maioria dos pacientes, de forma gradual e persistem até que se proceda a remoção do alimento implicado13. Caso o paciente apresente outros sintomas gastrointestinais ou alterações no crescimento, deve ser considerada a possibilidade de um diagnóstico alternativo13.
O exame físico é habitualmente normal, sem lesões como fissura anal, o que ocorre frequentemente nos casos de constipação.
Não existe na literatura definição de critérios específicos para o diagnóstico de proctocolite alérgica, porém alguns dados são úteis para a elaboração da suspeita clínica. São esses11 (adaptado do EAACI - European Academy of Allergy and Clinical Immunology):
- sangramento discreto nas fezes, tipo hematoquezia, em lactente aparentemente saudável;
- resolução dos sintomas após eliminação do alérgeno/alimento implicado da dieta do bebê ou da mãe, quando em aleitamento materno exclusivo;
- recorrência dos sintomas após reintrodução do alimento implicado na dieta;
- exclusão de outras causas de hematoquezia.
A maioria dos pacientes que posteriormente reintroduzem os alimentos não apresentam sintomas novamente, demonstrando o curso favorável da proctocolite em relação à tolerância imunológica. Alguns estudos demonstram que até 20% dos bebês em aleitamento materno exclusivo tem resolução espontânea do sangramento sem mudanças na dieta materna, e que o prognóstico em longo prazo é excelente13,54,68. Diante deste cenário, e somado à observação de que episódios de sangramento retal na infância são, na maioria, autolimitados, alguns autores recentemente propuseram observar e aguardar por até 4 semanas pela resolução espontânea, sem dieta de eliminação, em lactentes amamentados exclusivamente ao seio, com risco muito baixo de desenvolvimento de anemia56.
No caso de um período de mais de um mês, sugere-se dieta de eliminação, e havendo resolução da hematoquezia, deve-se realizar o teste de provocação oral (TPO). O teste de provocação oral deve ser realizado após curto período de dieta de eliminação, em torno de 72-96 horas, para confirmação do diagnóstico11,56. Não há necessidade, entretanto, que seja realizado de forma supervisionada em ambiente hospitalar. Se o TPO for positivo, sugere-se retomar a dieta de eliminação por 3 meses11,56.
Exames não invasivos
Exames laboratoriais, como análise de sangue e fezes, incluindo análise de elementos anormais nas fezes (EAF), exame parasitológico de fezes (EPF), dosagem de alfa 1 antitripsina fecal, pesquisa de sangue oculto, ou hemoglobina humana nas fezes, não devem ser utilizados de rotina para confirmação diagnóstica de proctocolite alérgica13.
O hemograma geralmente é normal, podendo alguns pacientes apresentar anemia ferropriva13. Eosinofilia periférica pode estar presente em até 43% dos casos56. Outros marcadores inflamatórios, como elevação de PCR e trombocitose, normalmente estão ausentes56.
Os níveis de calprotectina fecal normalmente encontram-se elevados, quando comparados a controles saudáveis, indicando inflamação da mucosa intestinal. Entretanto, seu uso em menores de 1 ano de idade apresenta restrições, devido à ausência de valores normais validados. Esse exame também não tem indicação de ser solicitado rotineiramente para o diagnóstico de proctocolite alérgica, por não haver correlação positiva entre os níveis da calprotectina fecal e testes de provocação positivos, em pacientes com proctocolite56.
A coprocultura e pesquisa de coccídeos e vírus podem ser utilizadas para pesquisa de infecção subjacente56.
O uso de testes alérgicos, como prick test, patch test e dosagem de IgE sérica total apresentam validade limitada para o diagnóstico. A dosagem de IgE sérica específica pode ser considerada em pacientes em aleitamento materno que apresentem sintomas de alergia IgE mediada associados, ou naqueles que apresentem comorbidades como dermatite atópica, bem como antes da reintrodução do alimento implicado após longo período de restrição56.
A avaliação ultrassonográfica pode revelar aumento de vascularização e espessamento da parede intestinal, principalmente do cólon descendente e sigmoide, sugerindo o diagnóstico. Entretanto estes achados não são específicos de proctocolite alérgica, e a inflamação no reto e sigmoide pode não ser visualizada.
Exames invasivos
Eventualmente a etiologia do sangramento retal pode ser de origem distinta, sendo importante para o diagnóstico diferencial excluir outras patologias através da realização de exames invasivos, como endoscopia, retossigmoidoscopia ou colonoscopia56.
A avaliação endoscópica não é necessária para o diagnóstico da proctocolite alérgica. O exame pode revelar congestão da mucosa intestinal, áreas com presença de petéquias, eritema focal, perda do padrão vascular, ulceração, nodularidade difusa ou, eventualmente, se apresentar com aspecto normal56.
As alterações histológicas são caracterizadas por infiltração eosinofílica na mucosa intestinal e lâmina própria, além de hiperplasia linfoide56. A arquitetura da mucosa normalmente está preservada e o infiltrado eosinofílico se concentra tipicamente no reto, especialmente no epitélio e na camada muscular da mucosa. Por se tratar de uma doença de distribuição não uniforme, podem ser necessárias múltiplas biópsias.
Diagnóstico diferencial de sangue nas fezes
O sangramento digestivo pode se manifestar de diversas formas. O sangramento digestivo alto é aquele que ocorre em qualquer local do trato gastrointestinal proximal até o ligamento de Treitz, o que inclui esôfago, estômago e duodeno. Já o sangramento digestivo baixo ocorre nos intestinos delgado (jejuno e íleo) e grosso69.
O mesmo também pode ser classificado de acordo as características das fezes: hematoquezia corresponde à passagem de sangue vivo pelo reto e geralmente representa sangramento digestivo baixo, apesar de poder ocorrer em sangramento digestivo alto. A melena geralmente decorre de sangramento digestivo alto e é caracterizada por fezes negras. O sangramento gastrintestinal oculto é aquele que não é visível a olho nu, e pode causar sintomas como anemia por deficiência de ferro, palidez ou fadiga69.
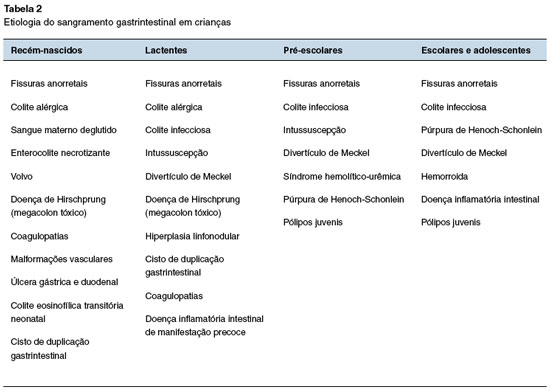
A etiologia do sangramento gastrintestinal em crianças varia com a faixa etária, conforme pode-se observar na Tabela 2.
Além das doenças listadas na Tabela 2, existem causas mais raras, como malignidades, síndrome da úlcera retal solitária, tiflite, hérnia encarcerada ou trombose mesentérica69.
A avaliação do paciente com sangramento nas fezes deve começar pela anamnese, destacando-se os seguintes pontos: duração e quantidade de sangue, aspecto das fezes e se o sangue parece estar misturado nas fezes ou apenas ao redor delas. Características como estado geral, dor abdominal, febre, perda de peso, história de hemorragias prévias, uso de medicamentos como anti-inflamatórios não-esteroidais (AINEs) e outros medicamentos, além de doenças de base, como hepatopatias ou malignidade, devem ser pesquisadas. O uso de AINEs pode causar ulcerações em todo o TGI, incluindo intestino delgado e cólon69. Além disso, alguns alimentos e medicamentos, como suplementos de ferro, gelatina e chocolate, podem alterar a coloração das fezes, mimetizando melena ou hematoquezia70.
Hematoquezia aguda em uma criança toxêmica com dor abdominal sugere isquemia intestinal como complicação de intussuscepção, volvo, hérnia encarcerada ou trombose mesentérica. Em crianças menores de 2 anos a intussuscepção deve ser a principal suspeita, podendo estar associada a divertículo de Meckel, pólipo, hiperplasia nodular linfoide, corpo estranho, linfoma, entre outros69.
Sintomas de colite, como diarreia sanguinolenta, tenesmo, evacuações noturnas e dor abdominal podem surgir em colites infecciosas ou alérgicas, além de enterocolite necrotizante e doença de Hirschprung com enterocolite69.
Como a maioria das colites infecciosas são autolimitadas e tem resolução espontânea em duas semanas, pacientes com diarreia sanguinolenta por mais de duas semanas devem ser investigados para doença inflamatória intestinal69.
Nem sempre a colite se apresenta com diarreia. Muitas vezes há sangue misturado com fezes normais. Em menores de 6 meses este achado sugere proctocolite eosinofílica ou hiperplasia nodular linfoide. Em lactentes entre 6 meses e 2 anos também pode sugerir pólipo juvenil69.
Quando o sangue não está misturado às fezes é provável que haja doença perianal, como fissura anal ou proctite69. Além disso, quando o sangue é visto principalmente no papel higiênico ou no vaso sanitário após término da evacuação, tal hipótese também é mais provável. Se ao exame físico houver fissura e eritema perianal, deve-se considerar o diagnóstico de celulite por estreptococo beta-hemolítico69.
Ao exame físico, deve-se inicialmente avaliar o estado hemodinâmico do paciente e pesquisar peritonite, sinais de hipertensão portal, além de massas abdominais.
Abordagem terapêutica
Assim como na maioria das alergias alimentares, o tratamento da proctocolite alérgica consiste na eliminação de antígenos desencadeantes com dieta de exclusão do alimento suspeito. As proteínas do LV são os alérgenos mais envolvidos71. Entretanto, ocasionalmente a eliminação conjunta de dois alimentos pode ser exigida, seguindo-se, nesse caso, exclusão de soja e ovo.
Para lactentes amamentados exclusivamente ao seio materno, a eliminação do alimento da dieta da mãe resulta em resolução dos sintomas na maioria dos casos, raramente sendo necessário o uso de fórmulas para cessar o sangramento intestinal13. A exclusão do alimento da dieta materna deve sempre ser acompanhada por nutricionista para avaliar o aporte de nutrientes adequado para a mãe e bebê, além de verificar a necessidade de suplementação11. O aleitamento materno sempre deve ser incentivado, não havendo indicação para suspender a oferta de leite materno56.
Para bebês que desenvolvem sintomas quando alimentados com fórmula infantil, 80% respondem à substituição por fórmula extensamente hidrolisada (FEH) e poucos casos necessitam de fórmula de aminoácidos (FAA)11,13,16. Fórmulas à base de proteína da soja geralmente não são recomendadas visto que a correatividade entre as proteínas do leite de vaca e da soja ocorre em 10% a 30% dos pacientes com proctocolite1.
A remoção dos alimentos causadores de proctocolite alérgica, por exclusão na dieta materna ou no lactente alimentado por fórmula, resulta em rápida melhora dos sintomas. Na maioria dos casos, dentro de 72 horas após as mudanças na dieta observa-se resolução da hematoquezia, embora o sangramento nas fezes possa se manter por até 1 a 2 semanas para os pacientes mais sintomáticos11,16.
Se após 2 semanas do início da dieta de exclusão o lactente ainda estiver sintomático, é importante verificar e adequar a exclusão do antígeno na dieta materna e, em seguida, verificar outros possíveis alimentos a serem eliminados da dieta, sugerindo-se a exclusão da soja e posteriormente do ovo56,71. Se mais de uma proteína alimentar for restringida da dieta da mãe que amamenta, novamente ressalta-se a importância da supervisão de um nutricionista para garantir aporte nutricional e para evitar a perda excessiva de peso materno1,56.
O uso de probióticos para o tratamento da proctocolite alérgica ainda carece de estudos mais elaborados para sua indicação. Um ensaio clínico randomizado não mostrou nenhum benefício em relação ao uso de um probiótico, além da dieta materna, em pacientes com proctocolite16. Outro estudo com evidências muito limitadas sugere que o probiótico com Lactobacillus Rhamnosus GG possa promover a recuperação ou aquisição de tolerância56.
O diagnóstico precoce e preciso de proctocolite alérgica é importante a fim de se evitar dietas de exclusão desnecessárias que possam ter efeitos prejudiciais à saúde. O suporte nutricional se faz imprescindível para evitar deficiência nutricional materna ou nos bebês com proctocolite alérgica. A avaliação da dieta por nutricionista objetiva proporcionar substituições alimentares que garantam aporte adequado de vitaminas e minerais, incluindo principalmente cálcio, vitamina D, zinco e selênio. A suplementação desses nutrientes nem sempre é obrigatória se há uma adequação da alimentação1.
Prognóstico e reintrodução alimentar
A história natural da proctocolite alérgica é benigna e a maioria das crianças afetadas supera essa condição ainda no 1º ano de vida. A proctocolite alérgica raramente persiste entre o 1º e 2º ano de vida22.
Uma coorte prospectiva, acompanhando 185 crianças com proctocolite para avaliar os possíveis fatores associados ao desenvolvimento da tolerância mostrou que 99,4% dos pacientes adquiriu tolerância com a idade mediana de 11 meses (10 a 13 meses). No entanto, num grupo de 57 crianças, 33% somente conseguiram ingerir o alimento causador entre os 12 e os 19 meses. Os principais fatores relacionados a essa aquisição de "tolerância tardia" foram: retardo na introdução da alimentação complementar, concomitância de dermatite atópica, atopia familiar e a ingesta de fórmula infantil láctea (pelo menos 1 vez)67.
No estudo de Martin V. M. e cols., acompanhando 153 pacientes com diagnóstico de proctocolite alérgica, foi observado que a idade média para reintrodução bem-sucedida do alimento causador era em torno dos 11 meses. Nesse estudo, 15% dos pacientes não fizeram nenhuma restrição dietética e, apesar da exposição continuada ao alimento, desenvolveram tolerância aos alimentos envolvidos ao longo da infância, no entanto, alguns destes em idade mais tardia48.
Apesar do caráter benigno e resolução completa, um estudo sugere que a proctocolite poderia ser um fator de risco para o desenvolvimento de desordens gastrointestinais funcionais (DGIF), numa fase mais tardia da infância. A DGIF caracteriza-se por distúrbio da motilidade intestinal e hipersensibilidade visceral (síndrome do intestino irritável). O maior tempo de duração da hematoquezia seria o principal fator associado à presença desses sintomas já aos quatro anos de idade72.
Embora classicamente não-IgE mediada, alguns casos de proctocolite podem apresentar-se com IgE específica para o alimento causal, ou virem a desenvolver sintomas IgE-mediados ao longo da evolução, especialmente as crianças que apresentam dermatite atópica concomitante. Por esse motivo, embora não seja recomendado dosar a IgE específica para o alimento na maioria dos casos de proctocolite, a EAACI (European Academy of Allergy and Clinical Immunology) recomenda que, nas crianças com dermatite atópica associada, seja feita a dosagem de IgE específica antes da reintrodução do alimento causal, após longos períodos de exclusão22.
Com base nesse aspecto, estudo recente de Cetinkayanet P. G. e cols. sugere que poderiam existir três fenótipos de proctocolite, de acordo com a presença ou o desenvolvimento de IgE específica ao alimento suspeito. Há um fenótipo sem sensibilização IgE para o alimento em questão, um segundo fenótipo com sensibilização IgE, porém sem presença de sintomas IgE mediados, outro com IgE específica positiva e evolução para a forma clínica IgE mediada. Os autores observaram que os indivíduos com o fenótipo de "transição para a forma IgE mediada" alcançariam a tolerância mais tardiamente que as outras duas formas. Esses achados, porém, precisam ser confirmados por mais estudos65.
Por ser benigna e autolimitada, a reintrodução alimentar do alimento suspeito pode ser conduzida no domicílio, gradativamente, sob orientação do médico, quando este considerar que a criança, provavelmente, já tenha alcançado a tolerância, que costuma ocorrer até os 11-12 meses de idade para a maioria dos pacientes1,22,48.
Se o diagnóstico não foi tão preciso e a presença de sangue nas fezes tiver sido de leve intensidade, a reintrodução alimentar pode ser tentada mais precocemente, dado o caráter transitório da doença1. Alguns autores sugerem ainda que a introdução alimentar precoce de outros alimentos, a partir dos 4 meses e meio, poderia acelerar o desenvolvimento da tolerância ao leite em crianças com proctocolite alérgica48.
REFERÊNCIAS
1. Labrosse R, Graham F, Caubet J-C. Non-IgE-Mediated Gastrointestinal Food Allergies in Children: An Update. Nutrients. 2020 Jul 14;12(7):2086.
2. Nwaru BI, Hickstein L, Panesar SS, Roberts G, Muraro A, Sheikh A, et al. Prevalence of common food allergies in Europe: a systematic review and meta-analysis. Allergy. 2014;69(8):992-1007.
3. Gonçalves LCP, Guimarães TCP, Silva RM, Cheik MFA, de Ramos Nápolis AC, Barbosa E Silva G, et al. Prevalence of food allergy in infants and pre-schoolers in Brazil. Allergol Immunopathol (Madr). 2016;44(6):497-503.
4. Vieira MC, Morais MB, Spolidoro JV, Toporovski MS, Cardoso AL, Araujo GT, et al. A survey on clinical presentation and nutritional status of infants with suspected cow' milk allergy. BMC Pediatr. 2010;10:25.
5. Tordesillas L, Berin MC, Sampson HA. Immunology of Food Allergy. Immunity. 2017;47(1):32-50.
6. Solé D, Silva LR, Cocco RR, Ferreira CT, Sarni RO, Oliveira LC, et al. Consenso Brasileiro sobre Alergia Alimentar: 2018 - Parte 1 - Etiopatogenia, clínica e diagnóstico. Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associação Brasileira de Alergia e Imunologia. Arquivos de Asma, Alergia e Imunologia. 2018;2(1):7-38.
7. Calvani M, Anania C, Cuomo B, D'Auria E, Decimo F, Indirli GC, et al. Non-IgE- or Mixed IgE/Non-IgE-Mediated Gastrointestinal Food Allergies in the First Years of Life: Old and New Tools for Diagnosis. Nutrients. 2021;13(1):226.
8. Sampson HA. Food allergy: Past, present and future. Allergol Int. 2016;65(4):363-9.
9. Moore LE, Stewart PH, deShazo RD. Food Allergy: What We Know Now. The American Journal of the Medical Sciences. 2017;353(4):353-66.
10. Abrams EM, Hildebrand KJ, Chan ES. Non-IgE-mediated food allergy: Evaluation and management. Paediatr Child Health. 2021;26(3):173-81.
11. Caubet J-C, Szajewska H, Shamir R, Nowak-Wegrzyn A. Non-IgE-mediated gastrointestinal food allergies in children. Pediatr Allergy Immunol. 2017;28(1):6-17.
12. Leonard SA. Non-IgE-mediated Adverse Food Reactions. Curr Allergy Asthma Rep. 2017;17(12):84.
13. Mehr S, Brown-Whitehorn T. What do allergists in practice need to know about non-IgE-mediated food allergies. Ann Allergy Asthma Immunol. 2019;122(6):589-97.
14. Lozinsky AC, Morais MB de. Eosinophilic colitis in infants. J Pediatr (Rio J). 2014;90(1):16-21.
15. Maloney J, Nowak-Wegrzyn A. Educational clinical case series for pediatric allergy and immunology: allergic proctocolitis, food protein-induced enterocolitis syndrome and allergic eosinophilic gastroenteritis with protein-losing gastroenteropathy as manifestations of non-IgE-mediated cow's milk allergy. Pediatr Allergy Immunol. 2007;18(4):360-7.
16. Nowak-Wegrzyn A, Katz Y, Mehr SS, Koletzko S. Non-IgE-mediated gastrointestinal food allergy. J Allergy Clin Immunol. 2015;135(5):1114-24.
17. Bingemann TA, Sood P, Järvinen KM. Food Protein-Induced Enterocolitis Syndrome. Immunol Allergy Clin North Am. 2018 Feb;38(1):141-52.
18. Ruffner MA, Ruymann K, Barni S, Cianferoni A, Brown-Whitehorn T, Spergel JM. Food protein-induced enterocolitis syndrome: insights from review of a large referral population. J Allergy Clin Immunol Pract. 2013;1(4):343-9.
19. Nowak-Wegrzyn A, Jarocka-Cyrta E, Moschione Castro A. Food Protein-Induced Enterocolitis Syndrome. J Investig Allergol Clin Immunol. 2017;27(1):1-18.
20. Nowak-Wegrzyn A, Chehade M, Groetch ME, Spergel JM, Wood RA, Allen K, et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary-Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2017;139(4):1111-1126.e4.
21. Sampson HA, Aceves S, Bock SA, James J, Jones S, Lang D, et al. Food allergy: a practice parameter update-2014. J Allergy Clin Immunol. 2014;134(5):1016-1025.e43.
22. Meyer R, Chebar Lozinsky A, Fleischer DM, Vieira MC, Du Toit G, Vandenplas Y, et al. Diagnosis and management of Non-IgE gastrointestinal allergies in breastfed infants-An EAACI Position Paper. Allergy. 2020;75(1):14-32.
23. Zeevenhooven J, Koppen IJN, Benninga MA. The New Rome IV Criteria for Functional Gastrointestinal Disorders in Infants and Toddlers. Pediatr Gastroenterol Hepatol Nutr. 2017;20(1):1-13.
24. Benninga MA, Faure C, Hyman PE, St James Roberts I, Schechter NL, Nurko S. Childhood Functional Gastrointestinal Disorders: Neonate/Toddler. Gastroenterology. 2016;S0016-5085(16)00182-7.
25. Vandenplas Y, Abkari A, Bellaiche M, Benninga M, Chouraqui JP, Çokura F, et al. Prevalence and Health Outcomes of Functional Gastrointestinal Symptoms in Infants From Birth to 12 Months of Age. J Pediatr Gastroenterol Nutr. 2015;61(5):531-7.
26. Freedman SB, Al-Harthy N, Thull-Freedman J. The crying infant: diagnostic testing and frequency of serious underlying disease. Pediatrics. 2009;123(3):841-8.
27. Dubois NE, Gregory KE. Characterizing the Intestinal Microbiome in Infantile Colic: Findings Based on an Integrative Review of the Literature. Biol Res Nurs. 2016;18(3):307-15.
28. Nocerino R, Pezzella V, Cosenza L, Amoroso A, Di Scala C, Amato F, et al. The controversial role of food allergy in infantile colic: evidence and clinical management. Nutrients. 2015;7(3):2015-25.
29. Rhee SH, Pothoulakis C, Mayer EA. Principles and clinical implications of the brain-gut-enteric microbiota axis. Nat Rev Gastroenterol Hepatol. 2009;6(5):306-14.
30. Savino F, Cordisco L, Tarasco V, Calabrese R, Palumeri E, Matteuzzi D. Molecular identification of coliform bacteria from colicky breastfed infants. Acta Paediatr. 2009;98(10):1582-8.
31. Savino F, Ceratto S, De Marco A, Cordero di Montezemolo L. Looking for new treatments of Infantile Colic. Ital J Pediatr. 2014;40:53.
32. Murch S. Allergy and intestinal dysmotility - evidence of genuine causal linkage? Curr Opin Gastroenterol. 2006;22(6):664-8.
33. Gordon M, Biagioli E, Sorrenti M, Lingua C, Moja L, Banks SS, et al. Dietary modifications for infantile colic. Cochrane Database Syst Rev. 2018;10:CD011029.
34. Forbes D. Mewling and puking: infantile gastroesophageal reflux in the 21st century. J Paediatr Child Health. 2013;49(4):259-63.
35. Vandenplas Y, Rudolph CD, Di Lorenzo C, Hassall E, Liptak G, Mazur L, et al. Pediatric gastroesophageal reflux clinical practice guidelines: joint recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition (NASPGHAN) and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN). J Pediatr Gastroenterol Nutr. 2009;49(4):498-547.
36. Nelson SP, Chen EH, Syniar GM, Christoffel KK. Prevalence of symptoms of gastroesophageal reflux during childhood: a pediatric practice-based survey. Pediatric Practice Research Group. Arch Pediatr Adolesc Med. 2000;154(2):150-4.
37. Martin AJ, Pratt N, Kennedy JD, Ryan P, Ruffin RE, Miles H, et al. Natural history and familial relationships of infant spilling to 9 years of age. Pediatrics. 2002 Jun;109(6):1061-7.
38. Singendonk M, Goudswaard E, Langendam M, van Wijk M, van Etten-Jamaludin F, Benninga M, et al. Prevalence of Gastroesophageal Reflux Disease Symptoms in Infants and Children: A Systematic Review. J Pediatr Gastroenterol Nutr. 2019;68(6):811-7.
39. Costa AJF, Silva GAP, Gouveia PAC, Pereira Filho EM. [Prevalence of pathologic gastroesophageal reflux in regurgitant infants]. J Pediatr (Rio J). 2004;80(4):291-5.
40. Rosen R, Vandenplas Y, Singendonk M, Cabana M, DiLorenzo C, Gottrand F, et al. Pediatric Gastroesophageal Reflux Clinical Practice Guidelines: Joint Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr. 2018;66(3):516-54.
41. Vandenplas Y, Hauser B. An updated review on gastro-esophageal reflux in pediatrics. Expert Rev Gastroenterol Hepatol. 2015;9(12):1511-21.
42. Eichenwald EC, Committee on Fetus and Newborn. Diagnosis and Management of Gastroesophageal Reflux in Preterm Infants. Pediatrics. 2018;142(1):e20181061.
43. Salvatore S, Agosti M, Baldassarre ME, D'Auria E, Pensabene L, Nosetti L, et al. Cow's Milk Allergy or Gastroesophageal Reflux Disease-Can We Solve the Dilemma in Infants? Nutrients. 2021;13(2):297.
44. D'Auria E, Salvatore S, Acunzo M, Peroni D, Pendezza E, Di Profio E, et al. Hydrolysed Formulas in the Management of Cow's Milk Allergy: New Insights, Pitfalls and Tips. Nutrients. 2021 Aug 12;13(8):2762.
45. Loening-Baucke V. Prevalence, symptoms and outcome of constipation in infants and toddlers. J Pediatr. 2005;146(3):359-63.
46. Tabbers MM, DiLorenzo C, Berger MY, Faure C, Langendam MW, Nurko S, et al. Evaluation and treatment of functional constipation in infants and children: evidence-based recommendations from ESPGHAN and NASPGHAN. J Pediatr Gastroenterol Nutr. 2014;58(2):258-74.
47. Heine RG. Allergic gastrointestinal motility disorders in infancy and early childhood. Pediatr Allergy Immunol. 2008;19(5):383-91.
48. Martin VM, Virkud YV, Seay H, Hickey A, Ndahayo R, Rosow R, et al. Prospective Assessment of Pediatrician-Diagnosed Food Protein-Induced Allergic Proctocolitis by Gross or Occult Blood. J Allergy Clin Immunol Pract. 2020;8(5):1692-1699.e1.
49. Ben-Shoshan M. Food Protein-Induced Allergic Proctocolitis: Over- or Underdiagnosed? J Allergy Clin Immunol Pract. 2020;8(5):1700-1.
50. Arvola T, Ruuska T, Keränen J, Hyöty H, Salminen S, Isolauri E. Rectal Bleeding in Infancy: Clinical, Allergological, and Microbiological Examination. Pediatrics. 2006;117(4):e760-8.
51. Xanthakos SA, Schwimmer JB, Melin-Aldana H, Rothenberg ME, Witte DP, Cohen MB. Prevalence and outcome of allergic colitis in healthy infants with rectal bleeding: a prospective cohort study. J Pediatr Gastroenterol Nutr. 2005;41(1):16-22.
52. Barni S, Giovannini M, Mori F. Epidemiology of non-IgE-mediated food allergies: what can we learn from that? Curr Opin Allergy Clin Immunol. 2021;21(2):188-94.
53. Erdem SB, Nacaroglu HT, Karaman S, Erdur CB, Karkıner CU, Can D. Tolerance development in food protein-induced allergic proctocolitis: Single centre experience. Allergologia et Immunopathologia. 2017;45(3):212-9.
54. Nowak-Wegrzyn A. Food protein-induced enterocolitis syndrome and allergic proctocolitis. Allergy Asthma Proc. 2015;36(3):172-84.
55. Lucarelli S, Di Nardo G, Lastrucci G, D'Alfonso Y, Marcheggiano A, Federici T, et al. Allergic proctocolitis refractory to maternal hypoallergenic diet in exclusively breast-fed infants: a clinical observation. BMC Gastroenterol. 2011;11:82.
56. Mennini M, Fiocchi AG, Cafarotti A, Montesano M, Mauro A, Villa MP, et al. Food protein-induced allergic proctocolitis in infants: Literature review and proposal of a management protocol. World Allergy Organ J. 2020;13(10):100471.
57. Tsabouri S, Nicolaou N, Douros K, Papadopoulou A, Priftis KN. Food Protein Induced Proctocolitis: A Benign Condition with an Obscure Immunologic Mechanism. Endocr Metab Immune Disord Drug Targets. 2017;17(1):32-7.
58. Wang J, Zheng S, Yang X, Huazeng B, Cheng Q. Influences of non-IgE-mediated cow's milk protein allergy-associated gut microbial dysbiosis on regulatory T cell-mediated intestinal immune tolerance and homeostasis. Microb Pathog. 2021;158:105020.
59. Chehade M, Mayer L. Oral tolerance and its relation to food hypersensitivities. Journal of Allergy and Clinical Immunology. 2005;115(1):3-12.
60. Pérez-Machado MA, Ashwood P, Thomson MA, Latcham F, Sim R, Walker-Smith JA, et al. Reduced transforming growth factor-ß1-producing T cells in the duodenal mucosa of children with food allergy. European Journal of Immunology. 2003;33(8):2307-15.
61. van Wijk F, Nierkens S, de Jong W, Wehrens EJM, Boon L, van Kooten P, et al. The CD28/CTLA-4-B7 Signaling Pathway Is Involved in Both Allergic Sensitization and Tolerance Induction to Orally Administered Peanut Proteins. J Immunol. 2007;178(11):6894-900.
62. Ozen A, Gulcan EM, Ercan Saricoban H, Ozkan F, Cengizlier R. Food Protein-Induced Non-Immunoglobulin E-Mediated Allergic Colitis in Infants and Older Children: What Cytokines Are Involved? Int Arch Allergy Immunol. 2015;168(1):61-8.
63. Morita H, Nomura I, Orihara K, Yoshida K, Akasawa A, Tachimoto H, et al. Antigen-specific T-cell responses in patients with non-IgE-mediated gastrointestinal food allergy are predominantly skewed to TH2. Journal of Allergy and Clinical Immunology. 2013;131(2):590-592.e6.
64. Rycyk A, Cudowska B, Lebensztejn DM. Eosinophil-Derived Neurotoxin, Tumor Necrosis Factor Alpha, and Calprotectin as Non-Invasive Biomarkers of Food Protein-Induced Allergic Proctocolitis in Infants. J Clin Med. 2020;9(10):E3147.
65. Cetinkaya PG, Ocak M, Sahiner UM, Sekerel BE, Soyer O. Food protein-induced allergic proctocolitis may have distinct phenotypes. Ann Allergy Asthma Immunol. 2021;126(1):75-82.
66. Buyuktiryaki B, Kulhas Celik I, Erdem SB, Capanoglu M, Civelek E, Guc BU, et al. Risk Factors Influencing Tolerance and Clinical Features of Food Protein-induced Allergic Proctocolitis. J Pediatr Gastroenterol Nutr. 2020;70(5):574-9.
67. Cetinkaya PG, Kahveci M, Karaatmaca B, Esenboga S, Sahiner UM, Sekerel BE, et al. Predictors for late tolerance development in food protein-induced allergic proctocolitis. Allergy Asthma Proc. 2020;41(1):e11-8.
68. Elizur A, Cohen M, Goldberg MR, Rajuan N, Cohen A, Leshno M, et al. Cow's milk associated rectal bleeding: a population based prospective study. Pediatr Allergy Immunol. 2012;23(8):766-70.
69. Boyle JT. Gastrointestinal bleeding in infants and children. Pediatr Rev. 2008;29(2):39-52.
70. Silber G. Lower gastrointestinal bleeding. Pediatr Rev. 1990;12(3):85-93.
71. Antonella C. Non-IgE Mediated Food Allergy. Current Pediatric Reviews. 2020;16(2):95-105.
72. Di Nardo G, Cremon C, Frediani S, Lucarelli S, Villa MP, Stanghellini V, et al. Allergic Proctocolitis Is a Risk Factor for Functional Gastrointestinal Disorders in Children. J Pediatr. 2018;195:128-133.e1