Número Atual: Abril-Junho 2022 - Volume 6 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Larissa Silva Brandão
- Janaina Michelle Lima Melo
- Gabriela Andrade Dias
- Eli Mansour
- Rozana de Fátima Gonçalves
- Carolina Tavares De-Alcântara
- Fernanda Lugao Campinhos
- Daniela Farah Teixeira Raeder
- Leila Vieira Borges Trancoso-Neves
- Régis de Albuquerque Campos
- Solange Oliveira Rodrigues Valle
- Rosana Câmara Agondi
- Alfeu Tavares Franca
- Luis Felipe Chiaverini Ensina
ARTIGO ESPECIAL
Guia prático de urticária para grupos especiais de pacientes
Practical guide to urticaria for special patient groups
Larissa Silva Brandão1; Janaina Michelle Lima Melo2; Gabriela Andrade Dias3; Eli Mansour4; Rozana de Fátima Gonçalves5; Carolina Tavares De-Alcântara6; Fernanda Lugao Campinhos7; Daniela Farah Teixeira Raeder8; Leila Vieira Borges Trancoso-Neves9; Régis de Albuquerque Campos10; Solange Oliveira Rodrigues Valle11; Rosana Câmara Agondi12; Alfeu Tavares Franca13; Luis Felipe Chiaverini Ensina1
DOI: 10.5935/2526-5393.20220021
1. Universidade Federal de São Paulo (UNIFESP), Ambulatório de Alergia e Imunologia Clínica - São Paulo, SP, Brasil
2. Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto, Serviço de Alergia e Imunologia - Ribeirão Preto, SP, Brasil
3. Universidade do Estado do Rio de Janeiro, Serviço de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
4. Faculdade de Ciências Médicas, Universidade Estadual de Campinas (UNICAMP), Alergia e Imunologia, Departamento de Clínica Médica - Campinas, SP, Brasil
5. Alergodiagnóstico - Belo Horizonte, MG, Brasil
6. DermAlergo Clinic - Belém, PA, Brasil
7. Hospital Santa Casa de Misericórdia de Vitória, Centro de Referência em Asma, Alergia e Imunologia - Vitória, ES, Brasil
8. Hospital Regional da Asa Norte, Secretaria de Saúde do Distrito Federal, Unidade de Alergia e Imunologia - Brasília, DF, Brasil
9. Complexo Universitário Prof. Edgar Santos da Universidade Federal da Bahia, Ambulatório de Urticária - Salvador, BA, Brasil
10. Faculdade de Medicina da Bahia, Universidade Federal da Bahia, Departamento de Medicina Interna, Apoio Diagnóstico e Pós-graduação em Ciências da Saúde - Salvador, BA, Brasil
11. Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro, Serviço de Imunologia - Rio de Janeiro, RJ, Brasil
12. HC-FMUSP, Serviço de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
13. Faculdade de Medicina da Universidade Federal do Rio de Janeiro, Presidente Vitalício ASBAI - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Larissa Silva Brandão
E-mail: larissbrando@gmail.com
Submetido em: 24/02/2022
Aceito em: 06/03/2022
RESUMO
A urticária crônica é uma condição que afeta mais de um milhão de brasileiros, com grande impacto na qualidade de vida. Mesmo com diretrizes bem difundidas para o seu diagnóstico e tratamento, seu manejo pode ser desafiador em pacientes pediátricos, idosos e gestantes. Para auxiliar o médico especialista nestes casos, o Departamento Científico de Urticária da Associação Brasileira de Alergia e Imunologia elaborou esta revisão com as principais dúvidas e dificuldades referentes ao tema nestes grupos de pacientes.
Descritores: Urticária crônica, criança, idoso, gravidez, lactação.
INTRODUÇÃO
A urticária é uma condição caracterizada pela presença de urticas, angioedema, ou ambos, que pode ser classificada de acordo com o tempo de duração em aguda, quando persiste por menos de 6 semanas, ou crônica, quando por mais de 6 semanas1. Apesar de haver consenso para o diagnóstico e tratamento1,2, seu manejo pode ser desafiador até para o especialista, quando se trata de pacientes pertencentes a grupos menos estudados na literatura, como as crianças, idosos e gestantes.
Pensando nas dificuldades e principais dúvidas relacionadas à urticária nestes grupos "especiais", o departamento científico de Urticária da Associação Brasileira de Alergia e Imunologia (ASBAI) elaborou este guia de perguntas e respostas para auxiliar o médico especialista em sua prática clínica.
CRIANÇAS
1. Quais as principais causas de urticária aguda e crônica na infância?
A urticária aguda na infância é causada principalmente por infecções virais, mas também por reações de hipersensibilidade (relacionadas principalmente aos alimentos e medicamentos). Muitas vezes não é possível identificar se existe ou não um desencadeante específico para os sintomas, e parte destes casos evolui para a forma crônica espontânea. A urticária crônica espontânea não tem um desencadeante específico, e ocorre na maior parte das vezes por mecanismos de autorreatividade e/ou autoimunidade. As urticárias induzidas são aquelas desencadeadas por estímulos específicos como frio, calor, pressão, entre outros, e cujos mecanismos não estão totalmente esclarecidos.
A principal causa de urticária aguda na criança são as infecções virais, principalmente do trato respiratório superior2,3. Os microrganismos isolados mais comumente envolvidos em quadros de urticária aguda são: vírus herpes simplex tipo 1 (HSV1), vírus Epstein-Bar (EBV), adenovírus, rinovírus, citomegalovírus, parvovírus B19, vírus sincicial respiratório, rotavírus, Streptococcus beta-hemolítico do grupo A e Mycoplasma pneumoniae4-6.
Em menor frequência, a urticária aguda pode ser causada por reações de hipersensibilidade a alimentos, drogas, veneno de insetos, látex e meios de contraste5-7. Entretanto, o diagnóstico etiológico deve ser corroborado por uma história clínica consistente com reação de hipersensibilidade, e confirmada por testes cutâneos, dosagem de IgE sérica específica e/ou teste de provocação para evitar que o paciente seja rotulado erroneamente como alérgico. Muitas vezes a urticária aguda pode ocorrer de forma espontânea, quando não existe relação causa-efeito com agentes específicos2,3 .
Cerca de 20% das urticárias crônicas em crianças estão relacionadas a desencadeantes específicos - urticárias induzidas - sendo as mais frequentes as urticárias ao frio, colinérgica e dermografismo sintomático8-10.
Infecções virais, bacterianas e parasitárias foram reportadas como agravantes ou causadores de UC em crianças com uma frequência que varia de 0 a 37,8%8. Porém, a confirmação da relação causal dessas infecções nos pacientes com UC requer cautela, pois muitos casos remitem devido ao curso natural da UC e não têm relação com o tratamento da infecção3,8.
2. Existe diferença na prevalência da urticária crônica em crianças quando comparada a adultos e entre os gêneros?
A prevalência da UC pode ser ligeiramente maior em crianças do que em adultos, mas sem preferência por gênero.
Atualmente poucos dados estão disponíveis acerca da epidemiologia da urticária crônica em crianças. Em metanálise recente, quando avaliada a prevalência pontual de UC em crianças de 0 a 19 anos, esse índice foi ligeiramente maior (0,73% a 1,97%) do que em adultos (0,8%). Porém, não houve diferença significante na prevalência entre meninos e meninas9. Na Europa, a prevalência na infância variou de 1,1% a 1,5%, sendo numericamente maior em faixas etárias mais velhas (7 a 17 anos) em comparação com os mais novos (0 a 6 anos)11. Ainda não há dados de prevalência da urticária crônica em crianças na população brasileira.
3. Qual a idade de início da UCE em crianças? Pode acontecer no lactente?
A UCE pode acontecer em qualquer idade, mas a mediana de idade de início dos sintomas nos estudos com crianças variou entre 6 e 8 anos.
Com base em dados de prevalência internacional, a UCE é o tipo de UC mais comum em crianças (78%)3. Entretanto, informações sobre a idade de início da UCE nessa faixa etária ainda são escassos. A maioria dos estudos de prevalência em crianças incluiu lactentes, mas demonstraram que a prevalência de UC em crianças até 6 anos é menor quando comparada à de crianças mais velhas11. No Canadá, a mediana de idade de início da doença em crianças foi aos 6 anos, mas na análise de subgrupo específico por faixa etária, a mediana foi de 1,5 ano entre os menores de 4 anos10. No Brasil, em uma análise retrospectiva de crianças com UC em seguimento, a mediana de idade de início dos sintomas foi de 8 anos12.
4. Existe diferença na apresentação clínica da UCE em comparação aos adultos?
A apresentação clínica da UCE em crianças é semelhante à dos adultos, porém a frequência de angioedema é variável em diferentes populações.
De maneira geral, a apresentação clínica da UCE é semelhante à dos adultos, porém a frequência de angioedema em crianças parece ser menor em estudos internacionais, variando de 5% a 30%10,11,13. Por outro lado, em crianças brasileiras acompanhadas em dois centros de referência em urticária, a presença de angioedema foi relatada como 59,2%12.
5. Qual a patogênese da UCE na infância? É diferente dos adultos?
A teoria mais aceita atualmente é que a patogênese da UCE envolva mecanismos de autorreatividade, tanto nos adultos, como nas crianças.
O evento principal da patogênese de qualquer urticária é a degranulação dos mastócitos após estímulo por múltiplos desencadeantes, que resulta na liberação de histamina e outros mediadores inflamatórios. Entretanto, na UCE não há um desencadeante externo que promova a degranulação dos mastócitos11.
Existem poucos dados na literatura no que se refere aos mecanismos da urticária crônica espontânea (UCE) na infância. No entanto, é muito provável que a degranulação dos mastócitos ocorra por mecanismos autoimunes, assim como ocorre nos adultos11.
A teoria mais aceita atualmente é que fatores sorológicos desencadeiam a ativação dos mastócitos, como a presença de autoanticorpos IgG contra a IgE ou seu receptor, e IgE autorreativa contra diferentes antígenos, como a IL-24 e a peroxidase da tireoide14,15.
O estímulo inicial para a produção desses autoanticorpos capazes de ativar os mastócitos de forma crônica ainda é motivo de estudos, mas quadros infecciosos e outras doenças autoimunes poderiam justificar a evolução da UCE. Infecções virais agudas têm sido propostas como um potencial fator patogênico, pois produzem autoanticorpos que eventualmente podem ser altos, doença-específicos, patogênicos, e desencadear uma doença autoimune crônica10,16.
Estudos em crianças com UCE relataram mecanismo autoimune em pelo menos metade dos casos17-19. Um estudo que comparou dados de adultos e crianças brasileiras com UCE não documentou diferença significativa na prevalência de autoimunidade entre os grupos, o que corrobora a hipótese de que a patogênese é semelhante nas diferentes faixas etárias20. Além disso, a autoimunidade pode estar relacionada com uma resolução mais precoce e espontânea da urticaria crônica em crianças10.
6. Como deve ser feita a abordagem diagnóstica da UC na infância? É necessário a investigação complementar com IgE sérica específica ou teste de puntura (prick-test)?
A abordagem diagnóstica de urticária crônica na infância é semelhante à dos adultos. A investigação complementar com IgE sérica específica ou teste de puntura (prick-test) não é necessária e deve ser individualizada conforme a história clínica.
A anamnese detalhada é o primeiro passo da abordagem diagnóstica dos casos de urticária crônica, não importa a idade. Na história deve-se questionar a frequência e a duração das lesões (urticas são fugazes, duram menos de 24 horas no mesmo local e não deixam cicatrizes), a presença de angioedema associado ou isolado, história de atopia, outras comorbidades, e associação com sintomas sistêmicos, como febre, artralgia, astenia, mialgia, diarreia, queixas álgicas, entre outros. A história de lesões fixas, que duram mais de 24 horas, involuem com lesões residuais, ou são associadas a sintomas sistêmicos, deve sugerir outro diagnóstico, como a urticária vasculite e as síndromes autoinflamatórias2,21.
Apesar de menos frequente, a associação com possíveis desencadeantes também devem ser questionadas, particularmente os hábitos alimentares e os medicamentos em uso. Porém, quando a história não sugere uma relação temporal entre a exposição a um alérgeno específico e o início da urticária, não é recomendada a realização de testes alérgicos para alimentos, inalantes, aditivos ou medicamentos. Da mesma forma, se a história sugere relação de causa-efeito, a investigação apropriada para o alérgeno suspeito deve ser realizada, seja com IgE sérica específica, teste cutâneo ou restrição do alérgeno com posterior teste de provocação8. É válido lembrar que a restrição de qualquer alérgeno suspeito deveria resultar na resolução do quadro da urticária crônica. Se isso não ocorrer, a UCE deve ser considerada.
Nos quadros suspeitos de UC induzida, questionar em que circunstâncias a urticária aparece, ou qual estímulo específico induz o aparecimento das lesões. A suspeita de uma urticária induzida deve sempre ser confirmada com o teste específico. Se não for possível identificar um estímulo específico para o surgimento das lesões, considera-se o diagnóstico de UCE1,21.
Independente da faixa etária, os exames recomendados na investigação da urticária crônica são hemograma, proteína C-reativa (PCR) ou velocidade de hemossedimentação (VHS), para descartar outras doenças, especialmente as infecciosas. O consenso atual também sugere solicitar na investigação o anticorpo anti-TPO e a IgE total, uma vez que seus resultados podem auxiliar no manejo dos quadros de UCE. O teste do soro autólogo pode ser realizado para a triagem de autoanticorpos em casos selecionados, conforme a história clínica1.
A investigação de infecções, como H. pylori, parasitoses, vírus e outras bactérias deve ser individualizada conforme história ou testes laboratoriais sugestivos. A pesquisa de parasitas e protozoários é sugerida apenas em crianças que vivem em áreas endêmicas, como o Brasil, mas com sintomas gastrointestinais associados e contagem alta de eosinófilos no hemograma3,8.
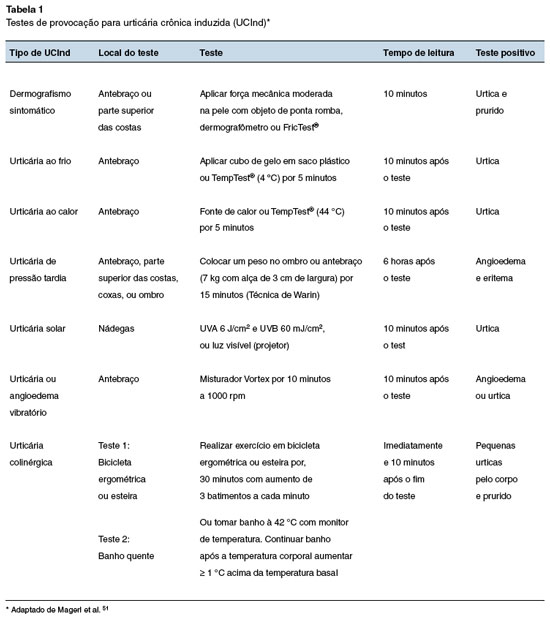
7. Qual tipo de urticária induzida é mais comum em crianças? Há diferença na técnica de realização dos testes de provocação para UCInd nesta faixa etária?
O dermografismo sintomático é o tipo mais comum de UCInd em crianças, seguido pela urticária ao frio e pela urticária colinérgica. Os testes de provocação são realizados de forma semelhantes aos dos adultos19,22,23.
Em estudo recente na Turquia com 117 crianças com UCInd, o dermografismo sintomático foi o mais comum (65%), e teve melhor prognóstico quando comparado com outros subtipos de UCInd (40% de remissão em 5 anos). A urticária colinérgica foi o tipo com pior prognóstico, com dominância masculina e níveis basais de triptase sérica mais elevados23. No estudo de Miles e cols., a urticária ao frio e a colinérgica foram os subtipos mais frequentes22. Outros subtipos de UCInd, como a solar, pressão-tardia e aquagênica, foram menos comuns nos estudos com população pediátrica19,22,23. Os testes de provocação são realizados da mesma forma que nos adultos e estão listados na Tabela 1.
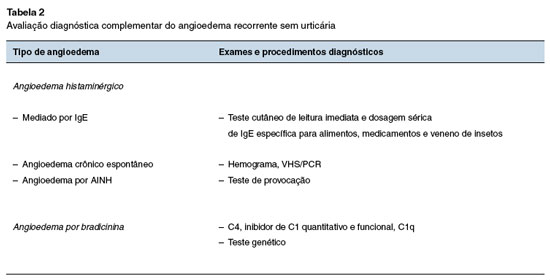
8. Como abordar a criança com angioedema recorrente sem urticária?
O diagnóstico de angioedema é clínico e uma anamnese detalhada associada ao exame físico ajudarão no diagnóstico etiológico na maioria dos casos. Exames complementares devem ser individualizados conforme a história clínica.
Para uma adequada abordagem do angioedema recorrente é importante questionar na anamnese a idade de início, a localização, se uni ou bilateral, simetria, se existe associação com prurido e/ou urticária, a frequência, duração dos episódios, fatores desencadeantes (alimento, medicamento, picada de inseto, exercício, trauma, etc.), infecções recentes, antecedentes familiares de angioedema, assim como a resposta aos tratamentos prévios com anti-histamínicos e/ou corticosteroides. A partir dessas informações, é possível classificar o angioedema por endótipo e estabelecer a via principal de mecanismo patogênico24:
- via histaminérgica: por ativação dos mastócitos com liberação de histamina, leucotrienos e prostaglandinas, e outros mediadores. Esta é a via mais comum entre as crianças. Neste grupo se enquadram os angioedemas alérgicos (por alimentos, picadas de insetos, medicamentos, látex, entre outros); e o angioedema induzido por anti-inflamatórios não esteroidais (AINEs), cujo principal mecanismo de hipersensibilidade é a inibição da cicloxigenase;
- via da bradicinina: nesta via, se destaca tanto o angioedema por inibidores da enzima de conversão da angiotensina (IECA) quanto o angioedema hereditário e adquirido por deficiência do inibidor de C1. É importante pesquisar se há presença de história familiar de angioedema, início na infância/adolescência, dor abdominal recorrente, aparecimento de edema das vias aéreas superiores, ausência de resposta a anti-histamínico, corticosteroides ou adrenalina, presença de pródromos antes do aparecimento do edema e/ou ausência de urticas;
- causas diversas: mais frequente em adultos do que em crianças. As causas mais comuns incluem infecções virais (Herpes Simplex, Coxsackie A e B, Hepatite B, Epstein-Barr), bacterianas (otite média aguda, sinusite aguda, amigdalite aguda e infeção urinária), e outras doenças mais raras na infância, como vasculites, tireoidites autoimunes e o angioedema idiopático. Sempre considerar diagnósticos diferenciais como dermatites de contato, infecções de pele, linfedemas, doenças autoimunes e tireoidianas, parasitoses, a síndrome de Melkersson-Rosenthal, e, no caso de edema intestinal, outras causas como infarto mesentérico, vasculite, e doença inflamatória intestinal25.
9. Quais ferramentas de avaliação de qualidade de vida, controle e gravidade da urticária podem ser utilizadas em crianças?
Poucas ferramentas são validadas para uso em crianças, com exceção do questionário de qualidade de vida, que tem um modelo específico para essa faixa etária (CDLQI - Escore de Qualidade de Vida em Dermatologia Infantil).
O UAS7 (Urticaria Activity Score ou Escore de atividade da urticária, em sete dias), é uma ferramenta prospectiva que avalia diariamente a atividade da urticária durante sete dias antes da consulta, baseado no número de lesões e na intensidade do prurido. Devido à necessidade de preenchimento diário pelo paciente, o UAS7 foi validado apenas para maiores de 18 anos. Eventualmente pode ser usado em crianças maiores, com preenchimento auxiliado por responsável; porém sua interpretação deve ser feita com critério26.
O Urticaria Control Test ou Teste de Controle da Urticária (UCT) avalia retrospectivamente o controle da urticária nas últimas quatro semanas por meio de quatro perguntas respondidas pelo paciente no momento da consulta. Também não foi validado em crianças, mas no estudo original foram incluídos pacientes com menos de 20 anos e pode ser utilizado em adolescentes bem instruídos27,28.
Similar ao UAS7, o Escore de Atividade do Angioedema (AAS) é uma ferramenta de avaliação prospectiva apenas para angioedema, composta de cinco perguntas, que devem ser respondidas diariamente por quatro semanas consecutivas antes da consulta. Entretanto, foi validado apenas em adultos, e sua aplicabilidade em crianças pode ser um pouco mais complicada29.
Os questionários de qualidade de vida em urticária (CU-Q2oL) e angioedema (AE-QoL) avaliam fatores do cotidiano, e podem ser aplicados durante a consulta. Ambos foram validados apenas em pacientes adultos30,31. Entretanto, o Escore de Qualidade de Vida em Dermatologia Infantil (CDLQI) e a Escala de Gravidade de Prurido em Crianças e Adolescentes (ISS-Ped) foram criados para avaliar a qualidade de vida de crianças entre 4 e 16 anos, e a gravidade do prurido em crianças de 2 a 18 anos, respectivamente. Apesar de não serem específicas, essas escalas podem auxiliar no seguimento de crianças com UC32,33.
10. Quais diagnósticos diferenciais devem ser pensados na criança com quadros urticariformes?
Nas crianças, sempre lembrar da urticária vasculite e das doenças autoinflamatórias.
Na urticária vasculite se observam lesões fixas, que duram mais de 24 horas no mesmo local, com sensação de queimação, prurido discreto e hiperpigmentação residual. Pode ser classificada como primária (idiopática) ou secundária a medicamentos, infecções e doenças reumatológicas. É subclassificada em normo e hipocomplementêmica; esta última com sintomas sistêmicos e associação com doenças reumatológicas. A biópsia cutânea é necessária para o diagnóstico34,35.
Já as doenças autoinflamatórias devem ser suspeitadas principalmente quando há sintomas sistêmicos inflamatórios associados a febre persistente ou recorrente3,34. A urticária é uma característica presente nas três síndromes periódicas associadas às criopirinas (Criopirinopatias). As criopirinopatias representam um espectro de três doenças que compartilham várias características, mas diferem em gravidade (em ordem crescente): Síndrome Familiar Inflamatória Associada ao Frio (FCAS), Síndrome Muckle-Wells e a Desordem Inflamatória Neonatal Multissistêmica (NOMID) ou Síndrome CINCA (crônico-infantil-neurológica-cutânea-articular). Os casos são caracterizados por episódios recorrentes de urticária neutrofílica (frequentemente o primeiro sintoma), associados a artralgia, mialgia, cefaleia, febre e perda auditiva neurossensorial. Acometimento ocular, como conjuntivite, ceratite e uveíte, pode ser observado nos três subtipos. As exacerbações do quadro podem ser desencadeadas por frio, pequenos traumas ou estresse, e a duração dos ataques varia de aproximadamente 12 horas (na FCAS) até 1 a 3 dias (na Muckle-Wells e CINCA/NOMID). No espectro mais grave (a CINCA/NOMID), o quadro inicia no período neonatal, com rash urticariforme, febre, artropatia com dismorfias, acometimento do sistema neurológico (como atraso do desenvolvimento, convulsões, hidrocefalia, meningite asséptica e elevação da pressão intracraniana), evoluindo para cronicidade na adolescência e idade adulta34,36.
Apesar de não terem a urticária como característica marcante, as próximas síndromes devem ser lembradas durante a infância. Na febre familiar do mediterrâneo, os pacientes apresentam tipicamente uma placa eritemato-edematosa do tipo erisipeloide, bem delimitada, uni ou bilateral, na superfície anterior dos membros inferiores. Além disso, apresentam episódios de febre alta recorrente por 1 a 3 dias, astenia, monoartrite de grandes articulações, dor abdominal e serosites. Na deficiência de mevalonato-quinase (Síndrome de Hiper-IgD), os níveis de IgD são tipicamente, mas não necessariamente, elevados, e diversos tipos de lesões cutâneas podem ocorrer, inclusive urticária. Os episódios de febre costumam iniciar antes dos quatro anos de vida, além de dor abdominal, diarreia, vômitos, serosite, cefaleia, poliartralgia, hepatoesplenomegalia e cefaleia. Na Síndrome Periódica Associada ao Receptor de TNF (TRAPS), a lesão cutânea mais típica é definida como um "eritema doloroso" (placa eritematosa centrífuga e migratória associada com mialgia). Porém, em algumas ocasiões, as lesões se apresentam como placas urticariformes que frequentemente deixam uma equimose no local, além de febre recorrente, dor abdominal, envolvimento musculoesquelético e ocular36.
11. Qual é a estratégia de tratamento da UC nas crianças? Existem diferenças na resposta ao tratamento em relação aos adultos?
Segundo o consenso internacional, para crianças é indicado o mesmo esquema terapêutico dos adultos.
O tratamento da UC em crianças deve ser sempre realizado com anti-histamínicos (anti-H1) não-sedantes de 2a geração (2aG), de eficácia e segurança comprovadas na população pediátrica (cetirizina, levocetirizina, loratadina, desloratadina, fexofenadina, rupatadina e bilastina)21. Assim como nos adultos, é recomendado iniciar o tratamento com anti-H1 de 2aG em dose padrão, reavaliar o quadro em 2 a 4 semanas e, se não houver controle dos sintomas, duplicar ou até quadruplicar a dose (1º passo). Nos casos refratários aos anti-H1 de 2aG em doses quadruplicadas, está indicada a associação com Omalizumabe (2º passo), autorizado no Brasil a partir dos 12 anos de idade para UCE, ou Ciclosporina (3º passo)1.
Crianças com UCE atendidas em um centro de referência e excelência (UCARE) em São Paulo, mostraram melhor controle da doença (64,5%) e menor taxa de não resposta aos anti-H1 de 2aG (23%), quando comparadas com adultos20. Além disso, dados de crianças com UCE de regiões diferentes do Brasil (Sudeste e Nordeste) mostraram que a maioria delas (88,4%) apresentou controle dos sintomas com anti-H1 de 2aG (45% com dose padrão, 25% com dose duplicada, e 16% com dose quadruplicada)12.
Nos casos refratários aos anti-H1 de 2aG, uma série de 10 casos de crianças brasileiras com UCE em uso de Omalizumabe mostrou que a média de tempo de tratamento foi de 18,8 meses. Com relação à resposta ao Omalizumabe, 70% estavam controlados, 10% tiveram resposta parcial e 20% não responderam ao tratamento. Nenhuma criança manifestou evento adverso37.
12. Qual é o prognóstico da urticária crônica na infância?
A UCE na criança é uma doença autolimitada com prognóstico favorável na maioria dos casos, com resolução espontânea em média de 83% até 2 anos de doença.
Em estudo recente, foram analisadas 250 crianças com UCE, com duração média de sintomas de 12 a 15 meses, taxa de remissão de 83% em 2 anos, e sem relação de pior prognóstico com a associação de atopia13. Em outro estudo, a taxa de remissão foi de 72% em até 5 anos. O maior risco de não remissão foi relacionado à maior gravidade da UCE38. Em contrapartida, no Canadá, a taxa de resolução por ano da UCE em crianças foi baixa (10%), semelhante aos adultos10.
IDOSOS
1. Existem diferenças na apresentação clínica da UCE em comparação com adultos abaixo de 60 anos?
Os idosos apresentam doença com duração mais curta, menor associação com urticária crônica induzida (UCInd), angioedema, atopia e exacerbação por anti-inflamatórios não hormonais, além de menor positividade no teste do soro autólogo (TSA).
Nos Estados Unidos, a prevalência estimada de UCE em pacientes acima de 60 anos é 0,23%39. Porém, um estudo coreano demonstrou um segundo pico de prevalência entre 70 e 79 anos, possivelmente devido à presença de comorbidades relacionadas à UC em maior frequência nesta faixa etária40.
A predominância de UCE no sexo feminino é controversa nos idosos2,4,5. Além disso, a duração da doença, associação com urticária crônica induzida (UCInd), presença de angioedema e a exacerbação por AINES parece ser menor do que nos adultos abaixo de 60 anos41-43. Os idosos com UCE apresentam doenças alérgicas com menor frequência. Contudo, há maior prevalência de hipertensão, diabetes, tireoidite de Hashimoto, insuficiência renal crônica e câncer nessa faixa etária42,44. Além disso, em estudo espanhol, foi observada menor positividade do teste do soro autólogo entre os idosos, provavelmente devido à imunossenescência, além de eosinopenia nos exames laboratoriais e IgE total baixa44.
2. Quais são os principais diagnósticos diferenciais de UCE nos idosos?
Os principais diagnósticos diferenciais da UCE nos idosos são: urticária induzida por medicamentos, UCInd, urticária vasculite, síndrome de Schnitzler, dermatite urticariforme e penfigoide bolhoso.
Nos idosos, um dos diagnósticos diferenciais importantes é a urticária induzida por medicamentos, decorrente de o uso de múltiplos fármacos ser frequente nessa faixa etária. O curso recorrente, a relação temporal com o uso da medicação, e o controle da urticária com a retirada são informações que auxiliam no diagnóstico. No entanto, é necessária a confirmação por testes cutâneos ou de provocação para que medicações importantes não sejam trocadas por outras mais complexas sem real necessidade21,45.
A dermatite urticariforme caracteriza-se pela presença de pápulas eritematosas, urticariformes, muitas vezes eczematosas, pruriginosas com distribuição simétrica, geralmente no tronco, de longa duração, ocorrendo com maior frequência em pacientes idosos46.
O penfigoide bolhoso é uma doença frequente em maiores de 60 anos, que evolui com surgimento de bolhas tensas de conteúdo seroso ou hemático, localizadas principalmente em região inguinal, axilas, abdome e membros47. As bolhas tipicamente se desenvolvem dentro de uma placa eritematosa e endurada. Porém, alguns pacientes podem apresentar múltiplas placas eritematosas urticariformes, sem a presença de bolhas, e com algum grau de prurido. Nesse estágio inicial, as lesões frequentemente apresentam aparência serpiginosa, e cerca de 10-35% dos pacientes evoluem com úlceras orais antes do surgimento das lesões cutâneas. O diagnóstico de penfigoide bolhoso requer biópsia cutânea, que demonstra infiltrado superficial de linfócitos e histiócitos com enriquecimento de eosinófilos classicamente associado com as bolhas subepidérmicas. No estudo com imunofluorescência direta se observa depósito de C3 e IgG em padrão linear na membrana basal epidérmica48.
A síndrome de Schnitzler é uma doença autoinflamatória adquirida rara. Os critérios diagnósticos essenciais incluem exantema urticariforme e gamopatia monoclonal IgM ou IgG, associada a febre recorrente acima de 38 °C sem qualquer outra causa, remodelamento ósseo anormal com ou sem dor óssea, infiltrado de neutrófilos na derme na biópsia de pele, leucocitose e/ou proteína C-reativa elevada35. A idade de pico da síndrome de Schnitzler é na sexta década de vida, mas deve ser suspeitada a partir dos 40 anos nos pacientes com os critérios diagnósticos citados49,50.
A urticária vasculite e a UCInd são outros diagnósticos diferenciais já discutidos anteriormente35,51.
A urticária crônica pode estar relacionada à malignidade, mas desaparece após a cura do câncer, e essa associação é extremamente rara (estimada de 1/1.500 ou menos). Dois mecanismos possíveis podem ligar o câncer à ativação de mastócitos e UCE. O primeiro consiste na produção e liberação de sinais derivados do tumor ou estroma (como prostaglandinas, leucotrienos, fator de crescimento endotelial vascular, etc.) que promovem o acúmulo e ativação dos mastócitos; e o segundo, a produção e liberação de antígenos derivados do tumor e detectados pela IgE no sangue. Na prática, o rastreio de rotina para doenças malignas não é recomendado. Entretanto, existem quatro características da UCE que podem sugerir associação com câncer: (1) resistência aos anti-histamínicos, (2) início antes do diagnóstico do câncer (geralmente 2-8 meses); (3) resolução após o tratamento do câncer; e (4) recorrência se recidiva do câncer52. Além disso, é mandatório avaliar, pela histórica clínica, se há sinais e sintomas que indiquem a investigação, como febre e perda repentina de peso21.
3. Como realizar a abordagem diagnóstica do paciente com angioedema recorrente sem urticária com início após os 60 anos?
A abordagem diagnóstica do angioedema é igual em todas as idades, com ênfase nos medicamentos de uso contínuo e recorrente; duração, localização do angioedema e resposta ao tratamento; sinais e sintomas associados; história familiar de angioedema; exames laboratoriais e testes de provocação de acordo com a suspeita clínica (Tabela 2).
O angioedema desencadeado por medicamentos é uma causa relevante nos idosos, seja pela via da bradicinina ou por liberação de histamina. Na forma histaminérgica, os AINEs podem desencadear angioedema causado por um ou mais medicamentos com estrutura química diferentes, além de exacerbar a UCE. Esse tipo de angioedema tem evolução mais rápida e apresenta boa resposta aos anti-histamínicos e corticosteroides45.
Na forma mediada pela bradicinina, está o angioedema por IECA e outros medicamentos envolvidos no metabolismo da bradicinina, como os bloqueadores dos receptores da angiotensina II (BRA), estatinas, sacubitril, estrogênios, anti-androgênios e gliptinas. Nesses casos, o angioedema tem duração mais lenta, cerca de 3 a 5 dias, e resposta inadequada aos anti-histamínicos, corticosteroides e adrenalina. O IECA deve ser interrompido em todos os pacientes com angioedema recorrente, mesmo se o angioedema começou vários anos após o início do tratamento. As localizações mais frequentes do angioedema por IECA são face, língua, orofaringe e laringe45,53.
O angioedema adquirido com deficiência do inibidor de C1 também ocorre predominantemente em adultos e idosos, podendo ser secundário a doenças linfoproliferativas, neoplasias e colagenoses, ou por autoanticorpos contra o inibidor de C1. Não é comum os quadros de angioedema hereditário (AEH) iniciarem após os 60 anos, mas a doença pode ter começo mais precoce e o diagnóstico ser tardio54.
4. Quais são os efeitos adversos esperados no tratamento da UCE nos idosos? Existe algum cuidado especial nessa faixa etária?
Os anti-H1 de 2ªG têm bom perfil de segurança, sendo pouco ou não sedantes, mas podem causar sonolência e efeitos anticolinérgicos em alguns pacientes, principalmente naqueles com insuficiência hepática e renal. Os efeitos adversos mais relacionados ao omalizumabe são dor no local de aplicação e cefaleia. Já para a ciclosporina, são hipertensão e nefrotoxicidade. O uso de corticosteroides deve ser restrito a períodos curtos, pelos efeitos adversos potencialmente graves em idosos, como hipertensão, obesidade, osteoporose, catarata e glaucoma.
Nos idosos, o uso de múltiplos medicamentos, tanto para a UCE quanto para as outras comorbidades, aliados às modificações fisiológicas associadas ao envelhecimento, podem interferir na farmacocinética e farmacodinâmica das drogas, alterando a resposta, aumentando a interação entre os medicamentos e seus efeitos adversos55.
Os anti-H1 de 2ªG são o tratamento de primeira linha da UCE devido ao seu perfil de eficácia e segurança. Não é recomendada a utilização de anti-H1 de primeira geração devido aos efeitos anticolinérgicos e sedativos secundários à penetração no sistema nervoso central. Além disso, podem ocorrer efeitos adversos indesejáveis para o idoso, como retenção urinária, arritmias, vasodilatação periférica, hipotensão postural, midríase, mudanças de estado mental e risco de queda11.
Nos casos de controle inadequado da urticária com dose padrão de anti-H1 de 2aG por 2 a 4 semanas, a dose deve ser aumentada para até quatro vezes a recomendada em bula21. Apesar disso, existem poucos ensaios clínicos de eficácia e segurança em idosos que apoiam esta recomendação. Os anti-H1 de 2aG são habitualmente não sedantes, mas em doses aumentadas podem causar sedação, principalmente a cetirizina, a loratadina e a rupatadina. Geralmente, seus efeitos sobre o sistema nervoso central não são exacerbados após a ingestão de álcool ou outros medicamentos psicotrópicos, mas é recomendada cautela no uso11.
Não foi observada evidência de maior risco de cardiotoxicidade, mesmo com doses aumentadas de anti-H1 de 2aG. Entretanto, nos idosos deve-se atentar para as condições de maior risco, como aumento do intervalo QT, doenças cardiovasculares, hipocalemia, hipomagnesemia, uso de medicamentos que causem prolongamento do intervalo QT ou inibição do metabolismo dos anti-H1 de 2aG56.
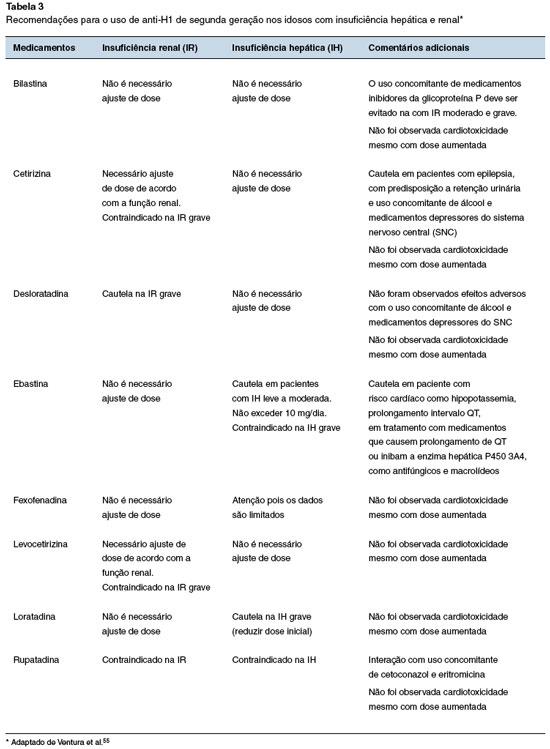
Geralmente, não é necessário ajuste da dose dos anti-H1 de 2aG em idosos, exceto quando a medicação passa por extenso metabolismo hepático em paciente com insuficiência hepática, ou o medicamento é excretado pela urina em pacientes com insuficiência renal (Tabela 3). A bilastina é o único anti-H1 de 2aG que não sofre metabolismo hepático. Porém, a cetirizina, levocetirizina e fexofenadina também são seguras devido à pequena metabolização pelo fígado. A via enzimática da desloratadina não é bem estabelecida, mas não é necessário ajuste de dose em pacientes com insuficiência hepática. A loratadina, por sua vez, tem passagem relevante pelo fígado e interação potencial com todos os inibidores das enzimas CYP3A4 e CYP2D6. Por isso, deve-se ter cautela com o uso em pacientes com doença hepática ou que usam medicamentos inibidores das enzimas citadas. Ademais, a loratadina é segura nos idosos e não requer ajuste de dose nessa faixa etária55.
Na UCE refratária à dose quadruplicada de anti-H1 de 2aG, está indicado adicionar omalizumabe na dose de 300 mg por via subcutânea a cada quatro semanas. Os efeitos adversos mais comuns são: dor no local de aplicação, cefaleia e artralgia. Não foi observada diferença na ocorrência de efeitos colaterais e resposta ao tratamento com o anti-IgE entre adultos menores de 60 anos e idosos em estudos de eficácia e segurança57,58.
Nos pacientes que não respondem em até seis meses de tratamento com omalizumabe, deve-se considerar adicionar ciclosporina ao anti-H1 de 2a G em dose quadruplicada1,21.
A eficácia da ciclosporina na UCE foi demonstrada em estudos controlados com placebo, porém existe um risco significativo da ocorrência de efeitos adversos. Seu uso deve ser cauteloso em idosos, pois podem apresentar função renal reduzida e múltiplas comorbidades. Contudo, geralmente é um medicamento seguro quando utilizado em doses de 3 mg/kg por dia. As contraindicações absolutas ao seu uso no idoso são hipertensão arterial de difícil controle, disfunção renal e linfoma de células T. As contraindicações relativas são: hipertensão arterial controlada, infecção ativa, uso concomitante de outros imunossupressores, enxaqueca e gota46.
Antes do início do tratamento, recomenda-se a realização de hemograma, função hepática e renal, ácido úrico, eletrólitos, lipidograma, parasitológico de fezes, urina I, sorologia para hepatites B e C, anti-HIV, PPD e radiografia de tórax. Durante o uso de ciclosporina, os níveis de pressão arterial sistêmica, função renal, hepática e eletrólitos devem ser monitorados mensalmente, pois os principais eventos adversos são a hipertensão arterial e a nefrotoxicidade. Podem ocorrer interações medicamentosas, com medicamentos que podem aumentar (diltiazem, verapamil, macrolídeos, amiodarona, antifúngicos, fluoxetina, corticosteroide, furosemida e diuréticos), ou reduzir (fenobarbital, carbamazepina) os níveis de ciclosporina no plasma. As vacinas com vírus vivos devem ser evitadas46.
Nas exacerbações não responsivas aos anti-H1 de 2aG, um curso rápido de corticosteroide (5-10 dias) pode ser indicado. Contudo, o uso prolongado do corticosteroide sistêmico não é recomendado pelo risco de efeitos adversos potencialmente graves em idosos, como hipertensão, obesidade, osteoporose, catarata e glaucoma59.
GESTANTES E LACTANTES
1. A urticária tende a melhorar ou piorar durante a gestação?
Acredita-se que a urticária pode melhorar durante a gestação, porém mais estudos são necessários.
A urticária não é uma doença da gravidez e, portanto, tem comportamento semelhante ao das pessoas não gestantes acometidas. Sabe-se que a urticária não é teratogênica, não afeta o desenvolvimento fetal e não altera o trabalho de parto60. O principal gatilho das crises é o estresse, e são mais frequentes nos 1º e 3º trimestre da gestação. Um estudo multicêntrico internacional (PREG-CU) sugere haver uma melhora da urticária durante a gravidez. Neste estudo, 288 mulheres gestantes responderam por questionário sobre a evolução da urticária durante a gestação. Cerca de metade das gestantes afirmaram que houve melhora dos seus sintomas, 28,9% apontaram não ter havido alteração e 20% disseram que houve piora. Após o parto, 43,8% das pacientes permaneceram com sintomas iguais, houve uma piora em cerca de 37%, e melhora em menos de 20%61.
2. Os anti-H1 2ªG estão indicados para tratamento neste grupo? É seguro aumentar a dose?
Sim, alguns anti-H1 de 2a geração são categoria B e podem ser indicados na gestação, porém o aumento da dose deve ser realizado com cautela.
Qualquer medicamento sistêmico deve ser prescrito com cuidado em grávidas, principalmente durante o primeiro trimestre. Não há relato de defeitos congênitos em mulheres que usaram anti-H1 de 2aG durante a gestação. Apesar da segurança da medicação ainda não ser totalmente estabelecida em gestantes, os anti-H1 de 2aG de categoria B são os mais indicados (cetirizina, levocetirizina, loratadina, desloratadina, bilastina). Em relação ao aumento da dosagem destes anti-H1, não há estudos de segurança e devem ser usados com cautela no período da gestação. Além disso, no caso da loratadina, deve-se lembrar que a droga é metabolizada no fígado e doses aumentadas não são indicadas (o que não se aplica à desloratadina)1.
3. Existe algum efeito adverso dos anti-H1 2aG na produção do leite materno?
Não, mas os anti-histamínicos podem ser excretados pelo leite. Portanto, apenas os de segunda geração estão indicados na lactante.
Os medicamentos atravessam o epitélio alveolar mamário e são excretados pelo leite materno. Os anti-H1 de 2aG são os mais indicados para as mulheres que estão amamentando, devido às suas propriedades não sedantes. A maioria deles é classificada como "compatíveis" na Categoria de Lactação de Hale, ou seja, são medicamentos sem relato de efeitos adversos sobre o lactente em estudos controlados com mulheres que amamentam. São eles: cetirizina, desloratadina, fexofenadina, levocetirizina e loratadina62-64.
4. É seguro usar omalizumabe durante a gestação?
Sim. O omalizumabe não é embriotóxico, teratogênico, não causa anomalias para o feto, e parece ser uma alternativa segura e eficiente para a gestante.
O omalizumabe é um anticorpo monoclonal humanizado, amplamente usado como medicação complementar na asma grave e urticária crônica que não respondem à medicação usual. Vários estudos mostram que seu uso é seguro na gestação. Não é embriotóxico, nem teratogênico e não causa anomalias congênitas21,65. Relatos de casos de mulheres que usaram omalizumabe antes e durante a gestação demonstraram que os bebês nasceram a termo e tiveram desenvolvimento normal66,67. Além disso, já foi usado em macacas gestantes, em doses até 10 vezes a recomendada nos seres humanos, sem mostrar danos ou prejuízo ao feto68. Embora não tenha sido aprovado para o tratamento de urticária na gravidez, parece ser uma alternativa segura e eficiente em pacientes refratárias ao tratamento convencional67.
5. Existe diferença na resposta ao tratamento comparado com as pacientes não gestantes?
Não. A gestação não interfere na resposta ao tratamento da urticária. O fluxograma de tratamento da urticária é o mesmo recomendado em outros grupos de pacientes.
A maioria das diretrizes nacionais e internacionais recomenda o mesmo fluxograma de tratamento da urticária em gestantes e não gestantes. Porém, há escassez de publicações científicas que abordam o manejo da urticária neste grupo, e a segurança das medicações não foi completamente estabelecida. De toda forma, é recomendado o uso da menor dose necessária para o controle completo da urticária e, semelhante a outros grupos, o objetivo do tratamento na gestação é atingir o total controle da doença11,21. Os dados a respeito do comportamento da urticária durante a gestação também são escassos, mas a UC parece ter maior probabilidade de melhora do que piora durante a gestação61. Além disso, nenhum estudo mostrou, até o momento, que a UC na gestação é mais refratária ao tratamento21.
6. É seguro usar corticosteroides em gestantes/lactantes não responsivas ao tratamento com anti-histamínicos?
Se usados por curtos períodos de tempo, os corticosteroides são considerados seguros em gestantes e lactantes. Porém, estas medicações não são recomendadas para uso rotineiro na urticária em todos os pacientes, independentemente da gestação ou amamentação.
O uso dos corticosteroides sistêmicos, devido ao seu perfil de segurança, está restrito ao controle de exacerbações, não somente em gestantes, mas em todos os pacientes com urticária, e não deve ser prescrito para uso prolongado. Nestas situações, um curso curto de corticosteroides na dose usual anti-inflamatória pode ser usado, esporadicamente, para reduzir a duração e a atividade da doença. A suspensão gradual é desnecessária. Portanto, os corticosteroides não são alternativa terapêutica aos anti-histamínicos na urticária crônica69,70.
Os corticosteroides são usados no controle de várias doenças durante a gestação, e o seu uso parece ser seguro, principalmente por curtos períodos. Apesar de improvável nestas situações, existe o risco de associação potencial com diabetes gestacional, pré-eclâmpsia, insuficiência adrenal neonatal, e baixo peso ao nascimento. Assim, o benefício do seu uso deve ser maior que os potenciais riscos.
Pequenas quantidades de corticosteroides, como prednisona e prednisolona, são excretadas no leite. Apesar disso, é considerado seguro o uso de corticosteroide sistêmico durante a lactação; contudo recomenda-se atrasar a amamentação por algumas horas após a dose diária do corticosteroide para minimizar possíveis riscos11,60.
7. Quais os principais diagnósticos diferenciais da UCE durante a gestação?
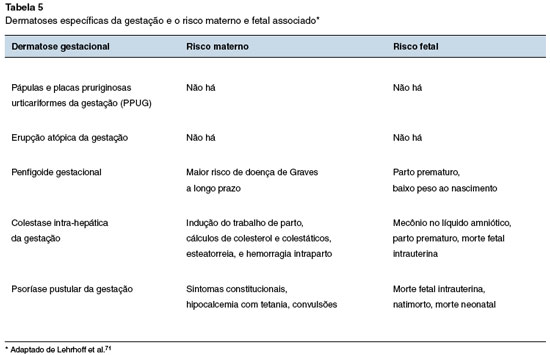
As pápulas e placas pruriginosas urticariformes da gestação (PPUG), a erupção atópica da gestação, o penfigoide gestacional, a colestase intra-hepática da gestação e a psoríase pustular da gestação são as dermatoses que devem ser consideradas no diagnóstico diferencial da urticária na gestação.
Os diagnósticos diferenciais da urticária devem ser considerados em todos os pacientes, inclusive na gestação21,34.
A gestação é um período caracterizado por alterações dermatológicas, com algumas dermatoses específicas desta condição, bem como o prurido sem lesão. A urticária até pode ocorrer durante, mas não é específica da gestação. As dermatoses da gestação são raras e não existem testes adequados para o diagnóstico, dificultando o seu manejo. As principais manifestações cutâneas e o risco materno-fetal das dermatoses da gestação estão descritas nas Tabelas 4 e 5, respectivamente11,60,71,72.
A dermatite autoimune à progesterona é uma doença rara, recorrente e que acomete mulheres em idade fértil. As manifestações cutâneas são polimórficas, variando desde lesões eczematosas, vesículo-papulares ou semelhantes ao eritema multiforme, podendo haver uma fase transitória urticariforme. Por isso, deve ser considerada no diagnóstico diferencial da urticária na gestação60,72.
Sempre que houver dúvida diagnóstica, é interessante orientar as pacientes a fotografarem as lesões para ajudar a elucidar o quadro60. Adicionalmente, em todo paciente diagnosticado com urticária e resposta inadequada a altas doses de anti-histamínicos deve-se aventar um possível diagnóstico diferencial11,21.
CONCLUSÃO
Clinicamente, a urticária crônica se apresenta com quadro clínico bem definido, que permite sua identificação independente da faixa etária. Entretanto, alguns diagnósticos diferenciais devem ser lembrados em grupos específicos de pacientes, especialmente se há outros sintomas associados ou se as lesões não apresentam as características típicas. Apesar da carência de estudos robustos em determinados grupos de pacientes, o tratamento recomendado não difere do restante da população com urticária e segue o mesmo fluxograma proposto no consenso internacional.
CONFLITO DE INTERESSES
Eli Mansour: speaker, apoio para eventos e assessoria científica da Novartis®, CSL Behring®, Takeda® e Sanofi®. Regis Albuquerque Campos: speaker, participante do advisory board e de pesquisa clínica para Novartis®. Solange Oliveira Rodrigues Valle: speaker, consultoria e pesquisa para Novartis®. Luis Felipe Chiaverini Ensina: pesquisa clínica, advisory board e speaker para Novartis® e Sanofi®; advisory board e speaker para Abbvie®; speaker para Mantercorp®.
REFERÊNCIAS
1. Zuberbier T, Abdul Latiff AH, Abuzakouk M, Aquilina S, Asero R, Baker D, et al. The International EAACI/GA2LEN/EuroGuiDerm/APAAACI Guideline for the Definition, Classification, Diagnosis and Management of Urticaria. Allergy. 2022;77(3):734-66.
2. Ensina LF, Valle SOR, Campos RA, Agondi R, Criado P, Bedrikow RB, et al. Guia prático da Associação Brasileira de Alergia e Imunologia para o diagnóstico e tratamento das urticárias baseado em diretrizes internacionais. Arq Asma Alerg Imunol. 2019;3(4):382-92.
3. Ben-Shoshan M, Grattan CE. Management of Pediatric Urticaria with Review of the Literature on Chronic Spontaneous Urticaria in Children. J Allergy Clin Immunol Pract. 2018;6(4):1152-61.
4. Cetinkaya PG, Soyer O, Esenboga S, Sahiner UM, Teksam O, Sekerel BE. Predictive factors for progression to chronicity or recurrence after the first attack of acute urticaria in preschool-age children. Allergol Immunopathol (Madr). 2019;47(5):484-90.
5. Guo C, Saltoun C. Urticaria and angioedema. Allergy Asthma Proc. 2019;40(6):437-40.
6. Minasi D, Manti S, Chiera F, Licari A, Marseglia GL. Acute urticaria in the infant. Pediatr Allergy Immunol. 2020;31(S26):49-51.
7. Sabroe RA. Acute Urticaria. Immunol Allergy Clin North Am. 2014;34(1):11-21.
8. Caffarelli C, Paravati F, El Hachem M, Duse M, Bergamini M, Simeone G, et al. Management of chronic urticaria in children: A clinical guideline. Ital J Pediatr. 2019;45(1):1-25.
9. Fricke J, Ávila G, Keller T, Weller K, Lau S, Maurer M, et al. Prevalence of chronic urticaria in children and adults across the globe: Systematic review with meta-analysis. Allergy Eur J Allergy Clin Immunol. 2020;75(2):423-32.
10. Netchiporouk E, Sasseville D, Moreau L, Habel Y, Rahme E, Ben-Shoshan M. Evaluating comorbidities, natural history, and predictors of early resolution in a cohort of children with Chronic Urticaria. JAMA Dermatology. 2017;153(12):1236-42.
11. Saini S, Shams M, Bernstein JA, Maurer M. Urticaria and Angioedema Across the Ages. J Allergy Clin Immunol Pract. 2020;8(6):1866-74.
12. Brandão L, Araujo C, Moura AC, Bruscky D, Dela Bianca AC, Camelo-Nunes I, et al. Chronic urticaria in children: a real-life study. J Allergy Clin Immunol. 2021;147(2):AB25.
13. Lachover-Roth I, Rabie A, Cohen-Engler A, Rosman Y, Meir-Shafrir K, Confino-Cohen R. Chronic urticaria in children - New insights from a large cohort. Pediatr Allergy Immunol. 2021;32(5):999-1005.
14. Kolkhir P, Church MK, Weller K, Metz M, Schmetzer O, Maurer M. Autoimmune chronic spontaneous urticaria: What we know and what we do not know. J Allergy Clin Immunol. 2017;139(6):1772-81.
15. Schmetzer O, Lakin E, Topal FA, Preusse P, Freier D, Church MK, et al. IL-24 is a common and specific autoantigen of IgE in patients with chronic spontaneous urticaria. J Allergy Clin Immunol. 2018;142(3):876-82.
16. Barzilai O, Ram M, Shoenfeld Y. Viral infection can induce the production of autoantibodies. Curr Opin Rheumatol. 2007;19(6):636-43.
17. Sahiner UM, Civelek E, Tuncer A, Yavuz ST, Karabulut E, Sackesen C, et al. Chronic urticaria: Etiology and natural course in children. Int Arch Allergy Immunol. 2011;156(2):224-30.
18. Caffarelli C, Cuomo B, Cardinale F, Barberi S, Dascola C, Agostinis F, et al. Aetiological Factors Associated with Chronic Urticaria in Children: A Systematic Review. Acta Derm Venereol. 2013;93(3):268-72.
19. Azkur D, Civelek E, Toyran M, Mısırlıoglu ED, Erkoçoglu M, Kaya A, et al. Clinical and etiologic evaluation of the children with chronic urticaria. Allergy Asthma Proc. 2016;37(6):450-7.
20. Ensina LF, Bastos PGA, de Lacerda AE, de Araujo CA, Camelo-Nunes I, Solé D. Comments on Balp et al. Pediatr Allergy Immunol. 2018;29(6):669-70.
21. Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, et al. The EAACI/GA2LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy Eur J Allergy Clin Immunol. 2018;73(7):1393-414.
22. Miles LM, Gabrielli S, Le M, Netchiporouk E, Baum S, Greenberger S, et al. Clinical Characteristics, Management, and Natural History of Chronic Inducible Urticaria in a Pediatric Cohort. Int Arch Allergy Immunol. 2021;182(8):757-64.
23. Bal F, Kahveci M, Soyer O, Sekerel BE, Sahiner UM. Chronic inducible urticaria subtypes in children: Clinical features and prognosis. Genuneit J, editor. Pediatr Allergy Immunol. 2021;32(1):146-52.
24. Giavina-Bianchi P, Aun MV, Motta AA, Kalil J, Castells M. Classification of angioedema by endotypes. Clin Exp Allergy. 2015;45(6):1142-3.
25. Pattanaik D, Lieberman JA. Pediatric Angioedema. Curr Allergy Asthma Rep. 2017;17(9):60.
26. Hawro T, Ohanyan T, Schoepke N, Metz M, Peveling-Oberhag A, Staubach P, et al. The Urticaria Activity Score - Validity, Reliability, and Responsiveness. J Allergy Clin Immunol Pract. 2018;6(4):1185-90.
27. Weller K, Groffik A, Church MK, Hawro T, Krause K, Metz M, et al. Development and validation of the Urticaria Control Test: A patient-reported outcome instrument for assessing urticaria control. J Allergy Clin Immunol. 2014 May;133(5):1365-72, 1372.e1-6.
28. Valle SOR, Dortas-Junior SD, Dias GAC, Motta AA, do-Amaral CSF, Martins EAPR, et al. Ferramentas para avaliação e acompanhamento da urticária crônica. Arq Asma, Alerg e Imunol. 2018;2(2):209-24.
29. Weller K, Groffik A, Magerl M, Tohme N, Martus P, Krause K, et al. Development, validation, and initial results of the Angioedema Activity Score. Allergy. 2013;68(9):1185-92.
30. Baiardini I, Pasquali M, Braido F, Fumagalli F, Guerra L, Compalati E, et al. A new tool to evaluate the impact of chronic urticaria on quality of life: chronic urticaria quality of life questionnaire (CU-Q2oL). Allergy. 2005;60(8):1073-8.
31. Weller K, Groffik A, Magerl M, Tohme N, Martus P, Krause K, et al. Development and construct validation of the angioedema quality of life questionnaire. Allergy. 2012;67(10):1289-98.
32. Prati C, Comparin C, Catucci Boza J, Ferreira Cestari T. Validação para o português falado no Brasil do instrumento Escore da Qualidade de Vida na Dermatologia Infantil (CDLQI). Med Cutan Ibero Lat Am. 2010;38(6):229-33.
33. Bruscky DMV, Melo ACCDB, Sarinho ESC. Cross-cultural adaptation and validation of the itching severity scale in children and adolescents with atopic dermatitis. Rev Paul Pediatr. 2017;35(3):244-51.
34. Davis MDP, van der Hilst JCH. Mimickers of Urticaria: Urticarial Vasculitis and Autoinflammatory Diseases. J Allergy Clin Immunol Pract. 2018;6(4):1162-70.
35. Zuberbier T, Maurer M. Urticarial Vasculitis and Schnitzler Syndrome. Immunol Allergy Clin North Am. 2014;34(1):141-7.
36. Hernández-Ostiz S, Prieto-Torres L, Xirotagaros G, Noguera-Morel L, Hernández-Martín, Torrelo A. Autoinflammatory Diseases in Pediatric Dermatology-Part 1: Urticaria-like Syndromes, Pustular Syndromes, and Mucocutaneous Ulceration Syndromes. Actas Dermosifiliogr. 2017;108(7):609-19.
37. Japiassu LG, Bastos PGA, Araújo CA, Camelo-Nunes I, Solé D, Ensina LF. Omalizumabe no tratamento da urticária crônica espontânea em pacientes pediátricos: série de casos. Arq Asma Alerg Imunol. 2018;2(1):78.
38. Cortellazzo Wiel L, Conversano E, Giangreco M, Fagotto L, Genovese MRL, Badina L, et al. Natural history and predictors of recovery in children with chronic spontaneous urticaria. Pediatr Allergy Immunol. 2021;32(1):201-4.
39. Wertenteil S, Strunk A, Garg A. Prevalence estimates for chronic urticaria in the United States: A sex- and age-adjusted population analysis. J Am Acad Dermatol. 2019;81(1):152-6.
40. Kim BR, Yang S, Choi JW, Choi CW, Youn SW. Epidemiology and comorbidities of patients with chronic urticaria in Korea: A nationwide population-based study. J Dermatol. 2018;45(1):10-6.
41. Chuamanochan M, Kulthanan K, Tuchinda P, Chularojanamontri L, Nuchkull P. Clinical features of chronic urticaria in aging population. Asian Pacific J Allergy Immunol. 2016;34(3):201-5.
42. Magen E, Mishal J, Schlesinger M. Clinical and laboratory features of chronic idiopathic urticaria in the elderly. Int J Dermatol. 2013;52(11):1387-91.
43. Ban G-Y, Kim M-Y, Yoo H-S, Nahm D-H, Ye Y-M, Shin Y-S, et al. Clinical features of elderly chronic urticaria. Korean J Intern Med. 2014;29(6):800.
44. Curto-Barredo L, Pujol RM, Roura-Vives G, Gimenez-Arnau AM. Chronic urticaria phenotypes: clinical differences regarding triggers, activity, prognosis and therapeutic response. Eur J Dermatology. 2019;29(6):627-35.
45. Longhurst HJ, Gonçalo M, Godse K, Ensina LF. Managing Chronic Urticaria and Recurrent Angioedema Differently with Advancing Age. J Allergy Clin Immunol Pract. 2021;9(6):2186-94.
46. Valle SOR, Motta AA, Amaral CS, Ensina LFC, Mallozi MC, Spengler MG, et al. What is new in chronic spontaneous urticaria? Brazilian J Allergy Immunol. 2016;4(1):9-25.
47. França AT, Valle SOR. Urticária e angioedema: diagnóstico e tratamento. 3ª ed. Rio de Janeiro: Revinter; 2014.
48. Brodell LA, Beck LA. Differential diagnosis of chronic urticaria. Ann Allergy, Asthma Immunol. 2008;100(3):181-8.
49. Gellrich FF, Günther C. Schnitzler syndrome. Hautarzt. 2019 Jun 5. English. doi: 10.1007/s00105-019-4434-4.
50. Zuberbier HCT, Maurer M. Urticarial Vasculitis and Schnitzler Syndrome. Immunol Allergy Clin North Am. 2014;34(1):141-7.
51. Magerl M, Altrichter S, Borzova E, Giménez-Arnau A, Grattan CEH, Lawlor F, et al. The definition, diagnostic testing, and management of chronic inducible urticarias - The EAACI/GA 2 LEN/EDF/UNEV consensus recommendations 2016 update and revision. Allergy. 2016;71(6):780-802.
52. Larenas-Linnemann D, Saini SS, Azamar-Jácome AA, Jensen-Jarolim E, Maurer M. Very rarely chronic urticaria can be caused by cancer and if so, resolves with its cure. Allergy Eur J Allergy Clin Immunol. 2018;73(9):1925-6.
53. Faisant C, Armengol G, Bouillet L, Boccon-Gibod I, Villier C, Lévesque H, et al. Angioedema Triggered by Medication Blocking the Renin/Angiotensin System: Retrospective Study Using the French National Pharmacovigilance Database. J Clin Immunol. 2016;36(1):95-102.
54. Giavina-Bianchi P, Arruda LK, Aun MV, Campos RA, Chong-Neto HJ, Constantino-Silva RN, et al. Diretrizes brasileiras para o diagnóstico e tratamento do angioedema hereditário - 2017. Arq Asma, Alerg Imunol. 2017;1(1):23-48.
55. Ventura MT, Cassano N, Romita P, Vestita M, Foti C, Vena GA. Management of Chronic Spontaneous Urticaria in the Elderly. Drugs Aging. 2015;32(4):271-82.
56. Cataldi M, Maurer M, Taglialatela M, Church MK. Cardiac safety of second‐generation H1‐antihistamines when updosed in chronic spontaneous urticaria. Clin Exp Allergy. 2019;49(12):1615-23.
57. Nettis E, Cegolon L, Di Leo E, Canonica WG, Detoraki A, Baiardini I, et al. Omalizumab in elderly patients with chronic spontaneous urticaria: An Italian real-life experience. Ann Allergy, Asthma Immunol. 2018;120(3):318-23.
58. Martina E, Damiani G, Grieco T, Foti C, Pigatto PDM, Offidani A. It is never too late to treat chronic spontaneous urticaria with omalizumab: Real-life data from a multicenter observational study focusing on elderly patients. Dermatol Ther. 2021;34(2):e14841.
59. Antia C, Baquerizo K, Korman A, Bernstein JA, Alikhan A. Urticaria: A comprehensive review: Epidemiology, diagnosis, and work-up. J Am Acad Dermatol. 2018;79(4):599-614.
60. Lawlor F. Urticaria and Angioedema in Pregnancy and Lactation. Immunol Allergy Clin North Am. 2014;34(1):149-56.
61. Kocatürk E, Al-Ahmad M, Krause K, Gimenez-Arnau AM, Thomsen SF, Conlon N, et al. Effects of pregnancy on chronic urticaria: Results of the PREG-CU UCARE study. Allergy. 2021;76(10):3133-44.
62. Hale TW. Medications and mother's milk. 15ª ed. Center IR, ed. Pharmasoft Publishing; 2012. p. 352-2519.
63. Murase JE, Heller MM, Butler DC. Safety of dermatologic medications in pregnancy and lactation. J Am Acad Dermatol. 2014;70(3):401.e1-401.e14.
64. Giugliani ERJ, Vieira GO, Elias CLLF, Closs CTK, Issler RM da S, Alves RMNR, et al. Uso de medicamentos e outras substâncias pela mulher durante a amamentação. Soc Bras Pediatr Dep Cient Aleitamento Matern. 2017;4:1-18.
65. Sánchez-Borges M, Ansotegui IJ, Baiardini I, Bernstein J, Canonica GW, Ebisawa M, et al. The challenges of chronic urticaria part 2: Pharmacological treatment, chronic inducible urticaria, urticaria in special situations. World Allergy Organ J. 2021;14(6):100546.
66. Losappio LM, Mirone C, Schroeder JW, Scibilia J, Balossi L, Pastorello EA. Omalizumab Use in Chronic Spontaneous Urticaria during Pregnancy and a Four Years' Follow-Up: A Case Report. Case Rep Dermatol. 2020;12(3):174-7.
67. Ensina L, Cusato-Ensina A, Camelo-Nunes I, Solé D. Omalizumab as Third-Line Therapy for Urticaria During Pregnancy. J Investig Allergol Clin Immunol. 2017;27(5):326-7.
68. Cuervo-Pardo L, Barcena-Blanch M, Radojicic C. Omalizumab use during pregnancy for CIU: a tertiary care experience. Eur Ann Allergy Clin Immunol. 2016;48(4):145-6.
69. Melo JML, Borges LV, França AT, Dias GA, Ensina LFC, Agondi RC, et al. Guia prático do tratamento com omalizumabe para urticária crônica espontânea. Arq Asma Alerg Imunol. 2020;4(3):289-99.
70. Bauer A, Dickel H, Jakob T, Kleinheinz A, Lippert U, Metz M, et al. Expert consensus on practical aspects in the treatment of chronic urticaria. Allergo J Int. 2021;30(2):64-75.
71. Lehrhoff S, Pomeranz MK. Specific dermatoses of pregnancy and their treatment. Dermatol Ther. 2013;26(4):274-84.
72. Peroni A, Colato C, Schena D, Girolomoni G. Urticarial lesions: If not urticaria, what else? The differential diagnosis of urticaria. J Am Acad Dermatol. 2010;62(4):541-55.