Número Atual: Abril-Junho 2022 - Volume 6 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Régis A. Campos
- Faradiba Sarquis Serpa
- Eli Mansour
- Maria Luiza Oliva Alonso
- Luisa Karla Arruda
- Marcelo Vivolo Aun
- Maine Luellah Demaret Bardou
- Ana Flávia Bernardes
- Fernanda Lugão Campinhos
- Herberto Jose Chong-Neto
- Rosemeire Navickas Constantino-Silva
- Jane da Silva
- Sérgio Duarte Dortas-Junior
- Mariana Paes Leme Ferriani
- Joanemile Pacheco de Figueiredo
- Pedro Giavina-Bianchi
- Lais Souza Gomes
- Ekaterini Goudouris
- Anete Sevciovic Grumach
- Marina Teixeira Henriques
- Antônio Abilio Motta
- Therezinha Ribeiro Moyses
- Fernanda Leonel Nunes
- Jorge A. Pinto
- Nelson Augusto Rosario-Filho
- Norma de Paula M. Rubini
- Almerinda Maria do Rêgo Silva
- Dirceu Solé
- Ana Júlia Ribeiro Teixeira
- Eliana Toledo
- Camila Lopes Veronez
- Solange Oliveira Rodrigues Valle
ARTIGO ESPECIAL
Diretrizes brasileiras de angioedema hereditário 2022 - Parte 2: terapêutica
2022 Brazilian guidelines for hereditary angioedema - Part 2: therapy
Régis A. Campos1; Faradiba Sarquis Serpa2; Eli Mansour3; Maria Luiza Oliva Alonso4; Luisa Karla Arruda5; Marcelo Vivolo Aun6,7; Maine Luellah Demaret Bardou8; Ana Flávia Bernardes3; Fernanda Lugão Campinhos2; Herberto Jose Chong-Neto9; Rosemeire Navickas Constantino-Silva10; Jane da Silva11; Sérgio Duarte Dortas-Junior4; Mariana Paes Leme Ferriani5; Joanemile Pacheco de Figueiredo12; Pedro Giavina-Bianchi6; Lais Souza Gomes6; Ekaterini Goudouris13; Anete Sevciovic Grumach8; Marina Teixeira Henriques8; Antônio Abilio Motta6; Therezinha Ribeiro Moyses2; Fernanda Leonel Nunes5; Jorge A. Pinto14; Nelson Augusto Rosario-Filho9; Norma de Paula M. Rubini15; Almerinda Maria do Rêgo Silva16; Dirceu Solé17; Ana Júlia Ribeiro Teixeira6; Eliana Toledo18; Camila Lopes Veronez19; Solange Oliveira Rodrigues Valle4
DOI: 10.5935/2526-5393.20220020
1. Faculdade de Medicina da Bahia, Universidade Federal da Bahia, Departamento de Medicina Interna e Apoio Diagnóstico, Programa de Pós-graduação em Ciências da Saúde - Salvador, BA, Brasil
2. Escola Superior de Ciências da Santa Casa de Misericórdia de Vitória, Serviço de Referência em Asma, Alergia e Imunologia - Vitória, ES, Brasil
3. Faculdade de Ciências Médicas, Universidade Estadual de Campinas, Divisão de Alergia e Imunologia Clínica, Departamento de Clínica Médica - Campinas, SP, Brasil
4. Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro, Serviço de Imunologia - Rio de Janeiro, RJ, Brasil
5. Faculdade de Medicina de Ribeirão Preto - Universidade de São Paulo, Disciplina de Imunologia Clínica e Alergia. Departamento de Clínica Médica - Ribeirão Preto, SP, Brasil
6. Faculdade de Medicina da Universidade de São Paulo, Disciplina de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
7. Faculdade Israelita de Ciências da Saúde Albert Einstein, Disciplina Agente Hospedeiro - São Paulo, SP, Brasil
8. Centro Universitário Faculdade de Medicina do ABC, Disciplina de Imunologia Clínica - Santo André, SP, Brasil
9. Universidade Federal do Paraná, Serviço de Alergia e Imunologia, Departamento de Pediatria - Curitiba, PR, Brasil
10. Centro Universitário Faculdade de Medicina do ABC, Laboratório de Imunologia Clínica - Santo André, SP, Brasil
11. Hospital Universitário Prof. Polydoro Ernani de São Thiago, Universidade Federal de Santa Catarina, Departamento de Clinica Médica - Florianópolis, SC, Brasil
12. Faculdade de Medicina da Bahia, Universidade Federal da Bahia, Departamento de Medicina Interna e Apoio Diagnóstico - Salvador, BA, Brasil
13. Faculdade de Medicina da Universidade Federal do Rio de Janeiro, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
14. Hospital das Clínicas da Faculdade de Medicina da Universidade Federal de Minas Gerais, Serviço de Imunologia Clínica - Belo Horizonte, MG, Brasil
15. Escola de Medicina e Cirurgia da Universidade Federal do Estado do Rio de Janeiro - UNIRIO, Disciplina de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
16. Universidade Federal de Pernambuco, Área Acadêmica de Pediatria, Centro de Ciências Médicas - Recife, PE, Brasil
17. Escola Paulista de Medicina - Universidade Federal de São Paulo, Disciplina de Alergia, Imunologia e Reumatologia - Departamento de Pediatria - São Paulo, SP, Brasil
18. Faculdade de Medicina de São José do Rio Preto, Disciplina de Alergia e Imunologia Clínica do Departamento de Pediatria e Cirurgia Pediátrica - São José do Rio Preto, SP, Brasil
19. University of California, Divisão de Reumatologia, Alergia e Imunologia, Departamento de Medicina - San Diego, Califórnia, EUA
Endereço para correspondência:
Régis A. Campos
E-mail: regiscampos@ufba.br
Submetido em: 03/04/2022
Aceito em: 08/04/2022
Conflito de interesses Os autores Régis A. Campos, Faradiba S. Serpa, Maria Luisa O. Alonso, Herberto J. Chong-Neto, Pedro Giavina-Bianchi, Anete S. Grumach, Eli Mansour, Eliana Toledo e Solange O. R. Valle referem ter recebido apoio financeiro e/ou honorários da Takeda e CSL Behring. A autora Anete S. Grumach realizou consultoria para a Catalyst, além de ser bolsista de produtividade CNPq. Os autores L. Karla Arruda, Marcelo V. Aun, Jane da Silva e Camila L. Veronez referem ter recebido apoio financeiro e/ou honorários da Takeda. Os autores Maine L. D. Bardou, Ana Flávia Bernardes, Fernanda L. Campinhos, Rosemeire N. Constantino-Silva, Sérgio D. Dortas-Junior, Mariana P. L. Ferriani, Joanemile P. de Figueiredo, Lais S. Gomes, Ekaterini Goudouris, Marina T. Henriques, Antônio A. Motta, Therezinha R. Moyses, Fernanda L. Nunes, Jorge A. Pinto, Ana Júlia R. Teixeira, Nelson A. Rosario-Filho, Norma de Paula M. Rubini, Almerinda Maria do Rêgo Silva e Dirceu Solé negam conflitos de interesse.
RESUMO
O tratamento do angioedema hereditário tem início com a educação dos pacientes e familiares sobre a doença, pois é fundamental o conhecimento da imprevisibilidade das crises, assim como os seus fatores desencadeantes. O tratamento medicamentoso se divide em terapia das crises e profilaxia das manifestações clínicas. As crises devem ser tratadas o mais precocemente possível com o uso do antagonista do receptor de bradicinina, o icatibanto ou o concentrado de C1-inibidor. É necessário estabeler um plano de ação em caso de crises para todos os pacientes. A profilaxia de longo prazo dos sintomas deve ser realizada preferencialmente com medicamentos de primeira linha, como concentrado do C1-inibidor ou o anticorpo monoclonal anti-calicreína, lanadelumabe. Como segunda linha de tratamento temos os andrógenos atenuados. Na profilaxia de curto prazo, antes de procedimentos que podem desencadear crises, o uso do concentrado de C1-inibidor é preconizado. Existem algumas restrições para uso desses tratamentos em crianças e gestantes que devem ser consideradas. Novos medicamentos baseados nos avanços do conhecimento da fisiopatologia do angioedema hereditário estão em desenvolvimento, devendo melhorar a qualidade de vida dos pacientes. O uso de ferramentas padronizadas para monitorização da qualidade de vida, do controle e da atividade da doença são fundamentais no acompanhamento destes pacientes. A criação de associações de pacientes e familiares de pacientes com angioedema hereditário tem desempenhado um papel muito importante no cuidado destes pacientes no nosso país.
Descritores: Angioedema hereditário, tratamento farmacológico, tratamento de emergência, qualidade de vida, tratamento biológico.
COMO TRATAR OS PACIENTES COM ANGIOEDEMA HEREDITÁRIO?
O tratamento do angioedema hereditário (AEH) envolve múltiplos aspectos relacionados à educação em saúde, farmacoterapia e uso de ferramentas para avaliar o controle, a atividade da doença e a qualidade de vida do paciente. Essas ações proporcionam planos terapêuticos individualizados que contribuem para alcançar o objetivo principal do tratamento, que é controlar totalmente a doença e proporcionar uma vida normal1.
A estratégia envolvendo o tratamento cuidadoso das crises e a sua prevenção é essencial para o adequado manejo dos pacientes, procurando reduzir a significativa morbimortalidade associada ao AEH. O tratamento medicamentoso do AEH consiste no uso de fármacos para crises e profilaxia de curto ou longo prazo2,3. Nas últimas décadas houve uma melhor compreensão sobre a fisiopatologia da doença, o que proporcionou o desenvolvimento de novas terapias4. No entanto, o acesso a essas terapias no Brasil ainda é restrito, e os pacientes continuam utilizando tratamentos inadequados, tanto para as crises, quanto para a profilaxia, o que contribui para desfechos desfavoráveis.
QUAIS SÃO AS AÇÕES RELACIONADAS À EDUCAÇÃO EM SAÚDE?
Educação apropriada pode proporcionar aos pacientes e/ou seus familiares habilidade para manejo do AEH. Uma vez diagnosticados, pacientes e familiares devem ser orientados quanto a doença, com o objetivo de auxiliá-los nas melhores decisões a serem tomadas3,5,6. Na infância, são necessárias também orientações aos professores, cuidadores, bem como médicos da família e pediatras7-9. Esclarecimentos sobre o curso do AEH e os fatores desencadeantes das crises são as medidas iniciais mais importantes para que o paciente e sua família tenham uma melhor qualidade de vida e possam prevenir complicações graves. Outros aspectos que merecem atenção pela possibilidade de afetar a gravidade da doença são as questões psicossociais10-13.
Os profissionais da saúde envolvidos no acompanhamento de pacientes com AEH, podem auxiliá-los nas tomadas de decisão sobre tratamento e outras condições que merecem atenção especial, empregando um processo chamado "tomada de decisão compartilhada" (TDC)6,13,14. Em consonância ao conceito de TDC, as últimas diretrizes internacionais de AEH consideram o emprego desse processo principalmente no que diz respeito à escolha da terapia, tornando o manejo do AEH sensível às preferências dos pacientes e familiares2,3. A informação compartilhada com o paciente deve ser imparcial e equilibrada, na medida em que inclua os motivos pelos quais utilizar ou não determinado tratamento6.
O paciente deve receber um documento por escrito com informações sobre a doença e a conduta a ser adotada em caso de uma crise10 (Anexo 1). Um laudo sobre a doença, opções terapêuticas, monitoramento, medicamentos proibidos e contato do médico especialista em AEH deve ser fornecido para outros médicos assistentes e equipes de emergência2,3,15. Esportes e hobbies com movimentos de impacto e risco de trauma devem ser evitados. O acompanhamento odontológico regular pode evitar extrações e procedimentos cirúrgicos, que são gatilhos importantes de crises10.
As imunizações estão indicadas para a prevenção das infecções que também são potenciais desencadeantes das crises3,16. Considerando que o AEH está classificado como imunodeficiência primária, ou seja, erro inato da imunidade (CID10: D84.1), os pacientes podem ter acesso ao esquema vacinal administrado pelos Centros de Imunobiológicos Especiais (CRIEs) do Ministério da Saúde17.
A vacinação contra influenza deve ser indicada anualmente, uma vez que alguns pacientes podem ter crises desencadeados por infecções respiratórias. As vacinas contra os vírus das hepatites A e B (VHA e VHB) devem ser indicadas para diminuir a chance de infecções e o risco teórico de transmissão do VHB por hemoderivados, utilizados no tratamento das crises de AEH. Desse modo, é recomendável a realização de sorologia para HBV, HCV e HIV, especialmente em pacientes que foram expostos a hemoderivados. A vacinação contra COVID-19 deve ser realizada, embora existam relatos recentes de crises de angioedema após a administração dessas vacinas3,16,18,19.
Outra questão relevante é a necessidade de pesquisar a doença em familiares e orientar sobre o padrão de herança e aconselhamento genético10. Todos os parentes de primeiro grau, mesmo que assintomáticos, devem ser investigados quanto à possibilidade de AEH10,12,20.
COMO A PROFILAXIA DE LONGO PRAZO DEVE SER REALIZADA?
O objetivo da profilaxia de longo prazo é reduzir a frequência e a gravidade das crises com o principal foco em melhorar a qualidade de vida do paciente e reduzir mortalidade1,3. O tratamento deve ser sempre personalizado, e a indicação deve ser baseada na frequência e gravidade das crises, qualidade de vida e acesso aos medicamentos21. Não há um limite estabelecido para o número de crises que indicaria a necessidade de uso contínuo de medicamento. Deve-se considerar que uma crise com obstrução das vias respiratórias superiores em um paciente pode ter um peso diferente que um número maior de crises leves acometendo extremidades em outro paciente.
A profilaxia de longo prazo não implica necessariamente em uso ininterrupto permanente. Ajustes de dose e frequência de uso devem ser individualizados, guiados pela evolução clínica do paciente3.
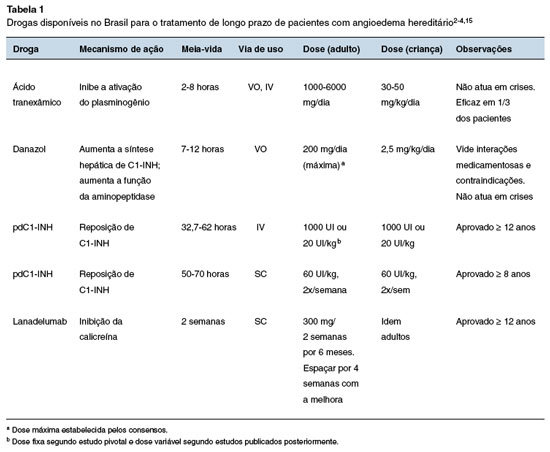
Os medicamentos atualmente disponíveis no Brasil para o tratamento profilático de longo prazo são: andrógenos atenuados, inibidores da plasmina (agentes antifibrinolíticos), concentrado do inibidor de C1 (C1-INH) e inibidores da calicreína (Tabela 1). Os consensos internacionais mais recentes estabeleceram como medicamentos de primeira linha para o tratamento de longo prazo do AEH, os concentrados do C1-INH e os inibidores de calicreína2,3,15,22. Entretanto, no Brasil, esses medicamentos ainda não estão disponíveis no Sistema Único de Saúde (SUS), que oferece acesso apenas ao andrógeno atenuado danazol, nem incorporados no Rol de Procedimentos da Agência Nacional de Saúde (ANS), que regula a saúde suplementar.
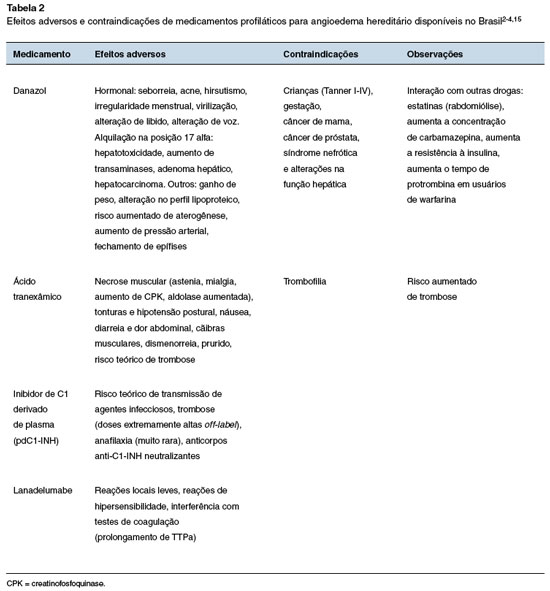
Os andrógenos atenuados (AA) utilizados para profilaxia de longo prazo incluem danazol e oxandrolona, que aumentam os níveis plasmáticos de C1-INH e C4, sendo efetivos na redução da frequência de crises de angioedema3. Os efeitos adversos mais relevantes dos AA e usualmente dose-dependentes são hepatotoxicidade, virilização e alteração do perfil lipídico plasmático. Efeitos virilizantes incluem irregularidade do ciclo menstrual, alterações da voz e hirsutismo.
Podem ocorrer efeitos psicológicos, como alterações de humor, perda de libido, ansiedade e depressão. Outras reações adversas descritas incluem ganho ponderal, acne, miopatias, hipertensão arterial e hematúria. Esses efeitos adversos são reversíveis com a interrupção do medicamento23-25. Danazol é o único AA com registro na Agência Nacional de Vigilância Sanitária (ANVISA), sendo a dose ótima para minimizar efeitos adversos ≤ 200 mg/dia3,15,26. Os pacientes em uso de AA devem ser monitorados com hemograma, função hepática, perfil lipídico, creatinofosfoquinase, alfa-fetoproteína e urinálise a cada seis meses e ultrassonografia abdominal anualmente, para rastreio de adenoma hepatocelular ou carcinoma. Os AA são contraindicados na gestação e amamentação, antes da puberdade, e em pacientes com neoplasias de próstata ou insuficiência hepática, renal ou cardíaca25.
A literatura é escassa sobre o uso do antifibrinolítico ácido tranexâmico na profilaxia de longo prazo do AEH27-29. Esse medicamento inibe competitivamente a ativação de plasminogênio, com redução na transformação de plasminogênio em plasmina e diminuição na fibrinólise. Apresenta eficácia inferior ao danazol e menor toxicidade, sendo seu uso reservado a pacientes com intolerância ou contraindicação ao danazol, assim como em pacientes menores de 12 anos4. O ácido tranexâmico é utilizado na dose de 30-50 mg/kg/dia, dividido em 2-3 tomadas, dose máxima de 6,0 g/dia3. A principal preocupação com o uso dos antifibrinolíticos é o risco de trombose, embora essa reação adversa não tenha sido relatada28,29. O início do efeito terapêutico é de aproximadamente 48 horas após sua administração27.
Os concentrados do inibidor de C1 derivados do plasma (pdC1-INH) ou recombinante humano (rhC1-INH) são medicamentos usados para repor a deficiência de C1-INH. Atuam em todos os sistemas regulados por esta glicoproteína, controlando a produção de bradicinina3,4. O pdC1-INH é obtido pela separação do C1-INH do plasma humano purificado por uma combinação de processos como crioprecipitação, cromatografia de troca de íons, ultrafiltração, nanofiltração, precipitação de polietilenoglicol, pasteurização e, finalmente, liofilização3,30. Este processo garante a segurança do tratamento com relação à transmissão de doenças infecciosas como hepatite e síndrome de imunodeficiência adquirida30-37. A meia-vida plasmática do pdC1-INH é superior a 30 horas, portanto, é seguro e eficaz para profilaxia de longo prazo, com poucos eventos adversos32,38-40.
No Brasil, estão aprovados pela ANVISA dois produtos: Berinert SC® (uso subcutâneo) e Cinryze® (uso intravenoso). Estudos duplo-cegos randomizados do Cinryze® demonstraram sua eficácia e segurança30,41,42. O estudo pivotal com Cinryze® utilizou a dose fixa de 1.000 UI intravenoso (IV) a cada 3-4 dias, porém, posteriormente, outro estudo retrospectivo mostrou melhor eficácia com o uso de doses de acordo com o peso do paciente (20 UI/Kg/dose)30,41,42. O risco de tromboembolismo decorrente do uso profilático do pdC1-INH foi observado pela FDA (US Food and Drug Administration)43. Estudos posteriores não confirmaram esta ocorrência, sugerindo que os pacientes poderiam apresentar outros fatores predisponentes associados44,45.
O uso profilático do Berinert SC®, duas vezes por semana, reduziu significativamente a frequência de crises46. O efeito adverso mais frequente foi reação leve no local da aplicação. O uso subcutâneo (SC) do pdC1-INH facilita a autoadministração e está disponível como Berinert® SC 2000/3000 UI (ANVISA)47. A formulação SC contém 1500 UI em 3 mL de solução, em comparação com a formulação IV, que contém 500 UI em 10 mL. A administração SC resulta em níveis plasmáticos mais consistentes entre as aplicações em comparação com a administração IV39. A dose recomendada é de 60 UI/Kg de peso, para pacientes acima de 8 anos, duas vezes por semana (a cada três ou quatro dias), a ser aplicado no abdome46,48.
Ainda não disponível em nosso país, o rhC1-INH (Ruconest®), é obtido a partir do leite de coelhas transgênicas e, por isto, é contraindicado em pacientes com alergia conhecida ou suspeita a coelhos ou produtos deles derivados32,49. Estudos clínicos demonstraram a eficácia e segurança do rhC1-INH, sem eventos adversos trombóticos49,50. A meia-vida plasmática é mais curta devido a sua glicosilação, aproximadamente 3 horas, o que dificulta o seu uso na profilaxia de longo prazo, porém, um estudo demonstrou esta possibilidade quando administrado uma vez por semana durante oito semanas40,51. A dose recomendada é de 50 U/kg IV para adultos com um peso corporal inferior a 84 kg, e uma dose de 4200 U (dois frascos) para adultos com peso superior50. Pacientes que não desejam serem tratados com produtos derivados do sangue por motivos religiosos, morais ou outras, podem receber o C1-INH recombinante52.
O lanadelumabe (Takhzyro®) faz parte do grupo de medicamentos inibidores da calicreína sendo um anticorpo monoclonal anti-calicreína plasmática para uso SC, liberado para pacientes acima de 12 anos de idade53. O estudo pivotal fase 3 (HELP), duplo-cego, randomizado, placebo controlado, avaliou o medicamento administrado por via subcutânea em três doses diferentes (150 mg cada quatro semanas; 300 mg cada quatro semanas e 300 mg cada duas semanas) ou placebo. Houve diferença significativa na redução das crises para as três doses utilizadas em relação ao placebo, com melhores resultados quando utilizado na dose de 300 mg a cada duas semanas53. Vale salientar que o efeito terapêutico ocorreu após a primeira dose e permaneceu ao longo de todo o ensaio clínico54. Este estudo foi seguido de fase aberta com a dose de 300 mg que comprovou a eficácia e segurança do medicamento a longo prazo quando em 97,7% dos dias de tratamento não ocorreram crises de angioedema14. Os eventos adversos descritos com mais frequência foram reações locais e tonteira, não sendo reportados eventos graves14,54. Recomenda-se a dose de 300 mg por via SC a cada 14 dias e após seis meses sem crises, o intervalo entre as doses pode aumentar para quatro semanas55. Estudo recente de vida real mostrou que o intervalo de administração pode ser aumentado gradualmente antes de alcançar esse período de seis meses sempre verificando a resposta clínica56.
O perfil de segurança dos diferentes fármacos deve ser sempre considerado na escolha da profilaxia de longo prazo no tratamento do AEH-C1-INH (Tabela 2).
A profilaxia de longo prazo para pacientes com AEH-nC1-INH não foi estudada em ensaios clínicos randomizados e controlados com placebo2. Entretanto, estudos abertos menores e relatos de séries de casos sugeriram estratégias que podem ser utilizadas. As duas principais terapias utilizadas são os antifibrinolíticos e terapia hormonal. Existem relatos para profilaxia de longo prazo no AEH-nC1-INH utilizando o pdC1-INH e o lanadelumabe, porém apenas em situações específicas, geralmente na ausência de resposta a outras opções2. Algumas mulheres com AEH-nC1-INH com piora dos sintomas na gestação se beneficiaram com uso do pdC1-INH57.
A primeira etapa do tratamento do AEH-nC1-INH consiste na suspensão do uso de estrógenos exógenos, sendo muitas vezes suficiente para deixar a paciente assintomática58. Outras opções incluem o uso de progestágenos ou mesmo de AA59-61. O ácido tranexâmico tem sido utilizado com boa resposta, provavelmente devido à inibição da formação de plasmina61.
COMO A PROFILAXIA EM CURTO PRAZO DEVE SER REALIZADA?
A profilaxia de curto prazo é indicada para pacientes submetidos a procedimentos médicos ou cirúrgicos que envolvam principalmente a região cervicofacial, com risco de angioedema das vias respiratórias superiores, como tratamento dentário mais invasivo (extração dentária), amigdalectomia, cirurgia facial, endoscopia, broncoscopia e procedimentos cirúrgicos que exigem a intubação traqueal54,62-65. Verificou-se que entre os pacientes com diagnóstico de AEH-C1-INH que realizaram extração dentária, 21% desenvolveram angioedema local após o procedimento65. Os dentistas desconhecem o AEH e os pacientes enfrentam dificuldades para terem o atendimento odontológico66.
Para procedimentos odontológicos menores, nenhuma profilaxia de rotina é necessária se o tratamento de crise estiver imediatamente disponível66. Em cirurgias não odontológicas, o risco de crise perioperatória varia de 5,7 a 30,5%63. A imprevisibilidade de crises de AEH desencadeadas por procedimentos, faz com que os consensos internacionais atuais sugiram considerar a profilaxia de curto prazo de forma individualizada2,15. Deve-se verificar o risco associado ao procedimento a ser feito, a disponibilidade de tratamento de crise e a ocorrência de episódio anterior em circunstâncias semelhantes15,21. Em algumas situações, quando o risco do procedimento a ser realizado é mínimo e existe disponibilidade do tratamento de crise, pode-se optar por não indicar a profilaxia de curto prazo. Nestes casos, ao menor sinal do início de sintomas, deve ser instituído o tratamento da crise21 (Figura 1).
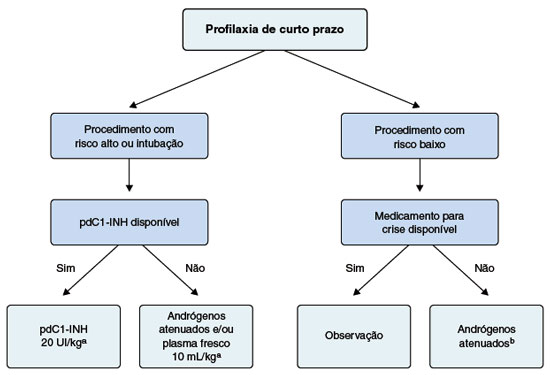
Figura 1
Profilaxia de curto prazo do angioedema hereditário com deficiência do C1-INH21
pdC1-INH = concentrado de C1-INH derivado do plasma.
a 1 a 6h antes do procedimento.
b Para danazol 2,5 a 10 mg/kg, até 200 mg/ 8-12h 5 dias antes e 2-3 dias após o procedimento.
O pdC1-INH é a primeira linha de tratamento para profilaxia de curto prazo, devendo ser utilizado uma a seis horas antes do procedimento, na dose de 20 U/kg33,41,67,68. O plasma fresco pode ser utilizado em procedimentos com risco alto ou necessidade de intubação, quando não há disponibilidade do pdC1-INH, porém, não há estudos comparativos avaliando os diferentes medicamentos69. A dose sugerida de plasma fresco é de 10 mL/kg (2-4 unidades para um adulto), uma a seis horas antes do procedimento70 (Figura 1). Os AA também podem ser usados quando o risco relacionado à cirurgia é relativamente baixo71. O danazol é administrado por via oral, três vezes ao dia, na dose de 2,5 a 10 mg/kg/dia com máximo de 600 mg/dia, iniciando 5 a 7 dias antes e mantendo-o até por 2 a 3 dias após o procedimento2,15,71-73. Verificou-se a ocorrência de crise de AEH em 12% dos pacientes após extração dentária, mesmo recebendo profilaxia de curto prazo65, o que reforça a necessidade de disponibilidade de medicamento para crise. Não existem dados publicados sobre a profilaxia de curto prazo no AEH-nC1-INH. Dessa forma, é recomendado o mesmo protocolo utilizado no AEH-C1-INH2.
COMO AS CRISES DE ANGIOEDEMA HEREDITÁRIO DEVEM SER TRATADAS?
O paciente e/ou cuidador deve ser orientado a tratar a crise, considerando o potencial de gravidade/localização e possível incapacidade. O tratamento precoce das crises é fundamental e os pacientes devem ter acesso à terapia e serem treinados a fazer autoadministração do medicamento2,3,15,74. Tratar a crise apenas em serviço médico exige deslocamento e resulta em atraso no início da terapia, o que pode contribuir para abordagens inadequadas e desfechos desfavoráveis. Embora exista consenso de que as crises de localização abdominal, facial, labial e do trato respiratório superior devam ser tratadas precocemente pelo seu potencial de gravidade, as crises de extremidades quando incapacitantes também merecem atenção e tratamento rápido2 (Figura 2). No caso de crise com acometimento da laringe, o retardo no tratamento pode ser fatal75. Assim, se recomenda que pacientes com AEH tenham pelo menos duas doses do medicamento para usar em seu domicílio em casos de eventuais crises3,10,76,77.
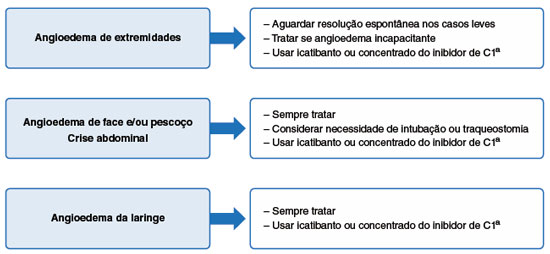
Figura 2
Recomendações para tratamento da crise de angioedema hereditário, de acordo com a área afetada18
a Disponíveis no Brasil: concentrado de C1-INH e icatibanto (Fyrazyr®). Em todas as situações, caso não esteja disponível o concentrado do inibidor de C1 ou o icatibanto, usar o plasma fresco congelado.
Na emergência, o primeiro passo da abordagem do paciente em crise de AEH acometendo as vias respiratórias superiores, língua e/ou úvula é manter a via aérea pérvia. Em pacientes instáveis, com risco iminente de asfixia, não se deve postergar a intubação orotraqueal (IOT)78. É importante ressaltar que, na fase inicial de obstrução das vias respiratórias, não se observa queda da saturação de oxigênio. A monitorização em sala de emergência está indicada e, em casos de hipotensão ou desidratação, a reposição de fluidos deve ser aplicada. Quando os pacientes apresentam crises abdominais graves, indica-se, além da terapia específica, tratamento sintomático com administração de fluidos, antieméticos e analgésicos. Podem ser necessários antiespasmódicos e narcóticos para tratar a dor intensa79.
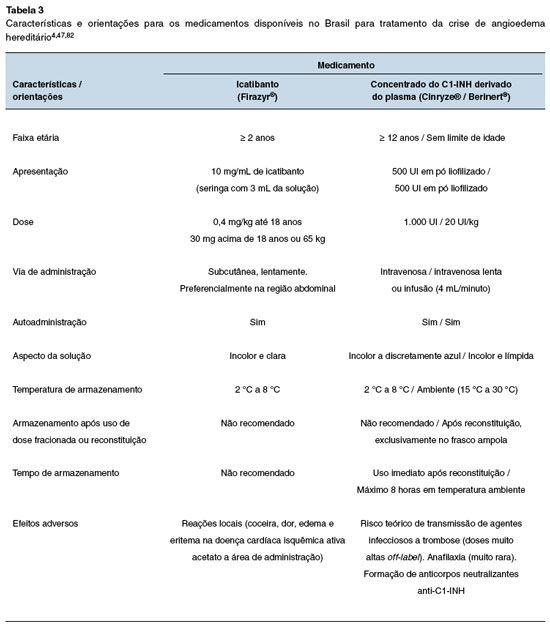
Os medicamentos utilizados para o tratamento das crises atuam impedindo a ação da bradicinina nas células endoteliais ou aumentando os níveis do C1-INH, e, consequentemente, reduzindo os níveis de bradicinina21. Para o manejo das crises, quatro tipos de tratamentos podem ser utilizados: pdC1-INH, rhC1-INH, antagonista do receptor B2 da bradicinina (icatibanto) e inibidor da calicreína (ecalantide)2,3,50,80. No Brasil, até o momento, há três produtos aprovados pela ANVISA para uso nas crises de AEH: dois pdC1-INH (Berinert® e Cinryze®)47,81 e o icatibanto (Firazyr®)82 (Tabela 3).
O pdC1-INH e o rhC1-INH são eficazes e seguros para o tratamento das crises de AEH em todas as faixas etárias42,67,80. O Berinert® é um produto pasteurizado e nanofiltrado, indicado para administração IV na dose de 20 UI/kg, independente da gravidade da crise42. Nos estudos pivotais o tempo médio de início do alívio dos sintomas foi de 0,46 horas e para a resolução completa 15,5 horas. Além disso, apenas 1,1% dos pacientes necessitaram de uma segunda dose para controle dos sintomas, sendo estabelecido o tempo de quatro horas entre a primeira e segunda dose, caso seja necessária42. O outro concentrado pdC1-INH nanofiltrado (Cinryze®), foi utilizado em doses fixas (500 U ou 1.000 U) em pacientes com angioedema de extremidades e nas crises abdominais83. Da mesma forma que com o Berinert®, a autoadministraçao de Cinryze® reduziu significativamente a duração e a gravidade das crises, além da necessidade de analgésicos. Uma dose de 1000 U é preconizada para o tratamento das crises e pode ser repetida uma hora após, se necessário41,49. Entretanto, existem evidências de que doses fixas podem não ser suficientes para controlar as crises, e a dose de 20 UI/kg é mais eficaz83. Dose adicional foi necessária em mais de 60% dos pacientes com crise de edema de laringe que receberam doses fixas do pdC1-INH83.
O rhC1-INH (Ruconest®) não é liberado para autoadministração, assim como não é disponível no Brasil. A dose recomendada é de uma injeção IV de 50 U/kg para adultos com peso corporal inferior a 84 kg e na dose de 4200 U (dois frascos) para os com peso igual ou superior a 84 kg84.
O acetato de icatibanto (Firazyr®) é uma molécula sintética, semelhante à bradicinina, que age como antagonista competitivo e seletivo do receptor B2 da bradicinina85,86. As crises de AEH são resolvidas mais rapidamente com o uso precoce do icatibanto em comparação com o uso tardio, por isso, se recomenda a administração nas primeiras seis horas após o início dos sintomas87. No Brasil, o acetato de icatibanto está licenciado para autoadministração domiciliar. O uso domiciliar é seguro, e os eventos adversos mais comuns são eritema e dor no local da injeção, com resolução espontânea88. A dose preconizada é de 30 mg para adultos e de 0,4 mg/kg na faixa etária de 2 a 17 anos, por via subcutânea, exclusivamente na região abdominal, podendo serem administradas injeções adicionais, a cada 6 horas, até o máximo de três vezes em 24 horas85.
Ecallantide (Kalbitor®) é um inibidor de calicreína aprovado para uso nos Estados Unidos e indisponível no Brasil. A dose recomendada é de 30 mg por via SC, e não é aprovado para autoadministração domiciliar, pois anafilaxia foi observada em aproximadamente 3% dos pacientes89.
O uso do plasma fresco congelado deve ficar reservado para situações nas quais nenhuma outra droga para crises esteja disponível. Essa estratégia de tratamento foi utilizada apenas em estudos observacionais e não foi testada em ensaios clínicos quanto à eficácia e à segurança nas crises de AEH. Além disso, a administração do plasma oferece não apenas a reposição do C1-INH, mas também os substratos nos quais esse inibidor atua, podendo não ter eficácia adequada e, inclusive, agravar o quadro. Outros riscos do uso do plasma consistem na ocorrência de reações transfusionais, transmissão de patógenos, além de sobrecarga de volume90. A dose recomendada é de duas a quatro unidades, para adultos, e de 10 a 15 mL/kg para crianças21.
A necessidade de procurar um serviço de saúde para administração de plasma, torna impossível para muitos pacientes receberem tratamento rápido90. Em algumas situações, a crise de angioedema pode ser muito grave e requerer uma terapêutica de rápida resposta e, além disso, em algumas regiões do Brasil o acesso à transfusão de plasma não é possível, o que enfatiza a necessidade de disponibilização de uma terapêutica eficaz e passível de autoadministração.
Até o momento, não existem estudos comparando a eficácia entre os fármacos usados para tratar a crise de AEH em ensaios clínicos randômicos. Portanto, sugerimos usar a opção disponível, no menor tempo possível entre o início da crise e sua aplicação para obter melhor eficácia.
COMO DEVE SER A ABORDAGEM DO ANGIOEDEMA HEREDITÁRIO NA INFÂNCIA E ADOLESCÊNCIA?
Cerca de 90% dos pacientes apresentam seus primeiros sintomas de AEH antes dos 20 anos de idade91. Estudo recente multicêntrico brasileiro avaliou 95 pacientes pediátricos com AEH-C1-INH e mostrou média de idade de início dos sintomas mais baixa (aos 3,3 anos), sendo que quase todos os pacientes sintomáticos (96,2%) tiveram seus primeiros sintomas antes dos 12 anos92. O AEH-nC1-INH em geral tem início na adolescência ou vida adulta, sendo rara sua manifestação antes da primeira década de vida93.
Na faixa etária pediátrica existe um atraso médio, de quatro a oito anos, no diagnóstico de AEH91,92. Alguns dos principais fatores envolvidos neste atraso incluem: dificuldade da criança verbalizar seus sintomas, diagnóstico equivocado dos sintomas (como exemplo: dores abdominais recorrentes são comuns na infância), sintomas podem ser menos intensos do que nos adultos, atraso na investigação pelos pais por negação de sua própria doença ou medo do resultado, testes de triagem com C4 com acurácia baixa na faixa etária pediátrica, ausência de história familiar e pouco reconhecimento da doença por parte dos médicos pediatras. Em geral, os pediatras são os primeiros médicos a avaliar uma criança com AEH, entretanto eles são responsáveis por apenas 3% dos diagnósticos desta doença94. Dessa forma, é muito importante a educação destes profissionais, salientando sinais de alerta para o diagnóstico do AEH em crianças: história familiar positiva, presença de dor abdominal recorrente e trauma como fator desencadeante das crises de angioedema95.
O tratamento medicamentoso do AEH na infância e adolescência utiliza as mesmas estratégias dos adultos, entretanto, é importante salientar que são poucos os ensaios clínicos direcionados especificamente para a faixa etária pediátrica, particularmente em menores de 12 anos9.
No Brasil, até o momento, há três produtos aprovados pela ANVISA para o tratamento das crises de angioedema nesta faixa etária: dois pdC1-INH (Berinert® e Cinryze®) e o icatibanto (Firazyr®).
O pdC1-INH para uso IV é eficaz e seguro no tratamento de todas as formas de crises de AEH por deficiência do C1-INH em crianças e adolescentes. Pesquisa recente com o uso do pdC1-INH na faixa etária pediátrica por um período prolongado confirmou sua eficácia e segurança96. O Berinert® é indicado para administração por via IV na dose de 20 UI/kg, independente da gravidade da crise e sem restrição de faixa etária. Outro pdC1-INH nanofiltrado, o Cinryze® está aprovado para adolescentes acima de 12 anos de idade em doses fixas (500 U ou 1000 U)10,97.
A segurança e eficácia do icatibanto (Firazyr®) foram estudadas em crianças98. A maioria dos pacientes iniciou a resolução dos sintomas em torno de uma hora e o evento adverso mais comum foi reação no local da aplicação com resolução espontânea. A dose preconizada é de 0,4 mg/kg na faixa etária de 2 a 17 anos, maiores que 12 kg, por via subcutânea, exclusivamente na região abdominal, podendo ser administradas injeções adicionais, a cada 6 horas, até o máximo de três injeções em 24 horas. É apresentado em seringas preenchidas de 3 mL contendo icatibanto 10 mg/mL. As doses podem ser adaptadas pelo peso [12 a 25 Kg =10 mg (1 mL); 26 a 40 Kg = 15 mg (1,5 mL); 41 a 50 Kg = 20 mg (2 mL); 51 a 65 Kg = 25 mg (2,5 mL); > 65 Kg = 30 mg (3 mL)].
O plasma fresco congelado deve ser utilizado na dose de 10 mL/kg IV, somente em situações de emergência e na ausência dos medicamentos licenciados para crise, devido aos efeitos colaterais e sua baixa eficácia com risco de piora paradoxal98. Outras opções não disponíveis no Brasil, mas utilizadas em outros países para tratamento das crises, incluem o ecallantide (inibidor da calicreína SC, maiores de 12 anos) e o Ruconest® (concentrado de C1-INH recombinante intravenoso, maiores de 12 anos)15,99.
Portanto, para o tratamento de crises em pacientes abaixo dos 12 anos de idade, podem ser utilizados pdC1-INH para uso IV (Berinert®), o icatibanto (Firazyr®) em pacientes acima dos dois anos de idade, e plasma fresco em qualquer idade.
Para a profilaxia de longo prazo das crianças com AEH abaixo dos 12 anos de idade está indicado o ácido tranexâmico, apesar de sua baixa eficácia, diante da impossibilidade de tratamento com medicamentos mais eficazes em uso em adolescentes e adultos3,100. O Lanadelumabe (Takhzyro®) está aprovado no momento apenas em pacientes a partir de 12 anos, revelando alta eficácia e bom perfil de segurança conforme demonstrado no estudo de extensão onde foram avaliados 21 pacientes abaixo de 18 anos14. Os AA não devem ser usados na faixa etária pediátrica, especialmente antes da puberdade25,101. Outras opções aprovadas pela ANVISA de alta eficácia e bom perfil de segurança incluem: pdC1-INH por via IV (Cinryze®, ≥ 12 anos) e SC (Berinert® SC, ≥ 8 anos) (Tabela 1). As adolescentes com AEH podem ser beneficiadas com o uso de progestágeno contínuo desde a menarca, pois podem ajudar no controle das crises, uma vez que inibem o ciclo de estrógeno endógeno, particularmente no AEH-nC1-INH101.
O pdC1-INH (Berinert SC®) e o lanadelumabe (Takhzyro®) mudaram significativamente a profilaxia de longo prazo, uma vez que ambos são seguros, liberados para autoadministração e por infusão subcutânea, o que é uma vantagem importante para uso em crianças e adolescentes2. Entretanto, estudos adicionais ainda são necessários para avaliar a eficácia e segurança em crianças menores.
Assim, para a profilaxia de longo prazo em menores de 8 anos, se encontra disponível no momento o ácido tranexâmico. Pacientes entre 8 e 12 anos de idade podem receber pdC1-INH SC (Berinert®), e aqueles com 12 anos ou mais podem receber profilaxia de longo prazo como os pacientes adultos, considerando AA naqueles com estágio de Tanner V.
Para a profilaxia de curto prazo são recomendadas as mesmas estratégias de farmacoterapia utilizadas nos adultos. É importante salientar que os AA não estão indicados para profilaxia de longo prazo em crianças antes da puberdade, mas podem ser utilizados por curto período antes de procedimentos de risco3.
COMO DEVE SER ABORDADO O AEH DURANTE A GESTAÇÃO, PARTO, PÓS-PARTO E LACTAÇÃO?
A anatomia, fisiologia e as mudanças hormonais provocadas pela gestação podem influenciar as manifestações e afetar o curso e o tratamento do AEH3. O estrogênio é um desencadeante de crises por estar relacionado ao controle da produção de bradicinina102. Assim, os sintomas podem se tornar mais frequentes e mais graves durante a gestação, após o parto e a lactação8,59,103,104. No período gestacional a doença pode melhorar, piorar ou pode não haver impacto sobre a frequência e gravidade das crises, o que torna difícil prever a evolução das pacientes105-107. Apesar dos resultados divergentes, a tendência é o agravamento dos sintomas durante o primeiro trimestre da gestação, quando os níveis séricos de estrogênio são mais elevados e a profilaxia de longo prazo com medicamentos contraindicados na gestação tem que ser interrompida. O segundo trimestre foi descrito como o período de menor atividade da doença devido aos níveis permanentemente altos dos outros hormônios. No terceiro trimestre, o aumento da produção de estrógenos placentários e de prolactina pode aumentar a frequência e intensidade das crises103.
A frequência de crises durante gestações anteriores não tem valor preditivo para a evolução do AEH em gestações posteriores. Pacientes sintomáticas têm maior chance de trabalho de parto prematuro ou aborto devido à atividade da bradicinina, que leva à contração do músculo liso uterino103. É descrito aumento da frequência e gravidade das crises em gestantes com início precoce dos sintomas ou que apresentam o trauma como um importante fator desencadeante107. Gestantes com AEH-C1-INH cujo feto tem a mesma deficiência, apresentam frequência de crises no período gestacional superior a aquelas cujos fetos são saudáveis108. Acredita-se que outros fatores ainda não determinados possam acarretar as crises de angioedema na gestante108. As gestantes com AEH-nC1-INH apresentam geralmente maior número de crises durante a gestação, particularmente no AEH-FXII57,109-111.
Os principais desencadeantes das crises nesse período são o estresse e traumas físicos112,113. As crises ocorrem em localização similar à do período não gestacional, podendo haver predileção pelo abdome, o que dificulta o diagnóstico diferencial103. Nessas situações, a ultrassonografia abdominal é útil na avaliação diagnóstica. Em geral as crises são leves e raramente apresentam risco de vida113.
Quanto à via de parto, o vaginal é preferível à cesariana. Quando há indicação obstétrica de parto cesáreo, a anestesia peridural é a melhor escolha114. É altamente recomendável que o hospital onde o parto será realizado tenha pessoal capacitado para assistência de pacientes com AEH e medicação disponível, tanto para profilaxia como para manejo de uma possível crise103.
O aconselhamento genético aos pacientes com AEH deve ser oferecido, uma vez que há 50% de chances de a prole também ter a doença103.
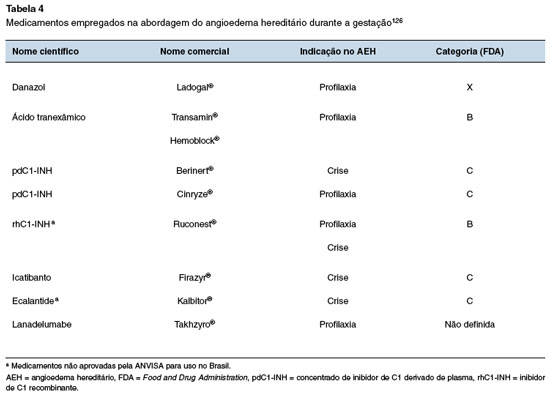
No planejamento da gravidez, mulheres que venham utilizando profilaxia de longo prazo com AA devem interromper o tratamento pelo menos um mês antes da concepção. Os andrógenos não são recomendados durante a gestação, pois atravessam a barreira placentária e podem resultar em virilização do feto, levando a pseudo-hermafroditismo feminino3,15. Recomenda-se a realização de uma dosagem de beta-HCG antes do início da administração de AA em mulheres em idade fértil15. O ácido tranexâmico também atravessa a barreira placentária e pode provocar efeitos colaterais para o feto, porém em menor intensidade do que aqueles causados pelos AA3,8,15,103.
O tratamento de crises durante a gestação inclui a prescrição de medicamentos sintomáticos (analgésicos), hidratação e uso de medicação específica, quando indicado103. A terapia de escolha na abordagem das crises durante a gestação, parto, pós-parto e amamentação é o pdC1-INH na mesma posologia que as não gestantes2,3,15. Outros medicamentos eficazes no manejo das crises, como o icatibanto e o C1-INH recombinante, foram utilizados nesse período, com bom perfil de segurança e eficácia115-117. Não há dados sobre o uso do ecallantide, e este medicamento é classificado como categoria C na gestação pela FDA103. O plasma fresco congelado pode ser administrado em casos de crise grave em que o pdC1-INH não esteja disponível.
Nos casos de AEH-C1-INH, quando a profilaxia de longo prazo é necessária, o medicamento de primeira linha é o pdC1-INH por via IV em dosagem similar à das mulheres não gestantes3,15,46,118. O pdC1-INH é utilizado há mais de duas décadas, com evidência de eficácia e segurança nessa população, sendo classificado como categoria C pela FDA2. Nas mulheres com AEH-nC1-INH há relatos isolados que mostram eficácia e segurança do concentrado de pdC1-INH57,119. O pdC1-INH administrado por via SC ainda não foi suficientemente avaliado, mas há casos descritos de uso em gestantes, sem evidências de riscos aos fetos120,121.
Quando o pdC1-INH não estiver disponível, o ácido tranexâmico pode ser indicado, mas sua eficácia não foi comprovada3. A dosagem é semelhante à prescrita para não gestantes. Embora não haja dados que corroborem maior risco pelo efeito pró-trombótico, é recomendável o uso com cautela em pacientes com história pessoal e/ou familiar de tromboembolismo122. Até o momento não há dados disponíveis sobre o uso do lanadelumabe durante a gestação e, portanto, ele não deve ser utilizado.
A profilaxia de curto prazo na gestação deve ser considerada em qualquer procedimento realizado, particularmente em intervenções com risco de crises tais como retirada de vilos coriônicos para amostras, amniocentese e aborto cirúrgico induzido3. O tratamento de primeira escolha também é a administração de pdC1-INH, 1 a 6 horas antes do procedimento, na dose de 20 U/kg de peso ou 1000 UI, dependendo do fármaco15,103. A necessidade de profilaxia de curto prazo para o parto não está definida. A maioria dos consensos internacionais sugere que a profilaxia deve ser indicada no parto cesáreo, mas que no parto vaginal apenas ter medicação para crise disponível na sala de parto seria suficiente2,3,15. A administração profilática de concentrado de pdC1-INH também está indicada em casos de necessidade de intubação e para partos difíceis exigindo fórceps ou em pacientes sem controle da doença durante o terceiro trimestre2,3,103. Há relatos isolados mostrando eficácia do uso de pdC1-INH para profilaxia de curto prazo no parto de mulheres com AEH-nC1-INH123. Quando houver indicação de profilaxia de curto prazo e o pdC1-INH não estiver disponível, plasma fresco congelado e/ou o ácido tranexâmico podem ser administrados3.
No puerpério as crises, geralmente, ocorrem imediatamente após o parto ou no prazo de 48 horas posteriores ao mesmo, e podem ter consequências graves103,123. Nesse período, algumas mulheres podem experimentar angioedema da vulva e dos locais de infusão, bem como obstrução uretral e crises abdominais, sendo recomendada a observação da paciente durante 72 horas após o parto32,103,123. Estudos mostram que, independentemente do tipo de parto, as crises são raras, mesmo na ausência de profilaxia106,107. Após a alta hospitalar, as recomendações do seguimento domiciliar da puérpera são as mesmas dispensadas à mulher com AEH não gestante103.
Na lactação, pode ocorrer aumento da frequência e da gravidade das crises de AEH, interferindo com a amamentação124. Concentrações mais elevadas de prolactina parecem ser responsáveis pelo aumento temporário das crises após o parto107. AA e antifibrinolíticos são excretados no leite humano e, por isso, devem ser evitados nesse período46,90. Mesmo assim, podemos considerar o uso do ácido tranexâmico na ausência do pdC1-INH como profilaxia32,90. Outra opção terapêutica para profilaxia durante a lactação é o uso de progesterona isolada, sem estrógeno102. Mesmo em baixas doses, a progesterona isolada é o contraceptivo de escolha durante a lactação, mesmo no pós-parto precoce125 e tem potencial profilático no manejo do AEH114.
A utilização dos medicamentos disponíveis para o tratamento do AEH com ou sem deficiência de C1-INH é limitada durante a gestação, parto, após o parto e a lactação, mas há opções disponíveis e seguras. O pdC1-INH é a opção recomendada como primeira linha no manejo dessas pacientes, tanto na profilaxia como no tratamento das crises3.
Os medicamentos para a abordagem terapêutica do AEH na gestação segundo a categorização da FDA estão resumidos na Tabela 4.
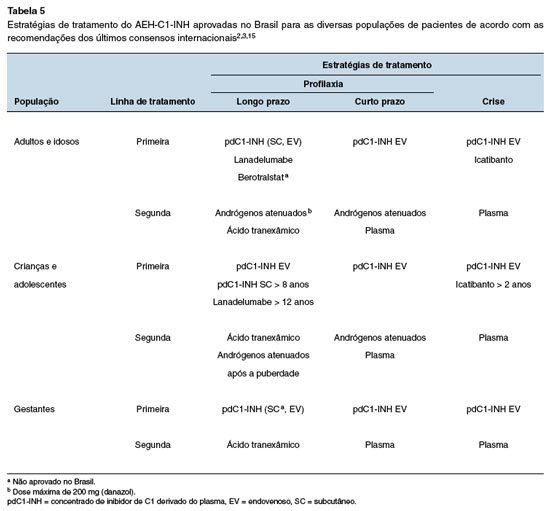
Portanto, segundo os últimos consensos internacionais, o tratamento do AEH-C1-INH, incluindo os grupos especiais (crianças, gestantes e nutrizes), inclui opções terapêuticas de primeira e segunda escolha (Tabela 5).
QUAIS AS PERSPECTIVAS NO TRATAMENTO DO ANGIOEDEMA HEREDITÁRIO?
Nas últimas décadas, o tratamento do AEH evoluiu do uso de drogas inespecíficas para profilaxia e tratamento das crises (como andrógenos atenuados, ácido tranexâmico e plasma congelado) para o uso de medicamentos específicos considerados de primeira linha. Os fármacos de primeira linha têm como alvo a reposição do C1-INH e, mais recentemente, moléculas direcionadas ao controle das proteínas do sistema calicreína-cininas plasmático1-3,15.
Com a disponibilização de medicamentos eficazes e seguros para tratamento das crises de angioedema, a maioria dos medicamentos em desenvolvimento atua para profilaxia de longo prazo. Diversos estudos também estão sendo conduzidos com a finalidade de ampliar a faixa etária e acrescentar outras indicações para os produtos existentes. A maioria dos novos medicamentos em desenvolvimento atualmente tem como alvo o fator XII, a calicreína plasmática e o receptor B2 de cininas (B2R). As novas terapias profiláticas pretendem propiciar maior comodidade posológica, com aumento do intervalo entre as aplicações IV ou SC, e desenvolver medicamentos de administração oral.
Dentre os medicamentos novos e já disponíveis em outros países, o berotralstat (BCX7353) (BioCryst Pharmaceuticals, Inc) foi aprovado pela FDA e EMA (European Medicines Agency). Trata-se de uma pequena molécula sintética que inibe a calicreína plasmática, de administração oral, que se mostrou segura e eficaz na profilaxia de longo prazo. No último consenso internacional de angioedema hereditário, juntamente com o concentrado de C1-INH derivado do plasma e com o lanadelumabe, esta molécula foi considerada uma das primeiras opções para profilaxia em longo prazo devido a eficácia e por ser de administração oral3. Alguns efeitos colaterais foram descritos: dor abdominal, vômito, diarreia e lombalgia127. Estas reações ocorrem logo após o início do tratamento, tornando-se menos frequentes com o tempo e são geralmente autolimitadas128.
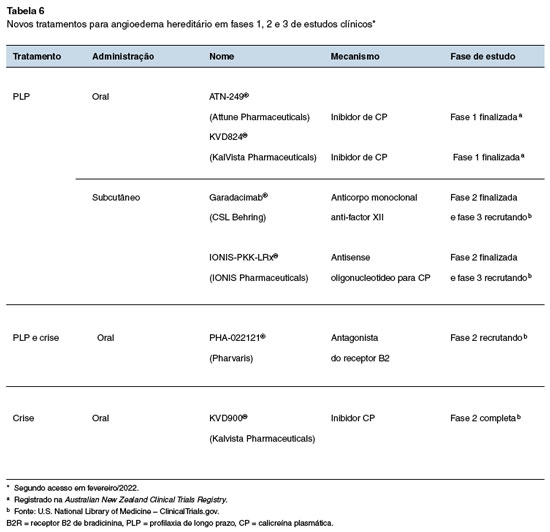
Ao menos seis novas drogas destinadas à profilaxia do AEH ou tratamento das crises se encontram em ensaios clínicos fase 1, 2 e 3 (Tabela 6). Dentre essas medicações, três atuam através da inibição da calicreína plasmática, com administração por via oral dentre as quais duas são destinados à profilaxia de longo prazo e uma ao tratamento das crises de angioedema129-134. Donidarsolen (IONIS PKK-LRx) é uma nova droga para o tratamento do AEH-C1-INH baseada no uso de um oligonucleotídeo antisense de segunda geração, que tem como alvo o gene que codifica a pré-calicreína plasmática com significante eficácia clínica, segurança e tolerância na profilaxia de longo prazo135-137. Garadacimab® (CSL312, CSL Behring) é um anticorpo monoclonal de administração subcutânea que tem como alvo o fator XIIa, em desenvolvimento para profilaxia de longo prazo no AEH-C1-INH, mostrando uma redução média das crises mensais de AEH acima de 90%138. A droga PHA-022121® (Pharvaris) se mostrou potente antagonista do receptor B2 de bradicinina (B2R) com administração oral, sendo atualmente avaliada para tratamento de crises e profilaxia a longo prazo em pacientes com AEH-C1-INH139-141.
As perspectivas de terapia gênica para o AEH-C1-INH têm se tornado mais próximas utilizando vetores adenovirais (AAV) na expressão de cópias normais do gene codificante do C1-INH142-144. Em outra abordagem inovadora, o NTLA-2002®, ainda em fase pré-clínica, baseou-se no uso do sistema clustered regularly interspaced short palindromic repeats (CRISPR)/Cas9 na edição in vivo do gene da pré-calicreína, gerando um processo de nocaute gênico145.
Considerando os novos tratamentos já aprovados e algumas das perspectivas de terapia para o AEH-C1-INH, a maior parte da via de contato e da fibrinólise já pode ser controlada, podendo resultar numa menor ação da bradicinina, com melhora ou prevenção das crises de angioedema (Figura 3).
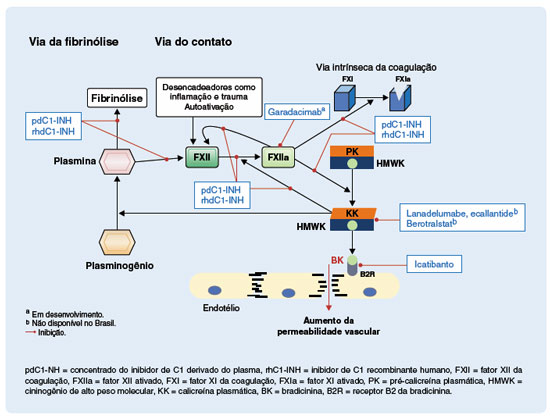
Figura 3
Local de ação nas vias da fibrinólise e do contato das diversas terapias para o angioedema hereditário com deficiência do C1-INH2-4
QUAIS SÃO AS FERRAMENTAS PARA O ACOMPANHAMENTO DA QUALIDADE DE VIDA, ATIVIDADE E CONTROLE DO ANGIOEDEMA HEREDITÁRIO?
As crises de AEH podem causar danos não apenas físicos, mas também psicológicos, como medo de óbito por asfixia durante crises laríngeas, temor por não ter o medicamento específico em caso de crise, medo de não ter médico que conheça sua doença no caso de atendimento de urgência, culpa por transmitir a doença para seus filhos, entre muitos outros146. Além disso, o aspecto imprevisível e potencialmente fatal da doença leva frequentemente à ansiedade, depressão, estresse ou risco de outros transtornos mentais, com comprometimento marcante da qualidade de vida dos pacientes e dos seus familiares147-156.
Nas últimas três décadas tornou-se frequente avaliar a qualidade de vida (QoL) de forma objetiva em diversas enfermidades, mas só recentemente tem se estudado o impacto do AEH sobre a QoL dos pacientes afetados157,158. Está bem estabelecido que o AEH afeta profundamente a qualidade de vida dos acometidos, tanto na esfera física, como psicológica e social22. Mensurar objetivamente a QoL destes pacientes pode contribuir para melhorar a abordagem terapêutica e avaliar a resposta ao tratamento instituído.
Existem dois questionários para avaliar a QoL de pacientes com AEH maiores de 18 anos. O Hereditary Angioedema Quality of Life questionnaire (HAE-QoL) aborda sete domínios: aspectos físicos e saúde, estigmas relacionados à doença, aspectos sociais e emocionais, preocupação com a prole, controle percebido sobre a doença, saúde mental e dificuldades no tratamento, com pontuação de 25 a 135, onde 25 é o pior estado geral de saúde, e 135 o melhor159-161. O Angioedema Quality of Life questionnaire (AE-Qol) é um questionário sintoma-específico para qualquer tipo de angioedema recorrente, e abrange quatro dimensões: capacidade funcional, fadiga, medo e alimentação, com pontuação de 0 a 100, onde zero corresponde ao melhor estado geral de saúde, e 100 ao pior162. O AE-QoL tem sido usado em estudos clínicos para avaliar efeito de novas terapias para AEH163.
O Angioedema Activity Score (AAS) foi o primeiro instrumento desenvolvido com a finalidade de avaliar a atividade do angioedema. É validado para todas as formas de angioedema recorrente, incluindo AEH, onde os pacientes documentam a presença ou ausência de angioedema nas últimas 24 horas. Se houver angioedema, é necessário responder a cinco perguntas adicionais, cada uma com pontuação de 0 a 3 pontos. De acordo com o período de tempo de registro dos sintomas, a pontuação mínima e máxima para o AAS consiste em: 0 a 15 (AAS: diário); 0 a 105 (AAS7: semanal) e 0 a 420 (AAS28: mensal)164.
Recentemente, foi desenvolvido o Angioedema Control Test (AECT), que é a primeira ferramenta para avaliar o controle da doença em pacientes com qualquer tipo de angioedema recorrente165. É composto por quatro questões, relacionadas à frequência, qualidade de vida, imprevisibilidade da doença, e tratamento, com escore de 0 a16, onde 16 é controle total, sendo que um escore ≥ 10 significa bom controle, e < 10 a falta de controle. No Brasil, o AECT está em processo de validação.
Todas estas ferramentas permitem mensurar a qualidade de vida, atividade e controle do AEH e auxiliam no manejo da doença, pois permitem uma compreensão mais ampla e objetiva, ajudando no ajuste do tratamento dos pacientes com AEH. Entretanto, existe a necessidade de padronizar o uso dessas ferramentas em crianças e seus cuidadores.
COMO FUNCIONAM E QUAIS SÃO AS FUNÇÕES DAS ASSOCIAÇÕES DE PACIENTES COM ANGIOEDEMA HEREDITÁRIO?
As primeiras associações de pacientes com doenças crônicas surgiram na década de 1950 e, desde então, houve um movimento crescente para fortalecimento dessas instituições. Nas últimas décadas, esse movimento baseou-se nas afirmações de que esses pacientes são um grupo que enfrenta obstáculos semelhantes, as experiências compartilhadas constituem um conhecimento diferente daqueles dos profissionais da saúde e que era legítimo o paciente ter direito de opinar nas decisões sobre sua doença. Estratégias para valorizar os pacientes e cuidadores podem melhorar os resultados em saúde, levando à tomada de decisões eficazes, gestão de complicações da doença, melhor comportamento em relação a saúde, fortalecimento dos grupos de apoio e uso eficiente dos serviços de saúde166.
Nesse contexto, foram criadas em vários países, associações de pacientes com angioedema hereditário (AEH), com objetivo de dar maior visibilidade e divulgar informações sobre a existência desta doença, oferecendo amplo apoio aos pacientes, familiares e cuidadores de pacientes com AEH. Estas instituições defendem a ideia de que em todos os locais do mundo, os pacientes com AEH devem ter acesso a todos os recursos necessários para o controle de seus sintomas, e com isso, garantir uma adequada qualidade de vida que permita a realização de suas atividades laborativas, escolares e a melhora dos relacionamentos interpessoais3.
Internacionalmente, a Hereditary Angioedema International (HAEi) é uma rede global de associações de pacientes, sem fins lucrativos, que foi criada com o objetivo de melhorar a vida dos indivíduos com AEH. A HAEi, que atualmente possui 93 países associados, fornece às suas organizações membros, ferramentas e assistência técnica especialmente desenvolvidas para promover educação sobre a doença e atividades de apoio que atendam às necessidades exclusivas dos pacientes com AEH e familiares. Além disso, também atua no incentivo a pesquisa clínica na geração de vários novos fármacos para o tratamento do AEH, em parceria com Centros de Referência e Excelência em Angioedema (ACARE) para melhorar ainda mais a qualidade do atendimento clínico e assistência ao paciente13.
No Brasil, a Associação Brasileira de Angioedema Hereditário (Abranghe) foi fundada em abril de 2010 por meio da iniciativa de pacientes com AEH. A Abranghe também vem trabalhando no sentido de fornecer suporte e representar os interesses dos portadores de AEH. Esta associação oferece informações sobre a doença, principais centros de referência especializados em AEH no país, fornece materiais educativos e participa de eventos nacionais e internacionais. Além disso, faz o registro de pacientes com diagnóstico confirmado da doença e fornece aos mesmos um cartão de identificação. O contato com a Abranghe pode ser feito por telefone, e-mail ou redes sociais167.
Devemos ressaltar que um papel importante das associações de pacientes é impulsionar a sensibilização de gestores quanto ao reconhecimento do AEH como uma condição crônica incapacitante e potencialmente fatal. Portanto, essas entidades podem auxiliar na elaboração de políticas públicas para melhorar o acesso aos meios diagnósticos e terapêuticos, objetivando assim, reduzir a morbidade e mortalidade e proporcionar uma vida mais digna a estes pacientes. A exemplo destas políticas, a Portaria GM/MS N° 199 de 30/01/2014 instituiu a política nacional de atenção integral às pessoas com doenças raras, aprovou as diretrizes para atenção integral às pessoas com doenças raras no SUS e institui incentivos financeiros de custeio para o diagnóstico dessas doenças168.
O acesso ao tratamento, considerado de alto custo, ainda tem sido um grande desafio enfrentado pelas associações que lutam pelos direitos dos pacientes com AEH. No âmbito do SUS, em quase todos os estados brasileiros o acesso aos medicamentos ocorre na maioria das vezes, por judicialização. No serviço privado, raramente as operadoras de saúde liberam os medicamentos indicados na profilaxia e para crise. Isso demonstra que estas políticas ainda necessitam ser mais aprimoradas para que todos tenham a garantia do acesso ao tratamento.
Cabe às associações de pacientes com AEH, o papel de educar pacientes e cuidadores, informar a população geral sobre a doença e aumentar a conscientização sobre os problemas relacionados ao AEH, para conquistar legitimidade social e dar visibilidade às suas demandas. Também é de vital importância que líderes e associações entendam as complexidades, as leis, as diretrizes e os processos envolvidos no acesso aos medicamentos, pois isso levará a imensuráveis benefícios aos portadores desta doença169.
CONSIDERAÇÕES FINAIS
Especialistas da Associação Brasileira de Alergia e Imunologia (ASBAI) e do Grupo de Estudos Brasileiro em Angioedema Hereditário (GEBRAEH) atualizaram essas diretrizes para a terapia do AEH, com o objetivo de ajudar os profissionais da área da saúde na identificação e abordagem desta doença. O AEH atualmente é menos negligenciado, mas ainda é necessário continuar progredindo com um olhar crítico para os novos desafios e lutando para um melhor cuidado aos pacientes com AEH.
Todos os medicamentos aprovados para o AEH no Brasil até o momento podem ter autoadministração domiciliar, sendo este aspecto fundamental no nosso país, pois em vários locais o acesso a unidades de saúde é precário, e o tratamento precoce de uma crise é muito importante, seja por apresentar melhores resultados, como também reduzir o sofrimento do paciente.
Novos medicamentos para a profilaxia de longo prazo como o pdC1-INH SC e o lanadelumabe, com ações específicas no sistema de cininas-calicreína, têm o potencial de reduzir significativamente o número de crises, além de poderem ser administrados por via subcutânea, contribuindo para uma melhora expressiva na qualidade de vida dos pacientes. Embora o custo desses medicamentos seja elevado, alguns pacientes com crises graves e muito frequentes, e que não melhoram mesmo com o uso de andrógenos atenuados, necessitam ter acesso a eles. Deve ser enfatizado que o uso de terapias preventivas para as crises não substituem a necessidade de acesso a medicamentos para o tratamento das crises.
Outros medicamentos irão surgir com o potencial de melhorar ainda mais o cuidado desses pacientes. O médico especialista em Alergia e Imunologia desempenha um papel fundamental nesse processo, sendo necessário um conhecimento mais atualizado e abrangente sobre o angioedema hereditário.
Permanecem como importantes desafios o acesso dos pacientes aos medicamentos mais novos e eficazes, e a liberação de medicamentos para pacientes pediátricos.
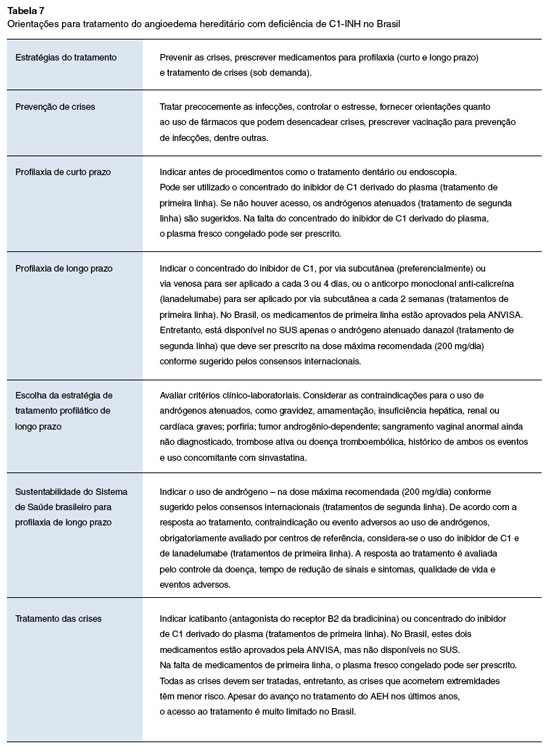
As orientações finais para o tratamento do angioedema hereditário com deficiência do inibidor de C1 se encontram sintetizadas na Tabela 7.
REFERÊNCIAS
1. Maurer M, Aygören-Pürsün E, Banerji A, Bernstein JA, Balle Boysen H, Busse PJ, et al. Consensus on Treatment Goals in Hereditary Angioedema: A Global Delphi Initiative. J Allergy Clin Immunol. 2021;148(6):1526-32. doi: 10.1016/j.jaci.2021.05.016.
2. Busse PJ, Christiansen SC, Riedl MA, Banerji A, Bernstein JA, Castaldo AJ, et al. US HAEA Medical Advisory Board 2020 Guidelines for the Management of Hereditary Angioedema. J Allergy Clin Immunol Pract. 2021;9(1):132-50.e3. doi: 10.1016/j.jaip.2020.08.046.
3. Maurer M, Magerl M, Betschel S, Aberer W, Ansotegui IJ, Aygören-Pürsün E, et al. The International WAO/EAACI Guideline for the Management of Hereditary Angioedema-The 2021 Revision and Update. Allergy. 2022. doi: 10.1111/all.15214.
4. Caballero T. Treatment of Hereditary Angioedema. J Investig Allergol Clin Immunol. 2021;31(1):1-16. doi: 10.18176/jiaci.0653.
5. Riedl MA. Creating a Comprehensive Treatment Plan for Hereditary Angioedema. Immunol Allergy Clin North Am. 2013;33(4):471-85. doi: 10.1016/j.iac.2013.07.003.
6. Settipane RA, Bukstein DA, Riedl MA. Hereditary Angioedema and Shared Decision Making. Allergy Asthma Proc. 2020;41(Suppl 1):S55-S60. doi: 10.2500/aap.2020.41.200057.
7. Campos R de A, Valle SOR, Toledo EC. Hereditary Angioedema: A Disease Seldom Diagnosed by Pediatricians. J Pediatr (Rio J) 2021;97 Suppl 1:S10-S16. doi: 10.1016/j.jped.2020.10.011.
8. Farkas H, Martinez-Saguer I, Bork K, Bowen T, Craig T, Frank M, et al. International Consensus on the Diagnosis and Management of Pediatric Patients with Hereditary Angioedema with C1 Inhibitor Deficiency. Allergy. 2017;72(2):300-13. doi: 10.1111/all.13001.
9. Pancholy N, Craig T. Hereditary Angioedema in Children: A Review and Update. Curr Opin Pediatr. 2019;31(6):863-8. doi: 10.1097/MOP.0000000000000832.
10. Craig T, Aygören-Pürsün E, Bork K, Bowen T, Boysen H, Farkas H, et al. WAO Guideline for the Management of Hereditary Angioedema. World Allergy Organ J. 2012;5(12):182-9. doi: 10.1097/WOX.0b013e318279affa.
11. Dagen C, Craig TJ. Treatment of Hereditary Angioedema: Items that need to be addressed in practice parameter. Allergy Asthma Clin Immunol. 2010;6(1):11. doi: 10.1186/1710-1492-6-11.
12. Valle SOR, França AT, Campos RA, Grumach AS. Angioedema Hereditário. Rev bras alerg imunopatol. 2010;33(3):80-7.
13. Paige D, Maina N, Anderson JT. Hereditary Angioedema: Comprehensive Management Plans and Patient Support. Allergy Asthma Proc. 2020;41(Suppl 1):S38-S42. doi: 10.2500/aap.2020.41.200059.
14. Banerji A, Anderson J, Johnston DT. Optimal Management of Hereditary Angioedema: Shared Decision-Making. J Asthma Allergy. 2021;14:119-25. doi: 10.2147/JAA.S284029.
15. Betschel S, Badiou J, Binkley K, Borici-Mazi R, Hébert J, Kanani A, et al. The International/Canadian Hereditary Angioedema Guideline. Allergy Asthma Clin Immunol. 2019;15(1):72. doi: 10.1186/s13223-019-0376-8.
16. Caballero T, Baeza ML, Cabañas R, Campos A, Cimbollek S, Gómez-Traseira C, et al. Consensus Statement on the Diagnosis, Management, and Treatment of Angioedema Mediated by Bradykinin. Part I. Classification, Epidemiology, Pathophysiology, Genetics, Clinical Symptoms, and Diagnosis. J Investig Allergol Clin Immunol. 2011;21(5):333-47.
17. Brasil. Ministério da Saúde. Manual dos Centros de Referência para Imunobiológicos Especiais. 5ª ed., 2019.
18. Serpa FS, Mansour E, Aun MV, Giavina-Bianchi P, Chong HJ, Arruda LK, et al. Hereditary Angioedema: How to Approach It at the Emergency Department? Einstein (São Paulo). 2021;19:eRW5498. doi: 10.31744/einstein_journal/2021RW5498.
19. Fijen LM, Levi M, Cohn DM. COVID-19 Vaccination and the Risk of Swellings in Patients with Hereditary Angioedema. J Allergy Clin Immunol Pract. 2021;9(11):4156-8. doi: 10.1016/j.jaip.2021.08.039.
20. Valle SOR, Alonso MLO, Tortora RP, Abe AT, Levy SAP, Dortas SD. Hereditary Angioedema: Screening of First-Degree Blood Relatives and Earlier Diagnosis. Allergy Asthma Proc. 2019;40(4):279-81. doi: 10.2500/aap.2019.40.4213.
21. Giavina-Bianchi P, Arruda LK, Aun MV, Campos RA, Chong-Neto HJ, Constantino-Silva RN, et al. Diretrizes brasileiras para o diagnóstico e tratamento do angioedema hereditário - 2017. Arq Asma Alerg Imunol. 2017;1(1):23-48. doi: 10.5935/2526-5393.20170005.
22. Bork K, Anderson JT, Caballero T, Craig T, Johnston DT, Li HH, et al. Assessment and Management of Disease Burden and Quality of Life in Patients with Hereditary Angioedema: A Consensus Report. Allergy Asthma Clin Immunol. 2021;17(1):40. doi: 10.1186/s13223-021-00537-2.
23. Cicardi M, Castelli R, Zingale LC, Agostoni A. Side Effects of Long-Term Prophylaxis with Attenuated Androgens in Hereditary Angioedema: Comparison of Treated and Untreated Patients. J Allergy Clin Immunol. 1997;99(2):194-6. doi: 10.1016/s0091-6749(97)70095-2.
24. Füst G, Farkas H, Csuka D, Varga L, Bork K. Long-Term Efficacy of Danazol Treatment in Hereditary Angioedema. Eur J Clin Invest. 2011;41(3):256-62. doi: 10.1111/j.1365-2362.2010.02402.x.
25. Riedl MA. Critical Appraisal of Androgen Use in Hereditary Angioedema: A Systematic Review. Ann Allergy Asthma Immunol. 2015;114(4):281-288.e7. doi: 10.1016/j.anai.2015.01.003.
26. Cicardi M, Bork K, Caballero T, Craig T, Li HH, Longhurst H, et al. Evidence-Based Recommendations for the Therapeutic Management of Angioedema Owing to Hereditary C1 Inhibitor Deficiency: Consensus Report of an International Working Group. Allergy. 2012;67(2):147-57. doi: 10.1111/j.1398-9995.2011.02751.x.
27. Sheffer AL, Austen KF, Rosen FS. Tranexamic Acid Therapy in Hereditary Angioneurotic Edema. N Engl J Med. 1972;287(9):452-4. doi: 10.1056/NEJM197208312870907.
28. Wintenberger C, Boccon-Gibod I, Launay D, Fain O, Kanny G, Jeandel PY, et al. Tranexamic Acid as Maintenance Treatment for Non-Histaminergic Angioedema: Analysis of Efficacy and Safety in 37 Patients. Clin Exp Immunol. 2014;178(1):112-7. doi: 10.1111/cei.12379.
29. Tengborn L, Blombäck M, Berntorp E. Tranexamic Acid - an Old Drug Still Going Strong and Making a Revival. Thromb Res. 2015;135(2):231-42. doi: 10.1016/j.thromres.2014.11.012.
30. Zuraw BL, Busse PJ, White M, Jacobs J, Lumry W, Baker J, et al. Nanofiltered C1 Inhibitor Concentrate for Treatment of Hereditary Angioedema. N Engl J Med. 2010;363(6):513-22. doi: 10.1056/NEJMoa0805538.
31. Terpstra FG, Kleijn M, Koenderman AHL, Over J, van Engelenburg FAC, Schuitemaker H, et al. Viral Safety of C1-Inhibitor NF. Biologicals. 2007;35(3):173-81. doi: 10.1016/j.biologicals.2006.08.005.
32. Maurer M, Magerl M, Ansotegui I, Aygören-Pürsün E, Betschel S, Bork K, et al. The International WAO/EAACI Guideline for the Management of Hereditary Angioedema-The 2017 Revision and Update. Allergy. 2018;73(8):1575-1596. doi: 10.1111/all.13384.
33. Bork K, Hardt J. Hereditary Angioedema: Long-Term Treatment with One or More Injections of C1 Inhibitor Concentrate per Week. Int Arch Allergy Immunol. 2011;154(1):81-8. doi: 10.1159/000319213.
34. Waytes AT, Rosen FS, Frank MM. Treatment of Hereditary Angioedema with a Vapor-Heated C1 Inhibitor Concentrate. N Engl J Med. 1996;334(25):1630-4. doi: 10.1056/NEJM199606203342503.
35. Tallroth GA. Long-Term Prophylaxis of Hereditary Angioedema with a Pasteurized C1 Inhibitor Concentrate. Int Arch Allergy Immunol. 2011;154(4):356-9. doi: 10.1159/000321830.
36. Kreuz W, Martinez-Saguer I, Aygören-Pürsün E, Rusicke E, Heller C, Klingebiel T. C1-Inhibitor Concentrate for Individual Replacement Therapy in Patients with Severe Hereditary Angioedema Refractory to Danazol Prophylaxis. Transfusion. 2009;49(9):1987-95. doi: 10.1111/j.1537-2995.2009.02230.x.
37. Frank MM. Hereditary Angiodema: A Current State-of-the-Art Review, VI: Novel Therapies for Hereditary Angioedema. Ann Allergy Asthma Immunol 2008;100(1 Suppl 2):S23-29. doi: 10.1016/s1081-1206(10)60583-2.
38. Bernstein JA, Ritchie B, Levy RJ, Wasserman RL, Bewtra AK, Hurewitz DS, et al. Population Pharmacokinetics of Plasma-Derived C1 Esterase Inhibitor Concentrate Used to Treat Acute Hereditary Angioedema Attacks. Ann Allergy Asthma Immunol. 2010;105(2):149-54. doi: 10.1016/j.anai.2010.06.005.
39. Zuraw BL, Cicardi M, Longhurst HJ, Bernstein JA, Li HH, Magerl M, et al. Phase II Study Results of a Replacement Therapy for Hereditary Angioedema with Subcutaneous C1-Inhibitor Concentrate. Allergy. 2015;70(10):1319-28. doi: 10.1111/all.12658.
40. Reshef A, Moldovan D, Obtulowicz K, Leibovich I, Mihaly E, Visscher S, et al. Recombinant Human C1 Inhibitor for the Prophylaxis of Hereditary Angioedema Attacks: A Pilot Study. Allergy. 2013;68(1):118-24. doi: 10.1111/all.12060.
41. Farkas H, Varga L. Human Plasma-Derived, Nanofiltered, C1-Inhibitor Concentrate (Cinryze®), a Novel Therapeutic Alternative for the Management of Hereditary Angioedema Resulting from C1-Inhibitor Deficiency. Biol Ther. 2012;2:2. doi: 10.1007/s13554-012-0002-5.
42. Craig TJ, Bewtra AK, Bahna SL, Hurewitz D, Schneider LC, Levy RJ, et al. C1 Esterase Inhibitor Concentrate in 1085 Hereditary Angioedema Attacks - Final Results of the I.M.P.A.C.T.2 Study. Allergy. 2011;66(12):1604-1611. doi: 10.1111/j.1398-9995.2011.02702.x.
43. Gandhi PK, Gentry WM, Bottorff MB. Thrombotic Events Associated with C1 Esterase Inhibitor Products in Patients with Hereditary Angioedema: Investigation from the United States Food and Drug Administration Adverse Event Reporting System Database. Pharmacotherapy. 2012;32(10):902-9. doi: 10.1002/j.1875-9114.2012.01126.
44. Farkas H, Kőhalmi KV, Veszeli N, Zotter Z, Várnai K, Varga L. Risk of Thromboembolism in Patients with Hereditary Angioedema Treated with Plasma-Derived C1-Inhibitor. Allergy Asthma Proc. 2016;37(2):164-70. doi: 10.2500/aap.2016.37.3933.
45. Crowther M, Bauer KA, Kaplan AP. The Thrombogenicity of C1 Esterase Inhibitor (Human): Review of the Evidence. Allergy Asthma Proc. 2014;35(6):444-53. doi: 10.2500/aap.2014.35.3799.
46. Longhurst H, Cicardi M, Craig T, Bork K, Grattan C, Baker J, et al. Prevention of Hereditary Angioedema Attacks with a Subcutaneous C1 Inhibitor. N Engl J Med. 2017;376(12):1131-40. doi: 10.1056/NEJMoa1613627.
47. Brasill. Ministério Da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Bulário Eletrônico. Berinert: Pó Liofilizado Para Solução Injetável. Bula Profissional do Medicamento [Internet]. Brasília (DF): ANVISA; 2021. Disponível em: https://Consultas.Anvisa.Gov.Br/#/Bulario/q/?NomeProduto=berinert. 2021.
48. Craig T, Zuraw B, Longhurst H, Cicardi M, Bork K, Grattan C, et al. Long-Term Outcomes with Subcutaneous C1-Inhibitor Replacement Therapy for Prevention of Hereditary Angioedema Attacks. J Allergy Clin Immunol Pract. 2019;7(6):1793-1802.e2. doi: 10.1016/j.jaip.2019.01.054.
49. Zuraw B, Cicardi M, Levy RJ, Nuijens JH, Relan A, Visscher S, et al. Recombinant Human C1-Inhibitor for the Treatment of Acute Angioedema Attacks in Patients with Hereditary Angioedema. J Allergy Clin Immunol. 2010;126(4):821-7.e14. doi: 10.1016/j.jaci.2010.07.021.
50. Riedl MA, Bernstein JA, Li H, Reshef A, Lumry W, Moldovan D, et al. Recombinant Human C1-Esterase Inhibitor Relieves Symptoms of Hereditary Angioedema Attacks: Phase 3, Randomized, Placebo-Controlled Trial. Ann Allergy Asthma Immunol. 2014;112(2):163-9.e1. doi: 10.1016/j.anai.2013.12.004.
51. Farrell C, Hayes S, Relan A, van Amersfoort ES, Pijpstra R, Hack CE. Population Pharmacokinetics of Recombinant Human C1 Inhibitor in Patients with Hereditary Angioedema. Br J Clin Pharmacol. 2013;76(6):897-907. doi: 10.1111/bcp.12132.
52. Hemperly SE, Agarwal NS, Xu Y-Y, Zhi Y-X, Craig TJ. Recent Advances in the Management of Hereditary Angioedema. J Am Osteopath Assoc. 2013;113(7):546-55. doi: 10.7556/jaoa.2013.006.
53. Banerji A, Riedl MA, Bernstein JA, Cicardi M, Longhurst HJ, Zuraw BL, et al. Effect of Lanadelumab Compared With Placebo on Prevention of Hereditary Angioedema Attacks: A Randomized Clinical Trial. JAMA. 2018;320(20):2108-21. doi: 10.1001/jama.2018.16773.
54. Riedl MA, Maurer M, Bernstein JA, Banerji A, Longhurst HJ, Li HH, et al. Lanadelumab Demonstrates Rapid and Sustained Prevention of Hereditary Angioedema Attacks. Allergy 2020;75(11):2879-2887. doi: 10.1111/all.14416.
55. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Bulário Eletrônico. Takhzyro: Solução Injetável. Bula Profissional do Medicamento [Internet]. Brasília (DF): ANVISA; 2021. Disponível em: https://Consultas.Anvisa.Gov.Br/#/Bulario/q/?NomeProduto=TAKHZYRO. 2021.
56. Buttgereit T, Vera C, Weller K, Gutsche A, Grekowitz EM, Aykanat S, et al. Lanadelumab Efficacy, Safety, and Injection Interval Extension in HAE: A Real-Life Study. J Allergy Clin Immunol Pract. 2021;9(10):3744-51. doi: 10.1016/j.jaip.2021.04.072.
57. Garcia JFB, Takejima P, Veronez CL, Aun MV, Motta AA, Kalil J, et al. Use of PdC1-INH Concentrate for Long-Term Prophylaxis during Pregnancy in Hereditary Angioedema with Normal C1-INH. J Allergy Clin Immunol Pract. 2018;6(4):1406-8. doi: 10.1016/j.jaip.2017.12.022.
58. Bork K. Diagnosis and Treatment of Hereditary Angioedema with Normal C1 Inhibitor. Allergy Asthma Clin Immunol. 2010;6(1):15. doi: 10.1186/1710-1492-6-15.
59. Bork K, Wulff K, Hardt J, Witzke G, Staubach P. Hereditary Angioedema Caused by Missense Mutations in the Factor XII Gene: Clinical Features, Trigger Factors, and Therapy. J Allergy Clin Immunol. 2009;124(1):129-34. doi: 10.1016/j.jaci.2009.03.038.
60. Saule C, Boccon-Gibod I, Fain O, Kanny G, Plu-Bureau G, Martin L, et al. Benefits of Progestin Contraception in Non-Allergic Angioedema. Clin Exp Allergy. 2013;43(4):475-82. doi: 10.1111/cea.12055.
61. Bork K, Wulff K, Witzke G, Hardt J. Treatment for Hereditary Angioedema with Normal C1-INH and Specific Mutations in the F12 Gene (HAE-FXII). Allergy. 2017;72(2):320-4. doi: 10.1111/all.13076.
62. Bernstein JA. Managing Hereditary Angioedema Patients Undergoing Otolaryngeal Procedures. Am J Rhinol Allergy. 2013;27(6):522-7. doi: 10.2500/ajra.2013.27.3964.
63. Aygören-Pürsün E, Martinez Saguer I, Kreuz W, Klingebiel T, Schwabe D. Risk of Angioedema Following Invasive or Surgical Procedures in HAE Type I and II - the Natural History. Allergy. 2013;68(8):1034-9. doi: 10.1111/all.12186.
64. Jurado-Palomo J, Muñoz-Caro JM, López-Serrano MC, Prior N, Cabañas R, Pedrosa M, et al. Management of Dental-Oral Procedures in Patients with Hereditary Angioedema Due to C1 Inhibitor Deficiency. J Investig Allergol Clin Immunol. 2013;23(1):1-6.
65. Bork K, Hardt J, Staubach-Renz P, Witzke G. Risk of Laryngeal Edema and Facial Swellings after Tooth Extraction in Patients with Hereditary Angioedema with and without Prophylaxis with C1 Inhibitor Concentrate: A Retrospective Study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2011;112(1):58-64. doi: 10.1016/j.tripleo.2011.02.034.
66. Zanichelli A, Ghezzi M, Santicchia I, Vacchini R, Cicardi M, Sparaco A, et al. Short-Term Prophylaxis in Patients with Angioedema Due to C1-Inhibitor Deficiency Undergoing Dental Procedures: An Observational Study. PLoS One. 2020;15(3):e0230128. doi: 10.1371/journal.pone.0230128.
67. Bork K. Pasteurized and Nanofiltered, Plasma-Derived C1 Esterase Inhibitor Concentrate for the Treatment of Hereditary Angioedema. Immunotherapy. 2014;6(5):533-51. doi: 10.2217/imt.14.33.
68. Magerl M, Frank M, Lumry W, Bernstein J, Busse P, Craig T, et al. Short-Term Prophylactic Use of C1-Inhibitor Concentrate in Hereditary Angioedema: Findings from an International Patient Registry. Ann Allergy Asthma Immunol. 2017;118(1):110-2. doi: 10.1016/j.anai.2016.10.006.
69. Navarro Ruiz A, Crespo Diz C, Poveda Andrés JL, Cebollero de Torre A. Algoritmo de diagnóstico y tratamiento del angioedema hereditario como herramienta para su. Farmacia Hospitalaria. 2013;(6):521-9. doi: 10.7399/FH.2013.37.6.980.
70. Galan HL, Reedy MB, Starr J, Knight AB. Fresh Frozen Plasma Prophylaxis for Hereditary Angioedema during Pregnancy. A Case Report. J Reprod Med. 1996;41(7):541-4.
71. Bhardwaj N, Craig TJ. Treatment of Hereditary Angioedema: A Review (CME). Transfusion. 2014;54(11):2989-96. doi: 10.1111/trf.12674.
72. Lumry WR. Management and Prevention of Hereditary Angioedema Attacks. Am J Manag Care. 2013;19(7 Suppl):s111-8.
73. Farkas H, Gyeney L, Gidófalvy E, Füst G, Varga L. The Efficacy of Short-Term Danazol Prophylaxis in Hereditary Angioedema Patients Undergoing Maxillofacial and Dental Procedures. J Oral Maxillofac Surg. 1999;57(4):404-8. doi: 10.1016/s0278-2391(99)90280-x.
74. Vázquez DO, Josviak DO, Fantini CA, Fili NL, Berardi AM, Zwiener RD, et al. Consenso argentino de diagnóstico y tratamiento del angioedema hereditario. Revista Alergia México. 2021;68(Suplemento 2):s1-s22. doi: 10.29262/ram.v68i6.914.
75. Longhurst HJ, Bork K. Hereditary Angioedema: An Update on Causes, Manifestations and Treatment. Br J Hosp Med. 2019;80(7):391-8. doi: 10.12968/hmed.2019.80.7.391.
76. Banerji A, Busse P, Christiansen SC, Li H, Lumry W, Davis-Lorton M, et al. Current State of Hereditary Angioedema Management: A Patient Survey. Allergy Asthma Proc 2015;36(3):213-217. doi: 10.2500/aap.2015.36.3824.
77. Christiansen SC, Bygum A, Banerji A, Busse P, Li H, Lumry W, et al. Before and after, the Impact of Available on-Demand Treatment for HAE. Allergy Asthma Proc. 2015;36(2):145-50. doi: 10.2500/aap.2015.36.3831.
78. Moellman JJ, Bernstein JA, Lindsell C, Banerji A, Busse PJ, Camargo CA, et al. A Consensus Parameter for the Evaluation and Management of Angioedema in the Emergency Department. Acad Emerg Med. 2014;21(4):469-84. doi: 10.1111/acem.12341.
79. Bork K, Staubach P, Eckardt AJ, Hardt J. Symptoms, Course, and Complications of Abdominal Attacks in Hereditary Angioedema Due to C1 Inhibitor Deficiency. Am J Gastroenterol. 2006;101(3):619-7. doi: 10.1111/j.1572-0241.2006.00492.x.
80. Cicardi M, Bellis P, Bertazzoni G, Cancian M, Chiesa M, Cremonesi P, et al. Guidance for Diagnosis and Treatment of Acute Angioedema in the Emergency Department: Consensus Statement by a Panel of Italian Experts. Intern Emerg Med. 2014;9(1):85-92. doi: 10.1007/s11739-013-0993-z.
81. Brasil. Ministério Da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Bulário Eletrônico. Cinryze: Pó Liofilizado. Bula Profissional do Medicamento [Internet]. Brasília (DF): ANVISA; 2022. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=Cinryze . 2022.
82. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Bulário Eletrônico. Firazyr: Solução Injetável. Bula Profissional do Medicamento [Internet]. Brasília (DF): ANVISA; 2019 [citado 2022 Mar 29]. Disponível em: http://www.Anvisa.Gov.Br/Datavisa/Fila_bula/Index.Asp. 2019.
83. Bork K, Bernstein JA, Machnig T, Craig TJ. Efficacy of Different Medical Therapies for the Treatment of Acute Laryngeal Attacks of Hereditary Angioedema Due to C1-Esterase Inhibitor Deficiency. J Emerg Med. 2016;50(4):567-80.e1. doi: 10.1016/j.jemermed.2015.11.008.
84. Valerieva A, Staevska MT, Grivcheva-Panovska V, Jesenak M, Kőhalmi KV, Hrubiskova K, et al. Recombinant Human C1 Esterase Inhibitor for Hereditary Angioedema Attacks: A European Registry. World Allergy Organ J. 2021;14(4):100535. doi: 10.1016/j.waojou.2021.100535.
85. Cicardi M, Banerji A, Bracho F, Malbrán A, Rosenkranz B, Riedl M, et al. Icatibant, a New Bradykinin-Receptor Antagonist, in Hereditary Angioedema. N Engl J Med. 2010;363(6):532-41. doi: 10.1056/NEJMoa0906393.
86. Lumry WR, Li HH, Levy RJ, Potter PC, Farkas H, Moldovan D, et al. Randomized Placebo-Controlled Trial of the Bradykinin B₂ Receptor Antagonist Icatibant for the Treatment of Acute Attacks of Hereditary Angioedema: The FAST-3 Trial. Ann Allergy Asthma Immunol. 2011;107(6):529-37. doi: 10.1016/j.anai.2011.08.015.
87. Maurer M, Aberer W, Bouillet L, Caballero T, Fabien V, Kanny G, et al. Hereditary Angioedema Attacks Resolve Faster and Are Shorter after Early Icatibant Treatment. PLoS One. 2013;8(2):e53773. doi: 10.1371/journal.pone.0053773.
88. Aberer W, Maurer M, Reshef A, Longhurst H, Kivity S, Bygum A, et al. Open-Label, Multicenter Study of Self-Administered Icatibant for Attacks of Hereditary Angioedema. Allergy. 2014;69(3):305-14. doi: 10.1111/all.12303.
89. Cicardi M, Levy RJ, McNeil DL, Li HH, Sheffer AL, Campion M, et al. Ecallantide for the Treatment of Acute Attacks in Hereditary Angioedema. N Engl J Med. 2010;363(6):523-31. doi: 10.1056/NEJMoa0905079.
90. Jindal AK, Reshef A, Longhurst H; GEHM workgroup (Global Equity in HAE Management). Mitigating Disparity in Health-Care Resources Between Countries for Management of Hereditary Angioedema. Clin Rev Allergy Immunol. 2021;61(1):84-97. doi: 10.1007/s12016-021-08854-5.
91. Christiansen SC, Davis DK, Castaldo AJ, Zuraw BL. Pediatric Hereditary Angioedema: Onset, Diagnostic Delay, and Disease Severity. Clin Pediatr (Phila). 2016;55(10):935-42. doi: 10.1177/0009922815616886.
92. Araújo-Simões J, Boanova AGP, Constantino-Silva RN, Fragnan NTML, Pinto JA, Minafra FG, et al. The Challenges in the Follow-Up and Treatment of Brazilian Children with Hereditary Angioedema. Int Arch Allergy Immunol. 2021;182(7):585-91. doi: 10.1159/000512944.
93. Bork K, Gül D, Hardt J, Dewald G. Hereditary Angioedema with Normal C1 Inhibitor: Clinical Symptoms and Course. Am J Med. 2007;120(11):987-92. doi: 10.1016/j.amjmed.2007.08.021.
94. Johnston DT, Smith RC. Hereditary Angioedema: Special Considerations in Children. Allergy Asthma Proc. 2020;41(Suppl 1):S43-S46. doi: 10.2500/aap.2020.41.200042.
95. Ocak M, Nain E, Şahiner ÜM, Akin MŞ, Karabiber E, Şekerel BE, et al. Recurrent Angioedema in Childhood: Hereditary Angioedema or Histaminergic Angioedema? Pediatr Dermatol. 2021;38(1):143-8. doi: 10.1111/pde.14467.
96. Farkas H, Kőhalmi KV, Visy B, Veszeli N, Varga L. Clinical Characteristics and Safety of Plasma-Derived C1-Inhibitor Therapy in Children and Adolescents with Hereditary Angioedema-A Long-Term Survey. J Allergy Clin Immunol Pract. 2020;8(7):2379-83. doi: 10.1016/j.jaip.2020.02.043.
97. Aygören-Pürsün E, Soteres D, Moldovan D, Christensen J, Van Leerberghe A, Hao J, et al. Preventing Hereditary Angioedema Attacks in Children Using Cinryze®: Interim Efficacy and Safety Phase 3 Findings. Int Arch Allergy Immunol. 2017;173(2):114-9. doi: 10.1159/000477541.
98. Farkas H, Reshef A, Aberer W, Caballero T, McCarthy L, Hao J, et al. Treatment Effect and Safety of Icatibant in Pediatric Patients with Hereditary Angioedema. J Allergy Clin Immunol Pract. 2017;5(6):1671-8.e2. doi: 10.1016/j.jaip.2017.04.010.
99. Fijen LM, Bork K, Cohn DM. Current and Prospective Targets of Pharmacologic Treatment of Hereditary Angioedema Types 1 and 2. Clin Rev Allergy Immunol. 2021;61(1):66-76. doi: 10.1007/s12016-021-08832-x.
100. Cancian M, Perego F, Senter R, Arcoleo F, De Pasquale T, Zoli A, et al. Pediatric Angioedema: Essential Features and Preliminary Results from the Hereditary Angioedema Global Registry in Italy. Pediatr Allergy Immunol. 2020;31 Suppl 24:22-24. doi: 10.1111/pai.13170.
101. Wahn V, Aberer W, Aygören-Pürsün E, Bork K, Eberl W, Faßhauer M, et al. Hereditary Angioedema in Children and Adolescents - A Consensus Update on Therapeutic Strategies for German-Speaking Countries. Pediatr Allergy Immunol. 2020;31(8):974-89. doi: 10.1111/pai.13309.
102. Gompel A, Fain O, Boccon-Gibod I, Gobert D, Bouillet L. Exogenous Hormones and Hereditary Angioedema. International Immunopharmacology. 2020;78:106080. doi: 10.1016/j.intimp.2019.106080.
103. Caballero T, Farkas H, Bouillet L, Bowen T, Gompel A, Fagerberg C, et al. International Consensus and Practical Guidelines on the Gynecologic and Obstetric Management of Female Patients with Hereditary Angioedema Caused by C1 Inhibitor Deficiency. J Allergy Clin Immunol. 2012;129(2):308-20. doi: 10.1016/j.jaci.2011.11.025.
104. Zuraw BL, Bork K, Binkley KE, Banerji A, Christiansen SC, Castaldo A, et al. Hereditary Angioedema with Normal C1 Inhibitor Function: Consensus of an International Expert Panel. Allergy Asthma Proc. 2012;33 Suppl 1:S145-56. doi: 10.2500/aap.2012.33.3627.
105. Martinez-Saguer I, Rusicke E, Aygören-Pürsün E, Heller C, Klingebiel T, Kreuz W. Characterization of Acute Hereditary Angioedema Attacks during Pregnancy and Breast-Feeding and Their Treatment with C1 Inhibitor Concentrate. Am J Obstet Gynecol. 2010;203(2):131.e1-7. doi: 10.1016/j.ajog.2010.03.003.
106. Bouillet L, Longhurst H, Boccon-Gibod I, Bork K, Bucher C, Bygum A, et al. Disease Expression in Women with Hereditary Angioedema. Am J Obstet Gynecol. 2008;199(5):484.e1-4. doi: 10.1016/j.ajog.2008.04.034.
107. Czaller I, Visy B, Csuka D, Füst G, Tóth F, Farkas H. The Natural History of Hereditary Angioedema and the Impact of Treatment with Human C1-Inhibitor Concentrate during Pregnancy: A Long-Term Survey. Eur J Obstet Gynecol Reprod Biol. 2010;152(1):44-9. doi: 10.1016/j.ejogrb.2010.05.008.
108. Debreczeni ML, Németh Z, Kajdácsi E, Farkas H, Cervenak L. Molecular Dambusters: What Is Behind Hyperpermeability in Bradykinin-Mediated Angioedema? Clin Rev Allergy Immunol. 2021;60(3):318-47. doi: 10.1007/s12016-021-08851-8.
109. Bork K, Wulff K, Witzke G, Hardt J. Hereditary Angioedema with Normal C1-INH with versus without Specific F12 Gene Mutations. Allergy. 2015;70(8):1004-12. doi: 10.1111/all.12648.
110. Feray S, Fain O, Kayem G, Sabourdin N, Constant I, Rigouzzo A. Repeated Attacks of Type III Hereditary Angioedema with Factor XII Mutation during Pregnancy. Int J Obstet Anesth. 2018;36:114-8. doi: 10.1016/j.ijoa.2018.07.003.
111. Veronez CL, Moreno AS, Constantino-Silva RN, Maia LSM, Ferriani MPL, Castro FFM, et al. Hereditary Angioedema with Normal C1 Inhibitor and F12 Mutations in 42 Brazilian Families. The Journal of Allergy and Clinical Immunology: In Practice. 2018;6(4):1209-16.e8. doi: 10.1016/j.jaip.2017.09.025.
112. Machado AM, Pires RM, Martins RO, Grumach AS. Pregnancy and Postpartum in Hereditary Angioedema With C1 Inhibitor Deficit in Women Who Have No Access to Therapy. J Investig Allergol Clin Immunol. 2017;27(5):322-3. doi: 10.18176/jiaci.0175.
113. González-Quevedo T, Larco JI, Marcos C, Guilarte M, Baeza ML, Cimbollek S, et al. Management of Pregnancy and Delivery in Patients With Hereditary Angioedema Due to C1 Inhibitor Deficiency. J Investig Allergol Clin Immunol. 2016;26(3):161-7. doi: 10.18176/jiaci.0037.
114. Yakaboski E, Motazedi T, Banerji A. Hereditary Angioedema: Special Considerations in Women. Allergy Asthma Proc. 2020;41(Suppl 1):S47-S50. doi: 10.2500/aap.2020.41.200077.
115. Moldovan D, Bernstein JA, Hakl R, Porebski G, Poarch K, Lumry WR, et al. Safety of Recombinant Human C1 Esterase Inhibitor for Hereditary Angioedema Attacks during Pregnancy. J Allergy Clin Immunol Pract. 2019;7(8):2938-40. doi: 10.1016/j.jaip.2019.05.042.
116. Hakl R, Kuklínek P, Krčmová I, Králíčková P, Freiberger T, Janků P, et al. Treatment of Hereditary Angioedema Attacks with Icatibant and Recombinant C1 Inhibitor During Pregnancy. J Clin Immunol. 2018;38(7):810-5. doi: 10.1007/s10875-018-0553-4.
117. Kaminsky LW, Kelbel T, Ansary F, Craig T. Multiple Doses of Icatibant Used during Pregnancy. Allergy Rhinol (Providence). 2017;8(3):178-81. doi: 10.2500/ar.2017.8.0210.
118. Brooks JP, Radojicic C, Riedl MA, Newcomer SD, Banerji A, Hsu FI. Experience with Intravenous Plasma-Derived C1-Inhibitor in Pregnant Women with Hereditary Angioedema: A Systematic Literature Review. J Allergy Clin Immunol Pract. 2020;8(6):1875-80.e3. doi: 10.1016/j.jaip.2020.03.009.
119. Gibbons KR, Abraham T, Sandhu M, Peppers BP, Girzhel JF, Hostoffer RW. Successful Perinatal Management of Hereditary Angioedema with Normal C1 Esterase Inhibitor and Factor XII Mutation Using C1 Esterase Inhibitor Therapy. Ann Allergy Asthma Immunol. 2017;119(6):558-9. doi: 10.1016/j.anai.2017.08.015.
120. Levy DS, Farkas H, Riedl MA, Hsu FI, Brooks JP, Cicardi M, et al. Long-Term Efficacy and Safety of Subcutaneous C1-Inhibitor in Women with Hereditary Angioedema: Subgroup Analysis from an Open-Label Extension of a Phase 3 Trial. Allergy Asthma Clin Immunol. 2020;16:8. doi: 10.1186/s13223-020-0409-3.
121. Andarawewa S, Aygören-Pürsün E. Subcutaneous C1-Inhibitor Concentrate for Prophylaxis during Pregnancy and Lactation in a Patient with C1-INH-HAE. Clin Case Rep. 2021;9(3):1273-5. doi: 10.1002/ccr3.3743.
122. Gompels MM, Lock RJ, Abinun M, Bethune CA, Davies G, Grattan C, et al. C1 Inhibitor Deficiency: Consensus Document. Clin Exp Immunol. 2005;139(3):379-94. doi: 10.1111/j.1365-2249.2005.02726.x.
123. Moraes CG de FB de, Mikami LR, Ferrari LP, Pesquero JB, Chong-Neto HJ, Rosario Filho NA. Short-Term Prophylaxis for Delivery in Pregnant Women with Hereditary Angioedema with Normal C1-Inhibitor. Rev Bras Ginecol Obstet. 2020;42(12):845-8. doi: 10.1055/s-0040-1718955.
124. Chinniah N, Katelaris CH. Hereditary Angioedema and Pregnancy. Aust N Z J Obstet Gynaecol. 2009;49(1):2-5. doi: 10.1111/j.1479-828X.2008.00945.x.
125. Bhardwaj NR, Espey E. Lactation and Contraception. Curr Opin Obstet Gynecol. 2015;27(6):496-503. doi: 10.1097/GCO.0000000000000216.
126. Pregnancy and Breastfeeding Warnings. Drugs.com [site na Internet]. Disponível em: https://www.drugs.com/pregnancy/ . Acessado em: 03/04/2022.
127. Aygören-Pürsün E, Magerl M, Maetzel A, Maurer M. Epidemiology of Bradykinin-Mediated Angioedema: A Systematic Investigation of Epidemiological Studies. Orphanet J Rare Dis. 2018;13(1):73. doi: 10.1186/s13023-018-0815-5.
128. Farkas H, Stobiecki M, Peter J, Kinaciyan T, Maurer M, Aygören-Pürsün E, et al. Long-Term Safety and Effectiveness of Berotralstat for Hereditary Angioedema: The Open-Label APeX-S Study. Clin Transl Allergy. 2021;11(4):e12035. doi: 10.1002/clt2.12035.
129. Hofman ZLM, Clark CC, Hack CE, de Maat S, Maas C. Detecting Oral Kallikrein-Targeting Therapy through Triggered Contact Activation: A Phase I Study. J Allergy Clin Immunol. 2020;146(6):1446-9.e5. doi: 10.1016/j.jaci.2020.03.038.
130. ANZCTR - Australian New Zealand Clinical Trials Registry. Registration. n.d. [Internet]. Disponível em: https://www.anzctr.org.au/Trial/Registration/TrialReview.aspx?id=375857&isReview=true. Acessado em: 03/04/2022.
131. KalVista Pharmaceuticals, Inc. KVD824 for HAE. [Internet]. Disponível em: https://www.kalvista.com/products-pipeline/kvd824-hae. Acessado em: 03/04/2022.
132. A Phase II, Cross-over Clinical Trial Evaluating the Efficacy and Safety of KVD900 in the On-Demand Treatment of Angioedema Attacks in Adult Subjects With Hereditary Angioedema Type I or II - Tabular View - ClinicalTrials.Gov. [Internet]. Disponível em: https://clinicaltrials.gov/ct2/show/record/NCT04208412. Acessado em: 03/04/2022.
133. Duckworth EJ, Murugesan N, Li L, Rushbrooke LJ, Lee DK, De Donatis GM, et al. Pharmacological Suppression of the Kallikrein Kinin System with KVD900: An Orally Available Plasma Kallikrein Inhibitor for the on-Demand Treatment of Hereditary Angioedema. Clin Exp Allergy. 2022. doi: 10.1111/cea.14122.
134. Maetzel A, Smith MD, Duckworth EJ, Hampton SL, De Donatis GM, Murugesan N, et al. KVD900, an Oral on-Demand Treatment for Hereditary Angioedema: Phase 1 Study Results. J Allergy Clin Immunol. 2022;S0091-6749(21)02666-X. doi: 10.1016/j.jaci.2021.10.038.
135. Cohn DM, Viney NJ, Fijen LM, Schneider E, Alexander VJ, Xia S, et al. Antisense Inhibition of Prekallikrein to Control Hereditary Angioedema. N Engl J Med. 2020;383(13):1242-7. doi: 10.1056/NEJMoa1915035.
136. Ferrone JD, Bhattacharjee G, Revenko AS, Zanardi TA, Warren MS, Derosier FJ, et al. IONIS-PKKRx a Novel Antisense Inhibitor of Prekallikrein and Bradykinin Production. Nucleic Acid Ther. 2019;29(2):82-91. doi: 10.1089/nat.2018.0754.
137. Fijen LM, Riedl MA, Bordone L, Bernstein JA, Raasch J, Tachdjian R, et al. Inhibition of Prekallikrein for Hereditary Angioedema. N Engl J Med. 2022;386(11):1026-33. doi: 10.1056/NEJMoa2109329.
138. Craig T, Magerl M, Levy DS, Reshef A, Lumry WR, Martinez-Saguer I, et al. Prophylactic Use of an Anti-Activated Factor XII Monoclonal Antibody, Garadacimab, for Patients with C1-Esterase Inhibitor-Deficient Hereditary Angioedema: A Randomised, Double-Blind, Placebo-Controlled, Phase 2 Trial. The Lancet. 2022;399(10328):945-55. doi: 10.1016/S0140-6736(21)02225-X.
139. Lesage A, Gibson C, Marceau F, Ambrosi H-D, Saupe J, Katzer W, et al. In Vitro Pharmacological Profile of a New Small Molecule Bradykinin B2 Receptor Antagonist. Front Pharmacol. 2020;11:916. doi: 10.3389/fphar.2020.00916.
140. ClinicalTrials.gov. [Internet]. Pharvaris Netherlands B.V. A Phase II, Double-Blind, Placebo-Controlled, Randomized, Dose-Ranging, Parallel Group Study to Evaluate the Safety and Efficacy of PHA-022121 Administered Orally for Prophylaxis Against Angioedema Attacks in Patients With Hereditary Angioedema Due to C1-Inhibitor Deficiency (Type I or Type II). Clinical trial registration; 2022.
141. ClinicalTrials.gov. [Internet]. Dose-https://clinicaltrials.gov/ct2/show/record/NCT04618211Ranging Study of Oral PHA-022121 for Acute Treatment of Angioedema Attacks in Patients with Hereditary Angioedema - Tabular View. Disponível em: . Acessado em: 03/04/2022.
142. Biomarin. BMN 331 for Hereditary Angioedema (HAE). [Internet]. Disponível em: https://www.biomarin.com/our-treatments/pipeline/bmn-331-for-hae/. Acessado em: 03/04/2022.
143. Qiu T, Chiuchiolo MJ, Whaley AS, Russo AR, Sondhi D, Kaminsky SM, et al. Gene Therapy for C1 Esterase Inhibitor Deficiency in a Murine Model of Hereditary Angioedema. Allergy. 2019;74(6):1081-9. doi: 10.1111/all.13582.
144. REGENXBIO Expands Pipeline Using NAV Vectors to Deliver Therapeutic Antibodies for the Treatment of Hereditary Angioedema and Neurodegenerative Diseases | REGENXBIO Inc. n.d. Disponível em: http://ir.regenxbio.com/news-releases/news-release-details/regenxbio-expands-pipeline-using-nav-vectors-deliver-therapeutic/. Acessado em: 03/04/2022.
145. Forget AL. A Modular CRISPR/Cas9 Genome Editing Platform for Durable Therapeutic Knockout and Targeted Gene Insertion Applications. 16th Annual Meeting of the Oligonucleotide Therapeutics Society. [Internet]. Disponível em: https://3o5c4w3neipl16yvhj3nfqam-wpengine.netdna-ssl.com/wp-content/uploads/Intellia-Therapeutics_Tony-Forget_OTS-2020_final_092920.pdf . Acessado em: 03/04/2022.
146. Crochet J, Lepelley M, Yahiaoui N, Vermorel C, Bosson J-L, Pralong P, et al. Bradykinin Mechanism Is the Main Responsible for Death by Isolated Asphyxiating Angioedema in France. Clin Exp Allergy. 2019;49(2):252-4. doi: 10.1111/cea.13297.
147. Banerji A. The Burden of Illness in Patients with Hereditary Angioedema. Ann Allergy Asthma Immunol. 2013;111(5):329-36. doi: 10.1016/j.anai.2013.08.019.
148. Longhurst H, Bygum A. The Humanistic, Societal, and Pharmaco-Economic Burden of Angioedema. Clin Rev Allergy Immunol. 2016;51(2):230-9. doi: 10.1007/s12016-016-8575-2.
149. Savarese L, Bova M, De Falco R, Guarino MD, De Luca Picione R, Petraroli A, et al. Emotional Processes and Stress in Children Affected by Hereditary Angioedema with C1-Inhibitor Deficiency: A Multicenter, Prospective Study. Orphanet J Rare Dis. 2018;13(1):115. doi: 10.1186/s13023-018-0871-x.
150. Savarese L, Bova M, Maiello A, Petraroli A, Mormile I, Cancian M, et al. Psychological Processes in the Experience of Hereditary Angioedema in Adult Patients: An Observational Study. Orphanet J Rare Dis. 2021;16(1):23. doi: 10.1186/s13023-020-01643-x.
151. Arce-Ayala YM, Diaz-Algorri Y, Craig T, Ramos-Romey C. Clinical Profile and Quality of Life of Puerto Ricans with Hereditary Angioedema. Allergy Asthma Proc. 2019;40(2):103-10. doi: 10.2500/aap.2019.40.4200.
152. Farkas H. Hereditary Angioedema: Examining the Landscape of Therapies and Preclinical Therapeutic Targets. Expert Opin Ther Targets. 2019;23(6):457-9. doi: 10.1080/14728222.2019.1608949.
153. Kuman Tunçel Ö, Gökmen NM, Demir E, Gülbahar O, Pırıldar. The Impact of Hereditary Angioedema on Quality of Life and Family Planning Decisions. Int J Psychiatry Med. 2019;54(6):377-94. doi: 10.1177/0091217419837068.
154. Liu S, Xu Y, Liu Y, Zhi Y. Hereditary Angioedema: A Chinese Perspective. Eur J Dermatol. 2019;29(1):14-20. doi: 10.1684/ejd.2018.3487.
155. Germenis AE, Margaglione M, Pesquero JB, Farkas H, Cichon S, Csuka D, et al. International Consensus on the Use of Genetics in the Management of Hereditary Angioedema. The Journal of Allergy and Clinical Immunology: In Practice. 2020;8(3):901-11. doi: 10.1016/j.jaip.2019.10.004.
156. Caballero T, Prior N. Burden of Illness and Quality-of-Life Measures in Angioedema Conditions. Immunol Allergy Clin North Am. 2017;37(3):597-616. doi: 10.1016/j.iac.2017.04.005.
157. Sirgy MJ, Michalos AC, Ferriss AL, Easterlin RA, Patrick D, Pavot W. The Quality-of-Life (QOL) Research Movement: Past, Present, and Future. Social Indicators Research. 2006;76(3):343-466. doi: 10.1007/s11205-005-2877-8.
158. Sirgy MJ, Reilly NP, Wu J, Efraty D. A Work-Life Identity Model of Well-Being: Towards a Research Agenda Linking Quality-of-Work-Life (QWL) Programs with Quality of Life (QOL). Applied Research in Quality of Life. 2008;3(3):181-202. doi: 10.1007/s11482-008-9054-6.
159. Prior N, Remor E, Pérez-Fernández E, Caminoa M, Gómez-Traseira C, Gayá F, et al. Psychometric Field Study of Hereditary Angioedema Quality of Life Questionnaire for Adults: HAE-QoL. J Allergy Clin Immunol Pract. 2016;4(3):464-73.e4. doi: 10.1016/j.jaip.2015.12.010.
160. Nunes FL, Ferriani MPL, Moreno AS, Langer SS, Maia LSM, Ferraro MF, et al. Decreasing Attacks and Improving Quality of Life through a Systematic Management Program for Patients with Hereditary Angioedema. Int Arch Allergy Immunol. 2021;182(8):697-708. doi: 10.1159/000513896.
161. Squeglia V, Barbarino A, Bova M, Gravante C, Petraroli A, Spadaro G, et al. High Attack Frequency in Patients with Angioedema Due to C1-Inhibitor Deficiency Is a Major Determinant in Switching to Home Therapy: A Real-Life Observational Study. Orphanet J Rare Dis. 2016;11(1):133. doi: 10.1186/s13023-016-0518-8.
162. Weller K, Groffik A, Magerl M, Tohme N, Martus P, Krause K, et al. Development and Construct Validation of the Angioedema Quality of Life Questionnaire. Allergy. 2012;67(10):1289-98. doi: 10.1111/all.12007.
163. Lumry WR, Weller K, Magerl M, Banerji A, Longhurst HJ, Riedl MA, et al. Impact of Lanadelumab on Health-Related Quality of Life in Patients with Hereditary Angioedema in the HELP Study. Allergy. 2021;76(4):1188-98. doi: 10.1111/all.14680.
164. Weller K, Groffik A, Magerl M, Tohme N, Martus P, Krause K, et al. Development, Validation, and Initial Results of the Angioedema Activity Score. Allergy. 2013;68(9):1185-92. doi: 10.1111/all.12209.
165. Weller K, Donoso T, Magerl M, Aygören-Pürsün E, Staubach P, Martinez-Saguer I, et al. Development of the Angioedema Control Test-A Patient-Reported Outcome Measure That Assesses Disease Control in Patients with Recurrent Angioedema. Allergy. 2020;75(5):1165-77. doi: 10.1111/all.14144.
166. Aymé S, Kole A, Groft S. Empowerment of Patients: Lessons from the Rare Diseases Community. Lancet. 2008;371(9629):2048-51. doi: 10.1016/S0140-6736(08)60875-2.
167. Abranghe [site na Internet]. Disponível em:https://www.abranghe.org.br. Acessado em: 03/04/2022.
168. Brasil. Ministério da Saúde. Portaria Nº 199, de 30 de janeiro de 2014. Institui a Política Nacional de Atenção Integral às Pessoas com Doenças Raras, aprova as Diretrizes para Atenção Integral às Pessoas com Doenças Raras no âmbito do Sistema Único de Saúde (SUS) e institui incentivos financeiros de custeio. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/gm/2014/prt0199_30_01_2014.html. Acessado em: 03/04/2022.
169. Pharma Boardroom [site na Internet]. The Role of Patient Associations in Rare Disease Drug Development. Disponível em: https://pharmaboardroom.com/articles/patient-associations-role-in-rare-disease-drug-development/. Acessado em: 03/04/2022.