Número Atual: Janeiro-Março 2022 - Volume 6 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Ana Karolina Barreto Berselli Marinho
- Lorena de Castro Diniz
- Bianca Noleto Ayres Guimarães
- Clarissa Morais Busatto Gerhardt
- Cláudia França Cavalcante Valente
- Claudia Leiko Yonekura Anagusko
- Fátima Rodrigues Fernandes
- Gisele Feitosa Zuvanov Casado
- Mônica de Araújo Álvares da Silva
- Newton Bellesi
- Ronney Correa Mendes
- Dewton de Moraes Vasconcelos
- Ekaterini Simões Goudouris
- Pedro Giavina-Bianchi
- Emanuel Savio Cavalcanti Sarinho
ARTIGO ESPECIAL
Posicionamento da ASBAI sobre a vacinação de crianças de 5 a 11 anos contra a COVID-19 com a vacina Comirnaty/ Pfizer/BioNTech - 27/12/2021
ASBAI's position on vaccination of children aged 5 to 11 years against COVID-19 with the Comirnaty/Pfizer/BioNTech vaccine - 12/27/2021
Ana Karolina Barreto Berselli Marinho1; Lorena de Castro Diniz1; Bianca Noleto Ayres Guimarães1; Clarissa Morais Busatto Gerhardt1; Cláudia França Cavalcante Valente1; Claudia Leiko Yonekura Anagusko1; Fátima Rodrigues Fernandes1; Gisele Feitosa Zuvanov Casado1; Mônica de Araújo Álvares da Silva1; Newton Bellesi1; Ronney Correa Mendes1; Dewton de Moraes Vasconcelos2; Ekaterini Simões Goudouris2; Pedro Giavina-Bianchi2; Emanuel Savio Cavalcanti Sarinho3
DOI: 10.5935/2526-5393.20220004
1. Departamento Científico de Imunizações da ASBAI
2. Grupo de Trabalho ASBAI COVID-19
3. Presidente da ASBAI
Endereço para correspondência:
Ana Karolina Barreto Berselli Marinho
E-mail: ana.marinho@hc.fm.usp.br
Submetido em: 18/01/2021
Aceito em: 25/01/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A Associação Brasileira de Alergia e Imunologia (ASBAI) se manifesta totalmente favorável à imunização contra a COVID-19 em indivíduos entre 5 e 11 anos, para a proteção não somente deste grupo, mas também de seus conviventes. A vacinação de crianças, demonstrada sua eficácia e segurança, é fundamental para o controle da circulação do vírus e proteção de indivíduos cuja resposta vacinal pode não ocorrer de modo eficiente, como os imunocomprometidos e idosos. A imunização de pessoas entre 5 e 11 anos deve ser uma estratégia de saúde pública fundamental para o controle da pandemia que nos assola desde março de 2020 com todas as suas graves consequências para a saúde pública e a economia.
Descritores: Vacinas contra COVID-19; imunização; criança.
Em agosto de 2020, o Instituto Nacional de Saúde da Mulher, da Criança e do Adolescente Fernandes Figueira (IFF/Fiocruz), apontou questões relevantes para o enfrentamento das consequências da pandemia de COVID-19 sobre a saúde de crianças e adolescentes no Brasil. Desde o início da pandemia, evidenciamos menos infecções sintomáticas e casos de doença grave e mortes por COVID-19 em crianças e adolescentes, em comparação com as demais faixas etárias1.
Os casos por idade notificados à OMS, de 30 de dezembro de 2019 a 25 de outubro de 2021, mostraram que as crianças menores de 5 anos representam 2% (1.890.756) dos casos globais notificados, e 0,1% (1.797) das mortes globais notificadas. As crianças mais velhas e os adolescentes mais jovens (faixa etária de 5 a 14 anos) são responsáveis por 7% (7.058.748) dos casos globais relatados, e 0,1% (1.328) das mortes globais relatadas. Os óbitos em todas as faixas etárias inferiores a 25 anos representaram menos de 0,5% das mortes globais relatadas. No Brasil, quase metade das crianças e adolescentes brasileiros mortos por COVID-19 em 2020 tinham até 2 anos de idade; um terço dos óbitos até 18 anos ocorreram entre os menores de 1 ano e 9% entre bebês com menos de 28 dias de vida2.
Desde abril de 2020, em diversos países da Europa, América do Norte e, inclusive, no Brasil, foram identificados casos de crianças e adolescentes com uma nova apresentação clínica associada à COVID-19, caracterizada por um quadro inflamatório tardio e grave, denominada como Pediatric Inflammatory Multisystem Syndrome temporally associated with COVID-19 (PIMS-TS) ou Multisystem Inflammatory Syndrome in Children (MIS-C), adaptada para o português como Síndrome Inflamatória Multissistêmica Pediátrica (SIM-P). Os principais achados dessa síndrome incluem: febre persistente, sintomas gastrointestinais (dor abdominal, náuseas, vômitos), conjuntivite bilateral não purulenta, sinais de inflamação dermatológica/mucocutânea, além de envolvimento cardiovascular frequente. Os casos mais graves apresentam choque com necessidade de suporte hemodinâmico e, algumas vezes, podem evoluir para a morte. No Brasil foi implantada oficialmente a vigilância dos casos de SIM-P associada à COVID-19 em 24 de julho de 2020, subsidiada pelos critérios de definição de caso padronizados pela Organização Mundial da Saúde (OMS) e, desde então, 1.377 casos foram notificados em todas as unidades federativas, com um total de 84 óbitos, correspondendo a 6,1% dos casos3.
Ressalta-se que o diagnóstico da COVID-19, além do risco de doença grave e SIM-P, também está associado a maior risco de ocorrência de diferentes outros acometimentos, tais como miocardite, pericardite, arritmias cardíacas, doenças desmielinizantes, encefalites, síndrome de Guillain-Barré, paralisia facial, miastenia gravis, hemorragias cerebrais, insuficiência renal aguda, trombose venosa profunda, infarto agudo do miocárdio e embolia pulmonar. As crianças e os adolescentes também podem apresentar manifestações clínicas prolongadas conhecidas como "COVID-19 longa", ou síndrome pós-COVID-199, ou sequelas pós-agudas de infecção por SARS-CoV-2, mas a frequência e as características dessas doenças ainda estão sob investigação4,5.
Portanto, embora a doença seja mais branda em crianças quando comparada a adultos e idosos, é importante ressaltar que doença grave e óbitos ocorrem e que a presença de doenças de base e comorbidades podem contribuir para o risco de diferentes manifestações graves relacionadas à COVID-19.
Abaixo mostramos que, apesar de proporcionalmente o número de casos ser bem menor, esses números são significativos e de forma nenhuma estariam dentro de um patamar "aceitável"6. A Tabela 1 mostra o número de óbitos (1.207) em menores de 18 anos no exercício de 2020, com os números relativos às diversas faixas etárias7.
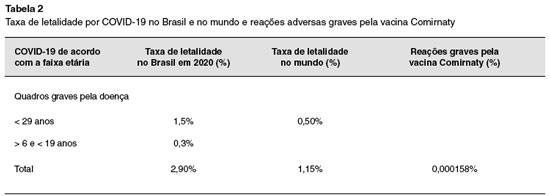
Na Tabela 2 podemos comparar os dados disponíveis do Brasil e do mundo, comparando a letalidade da doença em jovens e em adolescentes, além dos dados disponíveis de reações adversas "graves" à vacina Comirnaty (liberada pela ANVISA para os menores entre 5 e 11 anos de idade recentemente). Torna-se evidente que o risco de morrer de COVID nessa faixa etária é entre 10.000 e 20.000 vezes maior que o risco de ter alguma reação adversa à vacina8-10.
EFICÁCIA E IMUNOGENICIDADE
Dados consistentes de eficácia, imunogenicidade, segurança e tolerabilidade da vacina Comirnaty em pacientes de 5 a 11 anos derivam de um estudo de fases 2 e 3, envolvendo aproximadamente 2.268 participantes, realizado nos EUA, Finlândia, Polônia e Espanha, utilizando duas doses (de 10 µg) de um produto com concentração de 50 µg/mL, com um intervalo de três semanas11.
A eficácia foi avaliada por meio de proteção contra infecção sintomática e produção de anticorpos neutralizantes. Identificou-se que a vacina teve eficácia de 90,9% contra infecções sintomáticas, e que a resposta de produção de anticorpos neutralizantes foi tão satisfatória quanto aquela observada em indivíduos de 16 a 25 anos de idade11.
Ressaltamos que a eficácia de duas doses da vacina para crianças abaixo dos cinco anos ainda não foi demonstrada em estudos realizados pela Pfizer12.
SEGURANÇA
Dentre as 1.518 crianças vacinadas e as 750 que receberam o placebo, não foi observado nenhum evento adverso grave atribuível à vacinação. Ainda, dados do Centro de Controle de Doenças dos Estados Unidos descrevendo as notificações de eventos adversos em 5.126.642 crianças vacinadas (incluindo 2.014.786 com a segunda dose) identificaram uma incidência de 1,58 eventos adversos graves a cada 100 mil crianças vacinadas, sendo os eventos graves mais frequentes febre, vômito, dor torácica e elevação de proteína C-reativa. Foram notificados 14 casos com menção a miocardite, sendo que oito casos preencheram a definição de caso padronizada (6 com a segunda dose e 2 com a primeira dose), representando uma incidência de 0,04 casos de miocardite a cada 100 mil primeiras doses, e 0,29 casos de miocardite a cada 100 mil segundas doses12.
Reações alérgicas graves, como anafilaxia, podem ocorrer após qualquer vacina, incluindo as vacinas contra COVID-19. A taxa estimada de anafilaxias para todas as vacinas é de 1 para 1.000.000 de doses aplicadas, sendo considerado um evento raro13. Em relação às vacinas contra COVID-19, a observação de quadros de anafilaxia nos primeiros dias de vacinação em massa com a vacina da Pfizer nos EUA e no Reino Unido, levaram a uma estimativa de ocorrência de 0,5 casos:100.000 doses (ou 0.0005%). No entanto, com o avanço da imunização, o CDC estimou a prevalência de anafilaxia em 0,37 casos: 100.000 doses14.
Até o presente momento, não identificamos relatos de casos de anafilaxia em pacientes de 5 a 11 anos que receberam a vacina da Pfizer nos países que já iniciaram a imunização desta faixa etária.
BENEFÍCIO DA VACINAÇÃO EM CRIANÇAS
Embora a porcentagem de doença grave entre os casos pediátricos seja pequena, se o número de infecções nesta faixa etária aumentar, aumentará proporcionalmente o número de crianças que ficarão gravemente doentes. Dados de estudos em adolescentes sugerem que a vacinação com BNT162b2 (Comirnaty/Pfizer) para crianças de 5 a 11 anos de idade provavelmente evitará a maioria das hospitalizações e mortes. Embora os estudos pediátricos não tenham avaliado se as vacinas reduzirão a transmissão de SARS-CoV-2, dados de estudos em adultos vacinados sugerem que as crianças vacinadas têm probabilidade de transmitir quantidades menores do vírus por menos tempo. Assim, vacinar crianças 5 a 11 anos de idade tem o potencial de reduzir a transmissão do vírus entre famílias, escolas e comunidades15,16.
EXPERIÊNCIA INTERNACIONAL
O debate sobre a necessidade e adequação de instituir programa de imunização contra a COVID-19 em crianças aconteceu ao redor do mundo17,18.
A estratégia para adotar a vacinação de crianças deve considerar o cenário epidemiológico de cada país e os benefícios individuais e coletivos da imunização. Existem questões importantes a serem consideradas para vacinar crianças e adolescentes que vão além dos benefícios diretos à saúde de quem recebeu a vacina. A proposta é que a elevada cobertura vacinal possa contribuir para a redução da transmissão do SARS-CoV-2 neste grupo etário e, por conseguinte, redução da transmissão para adultos, idosos e imunocomprometidos. Além disso, atenuar as interrupções nas atividades educativas e esportivas das crianças, mantendo a segurança e bem-estar são benefícios indiscutíveis a ser considerados.
Considerando todos estes dados, os seguintes países já aprovaram a imunização de crianças de 5 a 11 anos contra a COVID-19 com a vacina da PFIZER:
- Estados Unidos (FDA), aprovação em 29 de outubro de 202119;
- Canadá (HC), aprovação em 19 de novembro de 202120;
- Comunidade Europeia (EMA), aprovação em 25 de novembro de 202121;
- Austrália (TGA), aprovação em 5 de dezembro de 202122;
- Singapura (HSA), aprovação em 10 de dezembro de 202123;
- Suiça (Swissmedic), 10 de dezembro de 202124;
- Reino Unido (MHRA), aprovada em 22 de dezembro de 202125.
APROVAÇÃO PELA ANVISA
Após avaliação de benefícios e riscos, seguindo protocolos de análise utilizados por diversas agências internacionais com função semelhante, a ANVISA concedeu à vacina Pfizer-BioNTech COVID-19 autorização de emergência para uso em crianças de 5 a 11 anos de idade no dia 16 de dezembro de 202126.
CONCLUSÃO
Diante de todos os dados apresentados, a Associação Brasileira de Alergia e Imunologia (ASBAI) se manifesta totalmente favorável à imunização contra a COVID-19 dos indivíduos entre 5 e 11 anos, para a proteção não somente deste grupo, mas também de seus conviventes. A vacinação de crianças, demonstrada sua eficácia e segurança, é fundamental para o controle da circulação do vírus e proteção de indivíduos cuja resposta vacinal pode não ocorrer de modo eficiente, como os imunocomprometidos.
Portanto, a ASBAI considera que uma consulta pública não cabe, uma vez que a indicação de imunização de pessoas entre 5 e 11 anos não deve ser uma questão de opinião, mas sim uma estratégia de saúde pública fundamental para o controle da pandemia que nos assola desde março de 2020 com todas as suas graves consequências econômicas, sociais, emocionais e efeitos na saúde individual e coletiva.
REFERÊNCIAS
1. FIOCRUZ. COVID-19 e Saúde da Criança e do Adolescente [site na Internet]. Disponível em: https://portaldeboaspraticas.iff.fiocruz.br/wp-content/uploads/2021/09/Covid_edu_v2.pdf. Acessado em: 22/12/2021.
2. FIOCRUZ. Fiocruz analisa dados sobre mortes de crianças por Covid-19 [site na Internet]. Disponível em: https://portal.fiocruz.br/noticia/fiocruz-analisa-dados-sobre-mortes-de-criancas-por-covid-19. Acessado em: 23/12/2021.
3. Brasil. Ministério da Saúde. Boletim Epidemiológico Especial - Doença pelo Novo Coronavírus - COVID-19. Semana epidemiológica 45: 7/11 a 13/11/2021. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/boletins-epidemiologicos/covid-19/2021/boletim_epidemiologico_covid_89_23nov21_fig37nv.pdf. Acessado em: 23/12/2021.
4. World Health Organization - WHO. Coronavirus disease (COVID-19): Post COVID-19 condition [site na Internet]. Disponível em: https://www.who.int/news-room/questions-and-answers/item/coronavirus-disease-(covid-19)-post-covid-19-condition.
5. Hageman JR. Long COVID-19 or Post-Acute Sequelae of SARS-CoV-2 Infection in Children, Adolescents, and Young Adults. Pediatr Ann. 2021 Jun;50(6):e232-e233.
6. Yahoo!notícias. Queiroga diz que mortes de crianças por covid "estão dentro de patamar aceitável" [site na Internet]. Disponível em: https://br.yahoo.com/noticias/queiroga-diz-que-mortes-de-criancas-por-covid-estao-dentro-de-patamar-aceitavel-171221199.html. Acessado em: 23/12/2021.
7. World Health Organization - WHO [site na Internet]. Global surveillance for COVID-19 caused by human infection with COVID-19 virus. Disponível em: https://www.who.int/publications/i/item/global-surveillance-for-covid-19-caused-by-human-infection-with-covid-19-virus-interim-guidance. Acessado em: 23/12/2021.
8. United States Food and Drug Administration - FDA. Fact Sheet for Healthcare Providers Administering Vaccine (Vaccination Providers) [Internet]. Disponível em: https://www.fda.gov/media/144413/download.
9. United States Food and Drug Administration - FDA. Pfizer-BioNTech COVID-19 Vaccine. Disponível em: https://www.fda.gov/emergency-preparednessandresponse/coronavirus-disease-2019-covid-19/pfizer-biontech-covid-19-vaccine.
10. Interim Report - Children 5 to <12 Years of Age: A Phase 1, Open-Label Dose-Finding Study to Evaluate Safety, Tolerability, and Immunogenicity and Phase 2/3 Placebo-Controlled, Observer-Blinded Safety, Tolerability, and Immunogenicity Study of a SARS-CoV-2 RNA Vaccine Candidate Against COVID-19 In Healthy Children and Young Adults Número de Protocolo: C4591007.
11. Su JR; Vaccine Safety Team; CDC COVID-19 Vaccine Task Force. Adverse events among children ages 5-11 years after COVID-19 vaccination: updates from v-safe and the Vaccine Adverse Event Reporting System (VAERS) - Dec 13, 2021 [Internet].
12. Pfizer.com [site na Internet]. Pfizer and Biontech provide update on ongoing studies of Covid-19 Vaccine. Disponível em: www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-provide-update-ongoing-studies-covid-19. Acessado em: 23/12/2021.
13. McNeil MM, Weintraub ES, Duffy J, Sukumaran L, Jacobsen SJ, Klein NP, et al. Risk of anaphylaxis after vaccination in children and adults. J Allergy Clin Immunol. 2016;137:868-78.
14. Woodworth KR, Moulia D, Collins JP, Hadler SC, Jones JM, Reddy SC, et al. The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Pfizer-BioNTech COVID-19 Vaccine in Children Aged 5-11 Years - United States, November 2021. MMWR Morb Mortal Wkly Rep. 2021 Nov 12;70(45):1579-83. doi: 10.15585/mmwr.mm7045e1.
15. Olson SM, Newhams MM, Halasa NB, Price AM, Boom JA, Sahni LC, et al.; Overcoming COVID-19 Investigators. Effectiveness of Pfizer-BioNTech mRNA Vaccination Against COVID-19 Hospitalization Among Persons Aged 12-18 Years - United States, June-September 2021. MMWR Morb Mortal Wkly Rep. 2021 Oct 22;70(42):1483-8. doi: 10.15585/mmwr.mm7042e1.
16. Moss WJ, Gostin LO, Nuzzo JB. Pediatric COVID-19 Vaccines: What Parents, Practitioners, and Policy Makers Need to Know. JAMA. 2021 Dec 14;326(22):2257-8. doi: 10.1001/jama.2021.20734.
17. Zou X, Cao B. COVID-19 vaccines for children younger than 12 years: are we ready? Lancet Infect Dis. 2021 Dec;21(12):1614-5. doi: 10.1016/S1473-3099(21)00384-4.
18. Saxena S, Skirrow H, Wighton K. Should the UK vaccinate children and adolescents against covid-19? BMJ. 2021;374:n1866. doi: 10.1136/bmj.n1866.
19. United States Food and Drug Administration - FDA. FDA Authorizes Pfizer-BioNTech COVID-19 vaccine for emergency use in children 5 through 11 years of age [site na Internet]. Disponível em: https://www.fda.gov/news-events/press-announcements/fda-authorizes-pfizer-biontech-covid-19-vaccine-emergency-use-children-5-through-11-years-age. Acessado em: 18/12/2021.
20. Government of Canada - Health Canada. Vaccines for children: COVID-19 [site na Internet]. Disponível em: https://www.canada.ca/en/public-health/services/vaccination-children/covid-19.html. Acessado em: 18/12/2021.
21. European Medicines Agency - EMA. Comirnaty COVID-19 vaccine: EMA recommends approval for children aged 5 to 11 [site na Internet]. Disponível em: https://www.ema.europa.eu/en/news/comirnaty-covid-19-vaccine-ema-recommends-approval-children-aged-5-11. Acessado em: 22/12/2021.
22. Australian Government - Department of Health. TGA provisionally approves Pfizer COVID-19 vaccine for 5 to 11 years-olds [site na Internet]. Disponível em: https://www.health.gov.au/news/tga-provisionally-approves-pfizer-covid-19-vaccine-for-5-to-11-year-olds. Acessado em: 22/12/2021.
23. Government of Singapore - Health Sciences Authority - HSA. HSA extends the use of comirnaty COVID-19 vaccine by Pfizer-BioNTech to children of ages 5 to 11 [site na Internet]. Disponível em: https://www.hsa.gov.sg/announcements/press-release/pfizercomirnaty_children. Acessado em: 22/12/2021.
24. Swissmedic - Swiss Agency for Therapeutic Products. Swissmedic approves COVID-19 vaccine from Pfizer/BioNTech for children aged 5 to 11 years [site na Internet]. Disponível em: https://www.swissmedic.ch/swissmedic/en/home/news/coronavirus-covid-19/covid-19-impfstoff-pfizer-biontec-kinder-5-11-jahren-genehmigt.html. Acessado em 23/12/2021.
25. GOV.UK. UK regulator approves use of Pfizer/BioNTech vaccine in 5- to 11-year-olds [site na Internet]. Disponível em: https://www.gov.uk/government/news/uk-regulator-approves-use-of-pfizerbiontech-vaccine-in-5-to-11-year-olds#:~:text=A%20new%20age%2Dappropriate%20formulation,it%20is%20safe%20and%20effective. Acessado em: 23/12/2021.
26. ANVISA - GGMED. Parecer Público de Avaliação do Medicamento - Aprovação [site na Internet]. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/noticias-anvisa/2021/copy_of_PPAM511anosPfizer2.pdf. Acessado em: 23/12/2021.