Número Atual: Janeiro-Março 2022 - Volume 6 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Jackeline Motta Franco
- Lucila Camargo Lopes de-Oliveira
- Ana Paula Beltran Moschione Castro
- Fabiane Pomiecinski
- Ana Carolina Rozalem Reali
- Ariana Campos Yang
- Bárbara Luiza de Britto Cançado
- Germana Pimentel Stefani
- Ingrid Pimentel Cunha Magalhães Souza Lima
- José Carlison Santos de-Oliveira
- José Luiz Magalhães Rios
- Nathalia Barroso Acatauassú Ferreira
- Renata Rodrigues Cocco
- Valéria Botan Gonçalves
- Norma de Paula M. Rubini
- Emanuel Sarinho
ARTIGO ESPECIAL
Introdução dos alimentos no primeiro ano de vida e prevenção da alergia alimentar: quais as evidências?
Introduction of food in the first year of life and food allergy prevention: what is the evidence?
Jackeline Motta Franco1; Lucila Camargo Lopes de-Oliveira1; Ana Paula Beltran Moschione Castro1; Fabiane Pomiecinski1; Ana Carolina Rozalem Reali1; Ariana Campos Yang1; Bárbara Luiza de Britto Cançado1; Germana Pimentel Stefani1; Ingrid Pimentel Cunha Magalhães Souza Lima1; José Carlison Santos de-Oliveira1; José Luiz Magalhães Rios1; Nathalia Barroso Acatauassú Ferreira1; Renata Rodrigues Cocco1; Valéria Botan Gonçalves1; Norma de Paula M. Rubini2; Emanuel Sarinho3
DOI: 10.5935/2526-5393.20220003
1. Associação Brasileira de Alergia e Imunologia, Departamento Científico de Alergia Alimentar - São Paulo, SP, Brasil
2. Associação Brasileira de Alergia e Imunologia, Diretoria Científica - São Paulo, SP, Brasil
3. Associação Brasileira de Alergia e Imunologia, Presidência - São Paulo, SP, Brasil
Endereço para correspondência:
Jackeline Motta Franco
E-mail: jmottafranco@hotmail.com
Submetido em: 27/11/2021
Aceito em: 06/12/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
OBJETIVO: A incidência das doenças alérgicas cresceu nas últimas décadas. Na tentativa de conter o aumento da alergia alimentar (AA) ao longo dos anos, estratégias de prevenção vêm sendo implementadas. Para promover um melhor entendimento dos dilemas que permeiam a introdução alimentar no primeiro ano de vida, esse artigo trata de uma revisão bibliográfica narrativa sobre a introdução dos alimentos complementares no primeiro ano de vida e possíveis associações com a prevenção primária da alergia alimentar.
FONTE DOS DADOS: Publicações relevantes foram pesquisadas nas bases de dados Cochrane Library, MEDLINE, PubMed, Guidelines International Network, National Guidelines Clearinghouse e revisadas recomendações do guia e do consenso nacional de alergia alimentar.
RESULTADOS: Estudos observacionais diversos e ensaios clínicos randomizados estão disponíveis, bem como recomendações publicadas por organizações científicas; no entanto, de qualidade variável. Foram consideradas as recomendações de diretrizes de prática clínica classificadas como de alta qualidade e publicações recentes ainda não categorizadas de forma sistemática em sua qualidade, mas internacionalmente reconhecidas como relevantes para a atenção primária.
CONCLUSÃO: Até o momento, não há evidências consistentes de que a introdução precoce, antes dos 6 meses, dos alimentos alergênicos, contribua para a prevenção de alergia a alimentos na população geral.
Descritores: Prevenção primária; hipersensibilidade alimentar; alimentos infantis; desenvolvimento infantil; ingestão de alimentos.
A incidência de doenças atópicas pediátricas cresceu nas últimas décadas1. Fatores genéticos e ambientais, em constante interação desde o período intrauterino, constituem a base fisiopatológica dessas doenças2. Na tentativa de conter o aumento da alergia alimentar (AA) ao longo dos anos, estratégias de prevenção vêm sendo implementadas, dentre elas, mudanças nos hábitos alimentares, notadamente na introdução alimentar no primeiro ano de vida3.
Nos anos 90, retardar a introdução dos alimentos mais alergênicos na dieta da criança foi a estratégia adotada4. Entretanto, essas recomendações não foram cientificamente sustentadas à medida que novos estudos foram surgindo e sugerindo se não seria o consumo precoce de alimentos alergênicos o melhor caminho para a indução da tolerância oral5.
Ensaios clínicos foram elaborados para testar a "Hipótese da via de exposição do alérgeno", segundo a qual o consumo precoce de alérgenos alimentares poderia induzir tolerância oral, enquanto a sensibilização alérgica a alérgenos alimentares poderia ocorrer por via transcutânea6-12. No entanto, a diversidade metodológica desses ensaios trouxe resultados conflitantes, e a incorporação das novas recomendações tornou-se um desafio em regiões com prevalências de AA, condições socioeconômicas e hábitos alimentares distintos13.
Para promover um melhor entendimento dos dilemas que permeiam a introdução alimentar no primeiro ano de vida, esse artigo trata de uma revisão bibliográfica narrativa sobre a introdução dos alimentos complementares no primeiro ano de vida e possíveis associações com a prevenção primária da alergia alimentar, através de perguntas e respostas sobre as principais controvérsias acerca do tema, adaptando as evidências científicas à prática clínica.
A DEFINIÇÃO DE INTRODUÇÃO PRECOCE OU TARDIA DA ALIMENTAÇÃO COMPLEMENTAR É UNIFORME NA LITERATURA?
Os resultados dos estudos ainda mostram controvérsias sobre o momento ideal14, e poucas conclusões podem ser assumidas como definitivas.
Em 2001, a Organização Mundial da Saúde (OMS) publicou uma revisão sistemática com o objetivo de avaliar as evidências científicas acerca do período ideal para a prática do aleitamento materno exclusivo. Os autores concluíram que o aleitamento materno exclusivo por seis meses deveria ser instituído, ao invés da orientação anterior, por quatro a seis meses, tendo em vista as inúmeras evidências dos benefícios em curto e longo prazo para o binômio mãe-filho e para a sociedade15. Em acordo, o "Guia Alimentar para Crianças Brasileiras Menores de 2 anos" do Ministério da Saúde, publicado em 201916, e o "Guia Prático de Alimentação da Criança de 0 a 5 anos - 2021", elaborado pela Sociedade Brasileira de Pediatria17, recomendam o aleitamento materno exclusivo até o 6° mês de vida.
A partir dos seis meses de idade, outros alimentos devem fazer parte da refeição da criança. A transição para as refeições familiares deve ocorrer em torno dos 12 meses16,17. Com esses marcos, podemos definir, para a nossa população, introdução precoce como a oferta de alimentos complementares ao leite materno antes dos seis meses de idade. Por outro lado, à luz dos conhecimentos atuais, a oferta de alimentos potencialmente alergênicos após os 12 meses de idade seria considerada oferta tardia. No entanto, essas definições deixam de ser tão evidentes em situações em que o aleitamento materno não é possível, ou é insuficiente.
Recomendações de outros países e entidades podem diferir da preconizada pela OMS15 e pelo Brasil16,17. A Sociedade Europeia de Gastrenterologia, Hepatologia e Nutrição Pediátrica (ESPGHAN) recomenda o início da introdução dos alimentos complementares entre quatro e seis meses de idade (17ª e 26ª semanas de vida), não devendo introduzi-los antes dos quatro, nem atrasar para além dos seis meses18.
A INTRODUÇÃO PRECOCE DA ALIMENTAÇÃO COMPLEMENTAR PODE TER UM PAPEL NO DESENVOLVIMENTO DA ALERGIA ALIMENTAR?
Há duas décadas, acreditava-se que a sensibilização alérgica a alimentos ocorria por meio da exposição oral e, portanto, prevenir AA traduzia-se em retardar a introdução dos alimentos potencialmente alergênicos19. Entretanto, a despeito do atraso nessa introdução, a prevalência da AA continuava aumentando, o que levou especialistas a reavaliar as recomendações e a elaborar novas estratégias de prevenção, uma delas com foco no momento ideal da introdução dos alimentos alergênicos na dieta das crianças20.
Estudos observacionais e in vitro, em animais e humanos, demonstraram sensibilização transcutânea a alérgenos alimentares através da pele inflamada, com eczema21-23. Dados publicados por Fox e cols. sugeriram que altos níveis de exposição ambiental ao amendoim, durante a infância, poderiam promover sensibilização ao invés de tolerância24. Um estudo ecológico que avaliou a prevalência de alergia ao amendoim em lactentes em Israel e no Reino Unido encontrou taxa significativamente maior no Reino Unido (1,85% vs. 0,17%). Uma explicação para essa diferença, favorecendo a tolerância, teria sido o consumo precoce e em maiores quantidades do amendoim em crianças israelenses25.
Fundamentados nos dados previamente publicados, estudiosos elaboraram a "Hipótese da via de exposição ao alérgeno" como uma das novas estratégias de prevenção. Ela sugeria que o equilíbrio das exposições, durante o primeiro ano de vida, se através da pele ou do intestino, prepararia o sistema imunológico para alergia ou tolerância, respectivamente26.
Ensaios clínicos se faziam necessários para colocar em teste a nova hipótese. O estudo Learning Early about Peanut Allergy (LEAP) foi o primeiro ensaio clínico elaborado para demonstrar se a introdução do amendoim antes de um ano de vida poderia servir como estratégias de prevenção primária e secundária eficazes na alergia ao amendoim6. A introdução do amendoim, entre 4 e 11 meses de vida, diminuiu significantemente a frequência de alergia ao amendoim entre crianças, sensibilizadas ou não, classificadas como de alto risco, por apresentar alergia ao ovo e/ou dermatite atópica grave6. Os resultados demonstrados trouxeram questionamentos: seria o benefício da introdução precoce do amendoim também encontrado com outros alimentos e na população geral?
O estudo Enquiring About Tolerance (EAT), avaliou se a introdução de seis alimentos alergênicos comuns (amendoim, leite, ovo, trigo, peixe e gergelim) poderia prevenir a AA em 1.303 lactentes da população geral, amamentados exclusivamente até os três meses de idade7. De acordo com a análise por intenção de tratar, 5,6% dos lactentes com introdução precoce, entre três e seis meses de vida, desenvolveram AA a pelo menos um dos seis alimentos aos três anos de vida, ao passo que, no grupo padrão, alimentados com sólidos a partir dos 6 meses de idade, a taxa foi de 7,1%, diferença não estatisticamente significante. Entretanto, na análise per protocolo, foi demonstrado uma redução significativa de alergia entre os diversos alimentos (2,4% vs. 6,4%), mais especificamente ao ovo e ao amendoim, no grupo de introdução precoce, entre 3-6 meses, sugerindo que a introdução do alimento numa "janela de tempo" poderia prevenir a alergia alimentar7.
Infelizmente, a taxa de abandono do estudo EAT foi muito alta, 69,1% dos lactentes recrutados, representando um importante viés na análise per protocolo. Analisando a taxa de adesão ao protocolo para cada alimento, o menor valor foi encontrado para o ovo (43,1%), sugerindo que o consumo do ovo cozido poderia ser o principal fator para o abandono27.
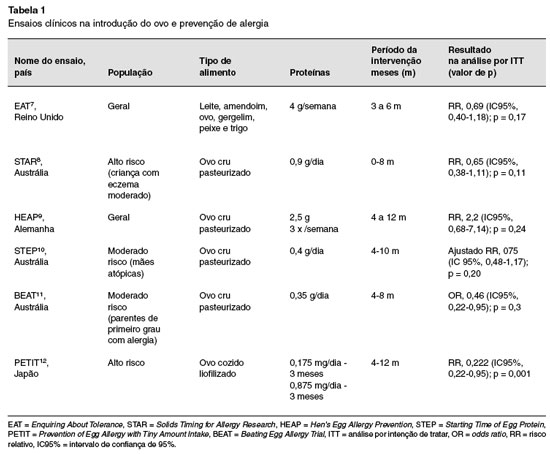
Ensaios clínicos randomizados controlados com placebo foram elaborados para avaliar o efeito preventivo da introdução precoce do ovo na AA7-12 (Tabela 1). Entre as evidências havia diversidades metodológicas relacionadas ao tipo do alimento escolhido, à forma de apresentação do alimento, à dose de proteína alergênica consumida, e ao desfecho procurado (Tabela 1). Essas diferenças geraram conclusões variadas, por vezes antagônicas, e nem sempre comparáveis2.
Na atualidade, embora a força das evidências seja maior para a introdução de amendoim em população de alto consumo, a exemplo dos Estados Unidos, estudos com outros alimentos alergênicos, como ovo, também demonstraram benefício em não adiar a sua oferta durante a transição alimentar. Entretanto, mais estudos são necessários em populações maiores, com diferentes dietas e exposições ambientais para a generalização e avaliação da segurança dessa potencial estratégia preventiva.
EM QUAIS POPULAÇÕES A IDADE DE INTRODUÇÃO DE ALIMENTOS POTENCIALMENTE ALERGÊNICOS MERECE CONSIDERAÇÕES NO CENÁRIO DA ALERGIA ALIMENTAR?
A genética tem forte influência na prevalência das alergias alimentares. Uma criança tem um aumento de sete vezes no risco de alergia a amendoim se tem um dos pais e/ou irmão acometidos28. Gêmeos monozigóticos têm 64% de probabilidade de alergia a amendoim se seu irmão gêmeo for alérgico29. Entretanto, pesquisas fundamentam que, por si só, alterações ou fatores genéticos não explicam a prevalência crescente de AA28,29.
De acordo com as recomendações internacionais, uma criança de alto risco para desenvolver alergia alimentar é assim definida quando um ou mais membros da família (pais e/ou irmãos) apresentam eczema, alergia alimentar, asma ou rinite alérgica2. O estudo LEAP, em 2015, considerou dois fatores como alto risco para sensibilização e alergia ao amendoim: eczema grave e/ou alergia a ovo6.
Nos grupos de risco para atopia, não retardar a introdução dos alimentos complementares alergênicos mostrou proteção contra o desenvolvimento de alergia alimentar6,8-12. Entretanto, uma preocupação é a possibilidade de prévia sensibilização ao alimento a ser introduzido, incluindo a chance de manifestações clínicas imediatas6. Embora tenha-se observado algumas reações alérgicas no estudo LEAP6, não existe recomendação de testes para pesquisa de IgE específica para alimentos, como rotina para a introdução alimentar. A excepcionalidade da alergia alimentar, nessa situação, não justificaria a recomendação dessa conduta, difícil de ser implantada em termos de saúde pública e que poderia, inclusive, trazer prejuízos pelo retardo na introdução alimentar30.
Outros aspectos são as questões culturais, preferências familiares e riscos específicos, como o medo dos pais de introduzirem o alimento quando o outro filho tem esse tipo de alergia. É importante estabelecer um relação médico-família de confiança e orientar a família que uma criança considerada de "alto risco" para desenvolvimento de alergia alimentar, não necessariamente, vai desenvolvê-la.
FÓRMULAS PARA ALEITAMENTO ARTIFICIAL APRESENTAM IMPACTO NO DESFECHO DA ALERGIA ALIMENTAR?
Frente à impossibilidade do aleitamento materno exclusivo, fórmulas infantis poliméricas devem ser introduzidas em crianças sem sintomas de alergia, de acordo com recomendações internacionais e nacionais15-17. No entanto, recente diretriz atualizada pela Academia Europeia de Alergia e Imunologia Clínica (EAACI) reforça a necessidade de se evitar complementação do leite materno com fórmulas infantis na primeira semana de vida, à qual se associou a maior chance de desenvolvimento de alergia31,32, além de aumentar o risco de desmame precoce, segundo a OMS15.
As principais considerações a respeito de fórmulas infantis e prevenção de alergia alimentar são derivadas do estudo alemão GINI (German Infant Nutricional Intervention Study). Neste estudo, 2.252 crianças com risco para alergias (um parente de primeiro grau alérgico) foram randomizadas (com cegamento durante os três primeiros anos) para receber fórmula padrão de leite de vaca ou fórmulas hidrolisadas (parcialmente ou extensamente hidrolisada de proteínas do soro do leite ou fórmula extensamente hidrolisada de caseína) nos quatro meses iniciais de vida, quando o aleitamento materno exclusivo não era possível. Desfechos alérgicos desse estudo têm sido avaliados nos últimos 20 anos. Na última publicação, os autores concluíram que as fórmulas extensamente hidrolisadas de caseína e as fórmulas parcialmente hidrolisada de proteínas do soro reduziram a prevalência de eczema e asma33. No entanto, revisão sistemática, em 2018, concluiu não haver evidências substanciais que comprovem que a utilização de fórmulas hidrolisadas previna doenças alérgicas34.
Sendo assim, devemos incentivar o aleitamento materno exclusivo até os seis meses de vida, evitar o uso de fórmulas poliméricas na primeira semana de vida, mesmo que seja com o objetivo de complementação. Não há ainda comprovação de que fórmulas hidrolisadas previnem alergias, quando impossibilitada a manutenção do aleitamento materno. Também não há comprovação de que retardar a introdução da ingestão da proteína do leite de vaca previna alergia.
A INTRODUÇÃO PRECOCE PARA A PREVENÇÃO DE ALERGIA DEVE SER INSTITUÍDA PARA TODOS OS ALIMENTOS?
Ensaios clínicos forneceram evidências de que a introdução precoce de amendoim e do ovo de galinha diminuiu a incidência de alergia ao amendoim e ao ovo em lactentes com alto risco de desenvolver AA. Estudos sobre prevenção a outros alérgenos alimentares têm sido menos robustos e mostraram evidências de segurança, mas não necessariamente de eficácia35.
Em relação à introdução de leite de vaca (LV), seja sob a forma de fórmulas infantis, leite in natura ou iogurte, não existem evidências robustas de que a introdução precoce exerça qualquer papel protetor. A sua introdução nos primeiros dias de vida pode contribuir para o desenvolvimento de alergia alimentar32, porém, a introdução a partir dos 3-4 meses ou após os 6 meses não demonstraram diferença de efeito em relação à alergia alimentar36. Da mesma forma, não existem evidências que justifiquem o retardo na introdução das proteínas do LV após os 12 meses de vida37. Com relação às fórmulas infantis especiais, hidrolisadas parcial ou extensamente, dados publicados em revisão sistemática não mais justificam o seu uso para a prevenção de alergia às proteínas do leite de vaca (APLV)34,38. Várias sociedades internacionais que recomendavam a introdução dessas fórmulas especiais hidrolisadas para a prevenção da APLV, em detrimento das fórmulas infantis convencionais, estão revisando estas recomendações30,37. Entretanto, na última publicação do GINI, de 2021, os autores concluíram que as fórmulas extensamente hidrolisadas de caseína e a parcialmente hidrolisada de proteínas do soro reduziram a prevalência de eczema e asma33.
Quanto à introdução do ovo, os estudos são muito variáveis em relação à dose recomendada, ao tipo de exposição (se ovo inteiro, ou clara pasteurizada crua ou cozida) e à população selecionada (presença de dermatite atópica ou risco aumentado de atopia)2,6,40. Revisão sistemática e metanálise, publicada em 2016, envolvendo o agrupamento de cinco estudos, com 1.915 participantes, evidenciou que a introdução precoce de ovo (entre 4 a 6 meses) foi associada à redução significativa de alergia a ovo39.
De acordo com o posicionamento da Autoridade Europeia em Segurança Alimentar, esta evidência é de confiança baixa a moderada, e, portanto, insuficiente para apoiar a introdução do ovo aos 3-4 meses de idade em todos os lactentes, para a prevenção da alergia. Nos estudos, nenhuma reação adversa grave foi observada com o ovo cozido, mas, quando a intervenção consistia em ovo cru pasteurizado em pó, algumas reações anafiláticas ocorreram. Portanto, deve-se evitar produtos que contenham ovos crus, mesmo que pasteurizados30,41. O ovo cozido deve ser introduzido na dieta das crianças à semelhança dos outros alimentos complementares, por volta dos 6 meses de idade30,41.
As diretrizes da Sociedade Britânica de Alergia e Imunologia Clínica (BSACI) sugerem que ovo e amendoim podem ser introduzidos, como parte da dieta familiar, em lactentes de alto risco, entre 4-6 meses de idade. Porém, recomendam a introdução do ovo antes da introdução do amendoim, porque a sensibilização ao ovo parece ocorrer antes42.
Em relação à introdução de amendoim, metanálise demonstrou evidência moderada, a partir de dois estudos (1.550 participantes), de que a introdução de amendoim entre 4 e 11 meses esteve associada à redução na alergia a amendoim40. De acordo com o posicionamento da Autoridade Europeia em Segurança Alimentar, há evidências de que a introdução do amendoim, durante o primeiro ano de vida, em comparação com evitá-lo até os 5 anos de idade, reduziu o risco de desenvolver alergia ao amendoim. No entanto, as evidências são insuficientes para concluir se, ao comparar lactentes em que o amendoim foi introduzido com idade £ 6 meses de idade com aqueles em que a introdução foi realizada em > 6 meses, mas ainda dentro do primeiro ano de vida, ocorreria um efeito semelhante41. Em países com alto consumo de amendoim, diretrizes americanas recomendam a introdução do amendoim entre 4 a 6 meses43.
O estudo HealthNuts relatou que a ingestão de castanha de caju para pacientes de alto risco (dermatite atópica grave e/ou alergia a ovo)27 antes de 1 ano de idade (n = 140) foi associada a nenhum caso de alergia a esta castanha aos 6 anos44. Não existem estudos disponíveis sobre a segurança ou eficácia da introdução precoce de outras nozes, soja ou marisco35.
À luz do conhecimento atual, não há evidências consistentes de que a introdução precoce, antes dos 6 meses, dos alimentos alergênicos, contribua para a prevenção de alergia a esses alimentos na população geral30,40.
AS RECOMENDAÇÕES DE INTRODUÇÃO COMPLEMENTAR DOS ESTUDOS EXTERNOS PODEM SER AMPLAMENTE APLICADAS NO BRASIL?
É sabido que a introdução de alimentos complementares junto ao leite materno diminui sua quantidade ingerida e, consequentemente, todos os seus benefícios imunológicos, como a prevenção de infecções e diminuição de mortalidade infantil, e não imunológicos, como a absorção otimizada de ferro e de zinco via leite materno pelo lactente, que serão reduzidos16,17. A literatura não permite estabelecer se a amamentação exerce alguma proteção em relação à AA45. Sugere-se que a introdução de alimentos alergênicos enquanto a criança é amamentada possa ter efeito protetor, porém não existem evidências suficientes a esse respeito45. Apesar de os resultados do estudo EAT terem demonstrado que não houve redução nas taxas de aleitamento materno com a introdução de alimentos sólidos a partir de 3 meses de idade, não existem dados sobre a relação risco/benefício de possível redução no tempo de aleitamento materno exclusivo num país como o Brasil, com elevado grau de pobreza, insegurança alimentar e de desnutrição, onde o leite materno garante maior segurança nutricional ao lactente46.
As primeiras habilidades motoras grosseiras indicativas de prontidão de desenvolvimento para alimentação à colher podem ser observadas entre 3 e 4 meses de idade. Nessa idade, pode-se presumir que os reflexos de procura e extrusão também podem ter diminuído em alguns bebês. Em lactentes prematuros, os marcos de desenvolvimento necessários para a alimentação também são atingidos em torno da mesma faixa etária (pós-termo), dependendo da gravidade da doença vivenciada durante o período neonatal, do grau de prematuridade e de quaisquer sequelas41.
Nesse raciocínio, o EAT foi o único ensaio de introdução precoce (3 meses) com múltiplos alérgenos simultaneamente7. Os pais deveriam oferecer às crianças, a partir de 3 meses de vida, juntamente ao aleitamento materno, ovo cozido, manteiga de amendoim, iogurte de leite de vaca, peixe branco cozido, pasta de gergelim e cereal à base de trigo7. No entanto, a adesão do grupo intervenção foi muito inferior à do grupo controle (de 31,9% vs. 92,9%)7. Os prováveis motivos para a baixa aderência foram a dificuldade em cozinhar determinados alimentos e a palatabilidade7.
Não há evidências de que a ordem de introdução dos diversos alimentos sólidos contribua para maior ou menor risco de alergia alimentar47. Assim, a introdução alimentar oportuna deve seguir os hábitos dietéticos das famílias, permitindo que a criança tenha contato com todos os grupos alimentares entre 6 e 12 meses de idade17. Não há razão para adiar a introdução de alimentos potencialmente alergênicos (ovos, cereais, proteínas do leite, carnes e peixes), para além de 1 ano de idade, nem para adiantar a exposição a alimentos potencialmente alergênicos, para antes dos 6 meses de idade47. Castanhas, amendoim e frutos do mar também podem, e idealmente devem, ser apresentados à criança nesse período17.
Com relação às crianças com grande risco de desenvolver alergia alimentar, aquelas com eczema grave, alergia a ovo, ou ambos, a orientação do Instituto de Alergia e Doenças Infecciosas dos EUA, em relação ao amendoim, é de que a sua introdução entre 4 e 6 meses de idade, ocorra após realização do prick test ou dosagem sérica de IgE específica para o amendoim e, quando necessário, realização do Teste de provocação oral48. No entanto, isso implicaria que todas as crianças de alto risco tivessem acesso a serviço especializado de alergia para testagem dos principais alérgenos - nesse caso do amendoim, o que é inviável na maior parte dos países, inclusive no Brasil46. Portanto, essa é mais uma questão que permanece em aberto, à espera de mais evidências.
QUE OUTROS FATORES, ALÉM DA ALIMENTAÇÃO COMPLEMENTAR, PODEM INTERFERIR NO DESFECHO DA ALERGIA ALIMENTAR?
Fatores genéticos, ambientais e dietéticos podem influenciar na ocorrência da alergia alimentar49. Entre os fatores genéticos, os que predispõem a defeitos nas filagrinas e, consequentemente, na barreira cutânea, facilitam a sensibilização transcutânea50. Neste racional, procurou-se avaliar se o uso de hidratantes foi passível de diminuir a sensibilização via transcutânea precoce, evitando assim o desenvolvimento de alergia alimentar12. Até o momento, os resultados não confirmaram esta hipótese, como evidenciado em revisão sistemática. No entanto, argumenta-se que talvez hidratantes mais específicos possam trazer resultados mais promissores50.
O convívio com animais e com outras pessoas podem ser considerados fatores ambientais protetores, ao passo que, uso de antibióticos, parto cesárea e inibidores da secreção ácida, fatores de risco51. Com relação à dieta, tem sido estudado como fatores protetores a amamentação, uso de probióticos e preferência por alimentos preparados em casa e com alto teor de fibras49. Um estudo com 1.628 crianças mostrou que dieta materna na gravidez rica em produtos industrializados e açucarados, combinado com um período mais longo de amamentação, pode favorecer alergia alimentar, sugerindo um efeito nocivo das gorduras trans nas crianças51. Mais estudos com suplementação de ácidos graxos de cadeia curta e fibras são necessários52,53, além de estudos para confirmar os efeitos imunomodulatórios da vitamina D e antioxidantes na prevenção de alergia alimentar54,55.
Com relação ao efeito dos probióticos, sabe-se que podem ter um papel na indução de células T regulatórias na mucosa, reforçando a barreira epitelial e protegendo contra a sensibilização a alérgenos alimentares56. Não está claro qual seria o momento ideal de intervenção, mas, segundo um estudo multicêntrico, talvez a idade de 3 a 6 meses seja uma janela durante a qual a microbiota intestinal possa influenciar a alergia alimentar53. Definições mais claras de microbiomas saudáveis e alergênicos são necessárias levando em consideração que variam em diferentes idades, regiões, grupos de risco e classes sociais. Apesar dos probióticos serem promissores na prevenção de alergia alimentar, uma revisão sistemática recente da Academia Europeia de Alergia57 e da Organização Mundial de Alergia concluem que os dados são insuficientes para que se recomende suplementação com probiótico, prebiótico, simbiótico ou transplante fecal na alergia alimentar, devido ao limitado e baixo nível de qualidade de evidências, seja na criança ou na gestante58.
Roduit e cols. avaliaram que, em uma coorte de 301 crianças, o consumo de iogurte, peixes, vegetais e frutas no primeiro ano de vida foi associado ao aumento do butirato, um metabólito da microbiota saudável, nas fezes das crianças na idade de 1 ano e reduziu a sensibilização a alérgenos alimentares até os 6 anos59, reforçando o conceito de que uma alimentação variada e saudável seja importante para o desenvolvimento de tolerância oral60.
CONCLUSÕES
Embora não haja na literatura uma padronização mais evidente ao que consideramos introdução alimentar precoce, já dispomos de dados suficientes para demonstrar que o atraso na introdução alimentar tem forte associação com um risco maior de alergias alimentares e, considerando os diversos benefícios do aleitamento materno, sugere-se que a introdução oportuna da alimentação complementar não seja feita antes dos seis meses de vida, e que, a partir dessa idade, mesmo os alimentos potencialmente alergênicos possam ser introduzidos na dieta, idealmente dentro do primeiro ano de vida, preferencialmente em vigência do aleitamento materno e mantendo-se um consumo rotineiro, respeitando o hábito alimentar da família.
REFERÊNCIAS
1. Sicherer SH, Sampson HA. Food allergy: a review and update on epidemiology, pathogenesis, diagnosis, prevention and management. J Allergy Clin Immunol. 2018;141:41-58.
2. Baker MG, Nowak-Wegrzyn A. Food allergy prevention: current evidence. Curr Opin Clin Nutr Metab Care. 2020;23(3):196-202.
3. Lack G. Update on risk factors for food allergy. J Allergy Clin Immunol. 2012;129(5):1187-97.
4. Fiocchi A Assa'ad A, Bahna S; Adverse Reactions to Foods Committee, American College of Allergy, Asthma and Immunology. Food allergy and the introduction of solid foods to infants: a consensus document. Ann Allergy Asthma Immunol. 2006;97(1):10-20.
5. Du Toit G, Foong R-XM, Lack G. Prevention of food allergy- Early dietary interventions. Allergology International. 2016;65(4):370-7.
6. Du Toit G, Roberts G, Sayre PH, Bahnson HT, Radulovic S, Santos AF, et al. Randomized trial of peanut consumption in infants at risk for peanut allergy. N Engl J Med. 2015;372:803-13.
7. Perkin MR, Logan K, Marrs T, Radulovic S, Craven J, Flohr C, et al. Enquiring About Tolerance (EAT) study: feasibility of an early allergenic food introduction regimen. J Allergy Clin Immunol. 2016;137:1477-86.
8. Tan JWL, Valerio C, Barnes EH, Van Asperen PP, Kakakios AM, Campbell DE. Early introduction of dietary egg reduces egg sensitization at 12 months of age in infants at risk of allergic disease. J Allergy Clin Immunol. 2017;139:1621-8.
9. Bellach J, Schwarz V, Ahrens B, Trendelenburg V, Keil T, Niggemann B, et al. Early introduction of hen's egg during weaning results in frequent allergic reactions: first results from a randomized placebo-controlled trial on hen's egg allergy prevention. Allergy. 2015;70(101):111.
10. Palmer DJ, Metcalfe J, Makrides M, Gold MS, Quinn P, West CE, et al. Early regular egg exposure in infants with eczema: a randomized controlled trial. J Allergy Clin Immunol. 2013;132:387-92.
11. Palmer DJ, Sullivan TR, Gold MS, Prescott SL, Makrides M. Randomized controlled trial of early regular egg intake to prevent egg allergy. J Allergy Clin Immunol. 2017;139:1600-7.
12. Natsume O, Kabashima S, Nakazato J, Yamamoto-Hanada K, Narita M, Kondo M; PETIT Study Team. Two-step egg introduction for prevention of egg allergy in high-risk infants with eczema (PETIT): a randomised, double-blind, placebo-controlled trial. Lancet. 2017 Jan 21;389(10066):276-86.
13. Heine RG. Food Allergy Prevention and Treatment by Targeted Nutrition. Ann Nutr Metab. 2018;72:27-39.
14. Tran MM, Lefebvre DL, Dai D, Dharma C, Subbarao P, Lou W, et al. Timing of food introduction and development of food sensitization in a prospective birth cohort. Pediatr Allergy Immunol. 2017;28(5):471-7.
15. World Health Organization. Report of the expert consultation on the optimal duration of exclusive brestfeeding. Genebra: World Health Organization; 2001.
16. BRASIL, Ministério da Saúde. Guia alimentar para crianças menores de 2 anos. Brasília-DF: Ministério da Saúde; 2019. p. 265.
17. Sociedade Brasileira de Pediatria - Departamento de Nutrologia. Guia Prático de Alimentação da Criança de 0 a 5 anos. São Paulo: SBP - Departamentos Científicos de Nutrologia e Pediatria Ambulatorial; 2021. p. 74.
18. Agostoni C, Decsi T, Fewtrell M, Goulet O, Kolacek S, Koletzko B, et al. Complementary feeding: a commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2008;46(1):99-110.
19. Sansotta N, Piacentini GL, Mazzei F, Minniti F, Boner AL, Peroni DG. Timing of introduction of solid food and risk of allergic disease development: Understanding the evidence. Allergol Immunopathol (Madr). 2013;41(5):337-45.
20. Ferraro V, Zanconato S, Carraro S. Timing of Food Introduction, and the Risk of Food Allergy. Nutrients 2019;11:1131.
21. Lack G, Fox D, Northstone K, Golding J. Avon Longitudinal Study of Parents and Children Study Team. Factors associated with the development of peanut allergy in childhood. N Engl J Med. 2003;348:977-85.
22. Brough HA, Santos AF, Makinson K, Penagos M, Stephens AC, Douiri A, et al. Peanut protein in household dust is related to household peanut consumption and is biologically active. J Allergy Clin Immunol. 2013;132:630-8.
23. Brough HA, Simpson A, Makinson K, Hankinson J, Brown S, Douiri A, et al. Peanut allergy: effect of environmental peanut exposure in children with filaggrin loss-of-function mutations. J Allergy Clin Immunol. 2014;134:867-75.
24. Fox AT, Sasieni P, du Toit G, Syed H, Lack G. Household peanut consumption as a risk factor for the development of peanut allergy. J Allergy Clin Immunol. 2009;123:417-23.
25. Du Toit G, Katz Y, Sasieni P, Mesher D, Maleki SJ, Fisher HR, et al. Early consumption of peanuts in infancy is associated with a low prevalence of peanut allergy. J Allergy Clin Immunol. 2008;122:984-91.
26. Du Toit G, Sampson HA, Plaut M, Burks W, Akdis CA, Lack G. Food allergy: Update on prevention and tolerance. J Allergy Clin Immunol. 2018;141:30-40.
27. Caffarelli C, Di Mauro, D, Mastrorilli C, Bottau P, Cipriani F, Ricci G. Solid Food Introduction and the Development of Food Allergies. Nutrients. 2018;10(11),1790.
28. Hourihane JO, Dean TP, Warner JO. Peanut allergy in relation to heredity, maternal diet, and other atopic diseases: results of a questionnaire survey, skin prick testing, and food challenges. BMJ. 1996;313(7064):1046.
29. Lack G, Fox D, Northstone K, Golding J. Factors associated with the development of peanut allergy in childhood. N Engl J Med. 2003;348:977-85.
30. Fleischer DM, Chan ES, Venter C, Spergel JM, Abrams EM, Stukus D, et al. A Consensus Approach to the Primary Prevention of Food Allergy Through Nutrition: Guidance from the American Academy of Allergy, Asthma, and Immunology; American College of Allergy, Asthma, and Immunology; and the Canadian Society for Allergy and Clinical Immunology. J Allergy Clin Immunol Pract. 2021;9(1):22-43.
31. Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, et al. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021;32:843-58.
32. Urashima M, Mezawa H, Okuyama M, Urashima T, Hirano D, Gocho N, et al. Primary prevention of cow's milk sensitization and food allergy by avoiding supplementation with cow's milk formula at birth: a randomized clinical trial. JAMA Pediatr. 2019;173:1137-45.
33. Gappa M, Filipiak-Pittroff B, Libuda L, von Berg A, Koletzko S, Bauer CP, et al. Long-term effects of hydrolyzed formulae on atopic diseases in the GINI study. Allergy. 2021;76(6):1903-7.
34. Osborn DA, Sinn JK, Jones LJ. Infant formulas containing hydrolysed protein for prevention of allergic disease and food allergy. Cochrane Database Syst Rev. 2017 Mar 15;3(3):CD003664.
35. Schroer B, Groetch M, Mack DP, Venter C. Practical Challenges and Considerations for Early Introduction of Potential Food Allergens for Prevention of Food Allergy. J Allergy Clin Immunol Pract. 2021 Jan;9(1):44-56.e1.
36. Royal C, Gray C. Allergy Prevention: An Overview of Current Evidence. Yale J Biol Med. 2020 Dec 29;93(5):689-98.
37. D'Auria E, Peroni GP, Sartorio MUA, Verduci E, Zuccotti GV, Venter C. The role of diet diversity and diet indices on allergy outcomes. Front Pediatr. 2020;8:545.
38. Szajewska H, Horvath A. A partially hydrolyzed 100% whey formula and the risk of eczema and any allergy: an updated meta-analysis. World allergy Organ J. 2017;10(1):27.
39. Roberts G. Another step towards prevention of food allergy. Lancet. 2017;389(10066):230-1.
40. Ierodiakonou D, Garcia-Larsen V, Logan A, Groome A, Cunha S, Chivinge J, et al. Timing of Allergenic Food Introduction to the Infant Diet and Risk of Allergic or Autoimmune Disease: A Systematic Review and Meta-analysis. JAMA. 2016;316(11):1181-92.
41. EFSA Panel on Nutrition, Novel Foods and Food Allergens (NDA), Castenmiller J, de Henauw S, Hirsch-Ernst KI, Kearney J, Knutsen HK, Maciuk A, et al. Appropriate age range for introduction of complementary feeding into an infant's diet. EFSA J. 2019 Sep 12;17(9):e05780. doi: 10.2903/j.efsa.2019.5780.
42. Turner PJ, Feeney M, Meyer R, Perkin MR, Fox AT. Implementing primary prevention of food allergy in infants: New BSACI guidance published. Clin Exp Allergy. 2018;48(8):912-5.
43. Sicherer SH, Sampson HA. Food allergy: a review and update on epidemiology, pathogenesis, diagnosis, prevention, and management. J Allergy Clin Immunol. 2018;141:4-58.
44. Peters RL, Barret DY, Soriano VX, McWilliam V, Lowe AJ, Ponsonby AL, et al. No cashew allergy in infants introduced to cashew by age 1 year. J Allergy Clin Immunol. 2021;147(1):383-4.
45. Greer FR, Sicherer SH, Burks AW; Committee on Nutrition; Section on Allergy and Immunology. The Effects of Early Nutritional Interventions on the Development of Atopic Disease in Infants and Children: The Role of Maternal Dietary Restriction, Breastfeeding, Hydrolyzed Formulas, and Timing of Introduction of Allergenic Complementary Foods. Pediatrics. 2019 Apr;143(4):e20190281.
46. Fisher HR, Du Toit G, Bahnson HT, Lack G. The challenges of preventing food allergy: Lessons learned from LEAP and EAT. Ann Allergy Asthma Immunol. 2018;121(3):313-9.
47. D'Auria E, Peroni GP, Sartorio MUA, Verduci E, Zuccotti GV, Venter C. The role of diet diversity and diet indices on allergy outcomes. Front Pediatr. 2020; 8;545. doi.org/10.3389/fped.2020.00545.
48. Fleischer DM, Spergel JM, Assa'ad AH, Pongracic JA. Primary prevention of allergic disease through nutritional interventions. J Allergy Clin Immunol Pract. 2013;1(1):29-36.
49. Berni Canani R, Paparo L, Nocerino R, Di Scala C, Della Gatta G, Maddalena Y, et al. Gut Microbiome as Target for Innovative Strategies Against Food Allergy. Front Immunol. 2019;15(10):191.
50. Kelleher MM, Cro S, Van Vogt E, Cornelius V, Lodrup Carlsen KC, Ove Skjerven H, et al. Skincare interventions in infants for preventing eczema and food allergy: A cochrane systematic review and individual participant data meta-analysis. Clin Exp Allergy. 2021;51(3):402-18.
51. Kim YH, Kim KW, Lee SY, Koo KO, Kwon SO, Seo JH, et al. Maternal Perinatal Dietary Patterns Affect Food Allergy Development in Susceptible Infants. J Allergy Clin Immunol Pract. 2019;7(7):2337-47.
52. Schindler T, Sinn JK, Osborn DA. Polyunsaturated fatty acid supplementation in infancy for the prevention of allergy. Cochrane Database Syst Rev. 2016:28;10.
53. Bunyavanich S, Shen N, Grishin A, Wood R, Burks W, Dawson P, et al. J Allergy Clin Immunol. 2016;138(4):1122-1130.
54. Shu SA, Yuen AWT, Woo E, Chu KH, Kwan HS, Yang GX, et al. Microbiota and Food Allergy. Clin Rev Allergy Immunol. 2019 Aug;57(1):83-97.
55. Venter C, Agostoni C, Arshad SH, Ben-Abdallah M, Du Toit G, Fleischer DM, et al. Dietary factors during pregnancy and atopic outcomes in childhood: A systematic review from the European Academy of Allergy and Clinical Immunology. Pediatr Allergy Immunol. 2020;31(8):889-912.
56. Sampson HA, O'Mahony L, Burks AW, Plaut M, Lack G, Akdis CA. Mechanisms of food allergy. J Allergy Clin Immunol. 2018;141(1):11-9.
57. de Silva D, Halken S, Singh C, Muraro A, Angier E, Arasi S, et al. Preventing food allergy in infancy and childhood: Systematic review of randomised controlled trials. Pediatr Allergy Immunol. 2020;31(7):813-26.
58. Fox A, Bird JA, Fiocchi A, Knol J, Meyer R, Salminen S, et al. The potential for pre-, pro- and synbiotics in the management of infants at risk of cow's milk allergy or with cow's milk allergy: An exploration of the rationale, available evidence and remaining questions. World Allergy Organ J. 2019;12(5):100034.
59. Roduit C, Frei R, Ferstl R, Loeliger S, Westermann P, Rhyner C, et al. High levels of butyrate and propionate in early life are associated with protection against atopy. Allergy. 2018;74(4):799-809.
60. Bunyavanich S, Berin MC. Food allergy and the microbiome: Current understandings and future directions. J Allergy Clin Immunol. 2019;144(6):1468-77.