Número Atual: Janeiro-Março 2022 - Volume 6 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Herberto Jose Chong-Neto
- Alfonso Cepeda
- Ana Sofia Moreira
- Andrea Leonardi
- Cristine Rosário
- Dirceu Solé
- Elizabeth Maria Mercer Mourão
- Fábio Chigres Kuschnir
- Fábio Ejzembaum
- Fausto Matsumoto
- Francisco M. Vieira
- Gennaro D'amato
- German Dario Ramon
- Gesmar Rodrigues Silva Segundo
- Giorgio Walter Canonica
- Gustavo Falbo Wandalsen
- Hector Badelino
- Ignácio Ansotegui
- Ivan Oswaldo Tinoco
- João Negreiros Tebyriçá
- Jose E. Gereda
- Juan Carlos Sisul Alvariza
- Leonard Bielory
- Luis Felipe Ensina
- Maria Isabel Rojo Gutiérrez
- Maria Susana Repka-Ramirez
- Marilyn Urrutia Pereira
- Marina Fernandes A. Cheik
- Mario Sanchez Borges
- Marylin Valentin Rostan
- Patricia Latour Staffeld
- Pedro Piraino
- Raphael Coelho Figueredo
- René Maximiliano Gomez
- Rodrigo Rodrigues Alves
- Rubén Horacio Pulido
- Nelson Augusto Rosário
ARTIGO ESPECIAL
Diretriz Latino-americana sobre o Diagnóstico e Tratamento da Alergia Ocular - Em nome da Sociedade Latinoamericana de Alergia, Asma e Imunologia (SLAAI)
Latin American Guideline on the Diagnosis and Treatment of Ocular Allergy - On behalf of the Latin American Society of Allergy, Asthma and Immunology (SLAAI)
Herberto Jose Chong-Neto1; Alfonso Cepeda2; Ana Sofia Moreira3; Andrea Leonardi4; Cristine Rosário1; Dirceu Solé5; Elizabeth Maria Mercer Mourão1; Fábio Chigres Kuschnir6; Fábio Ejzembaum7; Fausto Matsumoto5; Francisco M. Vieira8; Gennaro D'amato9; German Dario Ramon10; Gesmar Rodrigues Silva Segundo11; Giorgio Walter Canonica12; Gustavo Falbo Wandalsen5; Hector Badelino13; Ignácio Ansotegui14; Ivan Oswaldo Tinoco15; João Negreiros Tebyriçá16; Jose E. Gereda17; Juan Carlos Sisul Alvariza18; Leonard Bielory19; Luis Felipe Ensina5; Maria Isabel Rojo Gutiérrez20; Maria Susana Repka-Ramirez21; Marilyn Urrutia Pereira22; Marina Fernandes A. Cheik11; Mario Sanchez Borges23; Marylin Valentin Rostan24; Patricia Latour Staffeld25; Pedro Piraino26; Raphael Coelho Figueredo27; René Maximiliano Gomez28; Rodrigo Rodrigues Alves3; Rubén Horacio Pulido28; Nelson Augusto Rosário1
DOI: 10.5935/2526-5393.20220002
1. Universidade Federal do Paraná - Curitiba, PR, Brasil
2. Universidad Metropolitana - Barranquilla, Colômbia
3. Hospital Divino Espirito Santo de Ponta Delgada - Cidreiro, Portugal
4. University of Padua - Padua, Itália
5. Universidade Federal de São Paulo - Escola Paulista de Medicina - São Paulo, SP, Brasil
6. Universidade Estadual do Rio de Janeiro - Rio de Janeiro, RJ, Brasil
7. Santa Casa de São Paulo - São Paulo, SP, Brasil
8. Universidade Federal de Caxias do Sul - Caxias do Sul, RS, Brasil
9. Federico II University - Nápoles, Itália
10. Hospital Italiano Regional del Sur - Bahía Blanca, Argentina
11. Universidade Federal de Uberlândia - Uberlândia, MG, Brasil.
12. Humanitas University - Gênova, Itália
13. Universidad de Economía y Ciencias Sociales - San Francisco, Córdoba, Argentina
14. Hospital Quirón Bizkaia - Erandio, Espanha
15. Universidad Estatal de Cuenca - Cuenca, Equador
16. Universidade Federal do Rio de Janeiro - Rio de Janeiro, RJ, Brasil
17. Clínica Ricardo Palma - Lima, Peru
18. Allergy and Immunology - Asuncion, Paraguai
19. Hackensack Meridian School of Medicine - Nutley, New Jersey, EUA
20. Hospital Juarez de Mexico - México City, México
21. Universidad Nacional de Asunción - Asunción, Paraguai
22. Universidade Federal do Pampa - Uruguaiana, RS, Brasil
23. Centro Médico Docente La Trinidad, Departamento de Alergología e Inmunología Clínica - Caracas, Venezuela
24. Hospital Pereira Rossell, División de Alergia Pediátrica y Medicina Respiratoria - Montevideo, Uruguai
25. Universidad Nacional Pedro Henriquez Ureña - Santo Domingo, República Dominicana
26. Instituto de Previsión Social - Hospital Central - Asunción, Paraguai
27. Universidade Iguaçu - Imperatriz, Brasil
28. Fundación Hospital Universitario - Salta, Argentina
Endereço para correspondência:
Herberto Jose Chong Neto
E-mail: h.chong@uol.com.br
Submetido em: 19/01/2021
Aceito em: 25/01/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A alergia ocular, também conhecida como conjuntivite alérgica (CA), é uma reação de hipersensibilidade mediada por imunoglobulina E (IgE) do olho desencadeada por aeroalérgenos, principalmente ácaros da poeira doméstica e pólen de gramíneas. Os sintomas geralmente consistem em prurido ocular ou periocular, lacrimejamento e olhos vermelhos que podem estar presentes durante todo o ano ou sazonalmente. A alergia ocular tem frequência elevada, é subdiagnosticada e pode ser debilitante para o paciente. É potencialmente danosa para a visão, nos casos em que ocasiona cicatrização corneana grave, e na maioria dos pacientes associa-se a outros quadros alérgicos, principalmente rinite, asma e dermatite atópica. É classificada em conjuntivite alérgica perene, conjuntivite alérgica sazonal, ceratoconjuntivite atópica e ceratoconjuntivite vernal. O diagnóstico procura evidenciar o agente etiológico e a confirmação se dá pela realização do teste de provocação conjuntival. O tratamento baseia-se em evitar o contato com os desencadeantes, lubrificação, anti-histamínicos tópicos, estabilizadores de mastócitos, imunossupressores e imunoterapia específica com o objetivo de obter o controle e prevenir as complicações da doença.
Descritores: Alergia ocular; conjuntivite alérgica; rinoconjuntivite.
INTRODUÇÃO
A alergia ocular, também conhecida como conjuntivite alérgica (CA) é uma reação de hipersensibilidade mediada por imunoglobulina E (IgE) do olho desencadeada por aeroalérgenos, principalmente ácaros da poeira doméstica e pólen de gramíneas. Os sintomas geralmente consistem em prurido ocular ou periocular, lacrimejamento e olhos vermelhos, que podem estar presentes durante todo o ano ou sazonalmente1.
A alergia ocular tem frequência elevada, é subdiagnosticada e pode ser debilitante para o paciente, e, muitas vezes, desafiadora. É potencialmente danosa para a visão nos casos em que ocasiona cicatrização corneana grave, e na maioria dos pacientes associa-se a outros quadros alérgicos, principalmente rinite, asma e dermatite atópica1.
Anatomia do olho
O olho de maneira geral pode ser dividido em três partes: externa (composta por córnea e esclera), camada média (trato uveal-íris, corpo ciliar e coroide), e a camada interna, composta pela retina.
Conjuntiva
A conjuntiva é uma membrana mucosa, fina e transparente que recobre a esclera e também as pálpebras, internamente (região conhecida como fundo de saco). Tem vascularização rica, composta por tecido conjuntivo e linfoide. Entre a episclera e a conjuntiva temos a cápsula de Tenon, membrana colagenosa espessa que envolve o olho do nervo óptico ao limbo (Figura 1).
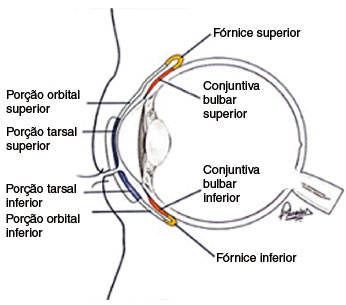
Figura 1
Aspecto anatômico da conjuntiva
A primeira camada é a epitelial. Composta por células caliciformes, glândulas unicelulares que secretam mucina. As células caliciformes podem produzir até 2,2 mL de muco por dia. O muco é essencial para a integridade da superfície ocular, pois lubrifica e protege as células epiteliais. A mucina reduz a tensão superficial do filme lacrimal para garantir sua estabilidade. Melanócitos: os melanócitos são vistos principalmente no limbo, fórnice, plica semilunar, carúncula e nos locais de perfuração dos vasos ciliares anteriores. Às vezes, eles dão à conjuntiva uma coloração acastanhada. Células de Langerhans: as células de Langerhans são, na verdade, células dendríticas. Sua principal função é processar o material do antígeno e apresentá-lo na superfície a outras células do sistema imunológico. Assim, elas funcionam como células apresentadoras de antígenos. A maior densidade de células de Langerhans foi encontrada na conjuntiva tarsal, seguida pelo fórnice e conjuntiva bulbar. O número de células diminui com a idade.
A segunda camada é a substância própria. Consiste em uma camada linfoide superficial e uma camada fibrosa mais profunda. É rica em mastócitos, linfócitos, células plasmáticas e neutrófilos.
Os linfócitos, principalmente linfócitos T, são encontrados em abundância na conjuntiva. Eles estão presentes na substância própria e no epitélio em uma proporção de 2:3. Agregações linfoides semelhantes ao tecido linfoide associado à mucosa (MALT) encontrado no intestino e brônquios, também são observadas na conjuntiva. Essas agregações linfoides que consistem em linfócitos T e B são conhecidas como tecido linfoide associado à conjuntiva (CALT).
Os mastócitos são basófilos semelhantes a células granulocíticas. A conjuntiva contém um grande número de mastócitos na substância própria. O número total de mastócitos na conjuntiva e tecido anexial é de aproximadamente 50 milhões. A conjuntivite alérgica é uma reação de hipersensibilidade mediada por mastócitos típica. Em pacientes com conjuntivite alérgica, os mastócitos também foram encontrados no epitélio conjuntival.
A terceira camada é a fibrosa, contém vasos, nervos e as glândulas de Krause.
A função da conjuntiva é proteger a superfície ocular de agentes externos e manter a lubrificação ocular, uma vez que o muco produzido pela conjuntiva ajuda a evitar o ressecamento ocular. É dividida em conjuntiva palpebral, bulbar e fornicial.
A conjuntiva palpebral é novamente subdividida em conjuntiva marginal, conjuntiva tarsal e orbital. A conjuntiva marginal é uma zona de transição entre a pele da pálpebra e a conjuntiva propriamente dita. Começa nas faixas intermarginais da pálpebra como uma continuação da pele. É constituída por epitélio estratificado. A conjuntiva marginal continua na superfície posterior da pálpebra por uma curta distância de 2 mm, até um sulco ou prega rasa, onde se funde com a conjuntiva propriamente dita. Este sulco é denominado sulco subtarsal.
A parte fornicial é uma dobra que reveste o fundo de saco formado pela conjuntiva que cobre a superfície posterior das pálpebras até a conjuntiva que cobre a superfície anterior do globo, essa porção é mais espessa e fracamente fixada para permitir o movimento do globo. É dividido em quatro regiões, conforme descrito a seguir.
O fórnice superior fica entre a pálpebra superior e o globo. Ele se estende de 8 a 10 mm da borda superior do limbo. O fórnice inferior fica entre a pálpebra inferior e o globo. Ele se estende até uma distância de 8 mm abaixo da parte inferior do limbo. O fórnice lateral está situado entre o canto lateral do olho e o globo. Ele se estende por uma distância de 15 mm da parte lateral do limbo. O fórnice medial é o mais raso e contém a carúncula e a plica semilunar.
A conjuntiva bulbar é a mais fina de todas as partes da conjuntiva, e tão transparente que a esclera e os vasos brancos subjacentes são vistos claramente. Ela está frouxamente presa, exceto por uma zona de 3 mm perto do limbo e perto das inserções dos músculos retos. A conjuntiva límbica é a parte da conjuntiva bulbar que cobre a região límbica e se funde com o epitélio corneano.
SEMIOLOGIA DA CONJUNTIVITE ALÉRGICA
Diante de um paciente com suspeita de conjuntivite alérgica, devemos estabelecer a origem etiológica de sua condição e estabelecer se seus sintomas são devidos a uma condição primária ou são secundários a outras doenças, como olho seco ou blefarite, que são causas frequentes de inflamação conjuntival e cujo tratamento deve se concentrar no tratamento das causas subjacentes2.
Para isso, é importante valorizar as ferramentas da clínica médica, que incluem uma boa anamnese, exploração clínica e a realização de exames complementares que nos permitem estabelecer um diagnóstico preciso, e assim tratar o paciente corretamente. A avaliação inicial deve incluir aspectos relevantes do exame oftalmológico geral e, em seguida, concentrar-se no exame específico da condição alérgica.
Anamnese
É necessário perguntar sobre os tópicos relacionados a seguir.
- Duração dos sintomas, sua evolução e recorrência.
- Fatores que os exacerbam.
- Apresentação uniu ou bilateral.
- Tipo de secreção: seroso, mucoso, purulento, filamentoso, etc.
- Exposição a diferentes ambientes e/ou substâncias.
- Esfrega ("fricção") os olhos.
- Lentes de contato: uso do regime, tipo de lentes, higiene, líquidos de limpeza, etc.
- História de alergias, asma, eczema, atopia, etc.
- Medicamentos tópicos e/ou sistêmicos em uso.
- Comprometimento imunológico: imunossupressão, quimioterapia, transplantes, etc.
- Doenças sistêmicas: atopia, síndrome de Stevens Johnson, câncer, etc.
- Exposição à fumaça do tabaco: fumante ativo ou passivo, uso de drogas ilegais.
- Ocupações e hobbies, exposição a poluentes do ar, viagens, hábitos de exercício, dieta, etc.
Exame físico
O exame físico inicial do paciente com conjuntivite alérgica inclui a avaliação da acuidade visual, o exame externo e o exame com uma lâmpada de fenda.
Deve incluir uma exploração detalhada de:
- linfadenopatias regionais: especialmente pré-auriculares, a fim de descartar a doença infecciosa;
- pele: em busca de sinais de rosácea, eczema, seborreia, etc.;
- anormalidades das pálpebras e anexos: inflamação, descoloração, ulcerações, nódulos, perda de cílios, etc.;
- sintomas e sinais: hiperemia, presença de folículos e papilas, aderência de pálpebras, prurido, irritação, dor, fotofobia, visão turva, epífora, etc.
Além disso, através do uso da lâmpada de fenda (biomicroscópio), deve ser dada atenção a:
- bordas palpebrais: inflamação, hiperedema ou hipopigmentação, alterações das glândulas de meibomia, queratinização, etc.;
- conjuntiva: lateralidade dos sintomas, tipo de reação conjuntival (folicular, papilar), distribuição (difusa, local), etc.;
- cílios: perda, triquíase, secreções, parasitas (demodex, piolhos);
- sistema lacrimal: punção e canais;
- conjuntiva tarsal e fornix: folículos, cicatrizes, corpos estranhos, etc.;
- conjuntiva bulbar: folículos, edema, nódulos, quemos, laxidade, papilas, úlceras, corpos estranhos, queratinização, etc.
TESTES DE DIAGNÓSTICO COMPLEMENTARES3
Manchas de diagnóstico in vivo da superfície ocular
Existem diferentes substâncias com propriedades de coloração que podem ser usadas para estudar a superfície ocular e que são muito úteis para o diagnóstico e monitoramento de pacientes com conjuntivite alérgica. Estas são a fluoresceína, a rosa de bengala e o verde da lisamina.
Culturas alvo
Biópsia/escovação/conjuntival raspada
Testes de sangue/lágrimas
Provocação conjuntival
Outros métodos de diagnóstico
FISIOPATOLOGIA DA CONJUNTIVITE ALÉRGICA
As doenças alérgicas dos olhos são causadas pela exposição direta da mucosa ocular a alérgenos ambientais, que são dissolvidos na lágrima e penetram na conjuntiva para se juntar aos anticorpos IgE ligados à superfície de mastócitos.
Uma vez que a conjuntiva é uma área da mucosa semelhante à mucosa nasal, os mesmos alérgenos que desencadeiam a rinite alérgica podem estar envolvidos na patogênese da conjuntivite alérgica. Antígenos comuns no ar, como poeira, fungos, pólen e gramíneas, podem causar os sintomas da conjuntivite alérgica aguda, como prurido, vermelhidão, queimação e lacrimejamento.
Em indivíduos sensibilizados, as células Th2 liberam citocinas proinflamatórias (IL-4, IL-5, IL-13) que estimulam a produção de IgE por células B4.
As reações produzidas podem ser divididas em um estágio inicial com duração de 20 a 30 minutos, que está relacionado à ativação específica dos mastócitos conjuntivais que causa sua degranulação, liberando histamina, proteoglicanos, proteases (triptase, quimases), bem como a formação de mediadores lipídicos (prostaglandinas e leucotrienos), interleucina (IL-4, IL-5, IL-6, IL-8, IL-13) e fator de necrose tumoral alfa (TNF-a). Essa reação segue uma fase tardia originada pela estimulação de células epiteliais e fibroblastos com a liberação de citocinas proinflamatórias e quimiocinas e caracterizada por infiltração de células inflamatórias (neutrófilos, eosinófilos, linfócitos e macrófagos), com consequente inflamação conjuntival persistente. Ao contrário de outras doenças alérgicas, há pouca infiltração eosinofílica em formas agudas, que aumentam à medida que a patologia é crônica.
Desde a descoberta de duas subpopulações de células T CD4+ funcionalmente diferentes (TH1 e TH2) há cerca de 30 anos, tornou-se rapidamente evidente que as células TH2 desempenham um papel crucial no desenvolvimento da inflamação alérgica do trato respiratório. Comumente, assumiu-se que uma resposta imune th2 e tipo I hipersensibilidade formam a base da conjuntivite alérgica. Acredita-se que os principais fatores que contribuem para a gravidade da CA são a carga de alérgenos na superfície ocular e a IgE específica produzida localmente. Além disso, há uma correlação muito significativa entre a presença de IgE específica de alérgenos em lágrimas e sintomas de alergia ocular. Esta liberação contínua de histamina, juntamente com o aumento da carga alérgica, leva a uma população em expansão de mastócitos que residem no tecido conjuntival, perpetuando assim a resposta alérgica. Existe uma correlação geral entre o grau de infiltração celular e a gravidade da doença. Além disso, sabe-se que os produtos de infiltração celular promovem irritação conjuntival. Além disso, as células epiteliais conjuntivas e fibroblastos geram a resposta alérgica, produzindo citocinas e outros fatores que mantêm a inflamação local e levam à remodelação tecidual5.
Descobriu-se que novas subpopulações de células T auxiliares - células Th17 que produzem interleucina-17 (IL-17) - desempenham um papel importante na patogênese da conjuntivite mediada por Th2. Estudos mostraram que as células Th17 estão envolvidas em uma variedade de inflamações imunológicas, incluindo psoríase, artrite reumatoide, doença inflamatória intestinal, lúpus eritematoso sistêmico e asma. No entanto, o papel de Th17 e IL-17 na conjuntivite alérgica ainda não está claro6.
EPIDEMIOLOGIA
Existe carência de dados internacionais sobre a prevalência de alergia ocular. Nos Estados Unidos, estima-se que a alergia ocular (AO) afete 15-20% da população geral7. Acredita-se que sintomas oculares ocorram em 30-70% dos pacientes com rinite alérgica (RA)8, sendo que são mais comumente desencadeados por alérgenos intra do que extradomiciliares9.
Na Suécia, a prevalência estimada de conjuntivite alérgica foi de 19%, na Turquia, a prevalência de conjuntivite alérgica (CA) em crianças entre 6 e 14 anos foi de 7%. No Paquistão, a prevalência de conjuntivite em pacientes com idades entre 5 e 19 anos foi de 19%10.
A prevalência de sintomas de alergia ocular em adolescentes brasileiros em 3.120 escolares foi de 15,5%, considerando o critério de mais de três episódios de prurido ocular nos últimos 12 meses. Neste estudo a prevalência de CA foi maior no sexo feminino, com 17,4% em comparação ao masculino, com 13,3%. Fatores genéticos, hormonais e uso de cosméticos estão sendo investigados como possíveis causas11. Em outros estudos todos os sintomas de alergia ocular pesquisados foram significativamente mais prevalentes em adolescentes do sexo feminino, incluindo prurido ocular, lacrimação, sensibilidade à luz e sensação de areia nos olhos. As meninas apresentaram mais sintomas oculares, porém, menores taxas de sensibilização do que os meninos1,8.
Na maioria dos estudos os sintomas mais frequentemente relacionados são: lacrimejamento (74%), seguido de fotofobia (50%) e sensação de corpo estranho (37%). Nestes a prevalência de conjuntivite alérgica foi de 20%, afetando mais pessoas do sexo feminino do que do masculino (56% versus 46%; p = 0,01)10. Estudos mais recentes mostram uma tendência à mudança na prevalência dos sintomas de CA em relação ao sexo, sendo que na infância são mais frequentes em meninos e, após a puberdade, nas meninas8,9.
A conjuntivite alérgica (CA) é frequentemente subdiagnosticada em pacientes com rinite e asma. O diagnóstico de conjuntivite foi registrado pelo médico assistente em 16% de 1.549 asmáticos (idade média de 4,3 anos), no entanto, 618 (44%) tiveram pelo menos um sintoma ocular que sugeria alergia ocular (AO)12.
A CA isolada foi estimada em 6-30% da população geral. A conjuntivite alérgica sazonal é a forma mais frequente; entretanto, estudos de centros terciários de referência em oftalmologia relatam que as formas crônicas, como ceratoconjuntivite primaveril e atópica, são as mais frequentemente vistas por oftalmologistas. Uma pesquisa envolvendo 304 oftalmologistas mostrou que a maioria dos pacientes com conjuntivite alérgica sofre anualmente de poucos episódios de conjuntivite leve e intermitente. No entanto, 30% dos pacientes são acometidos por episódios frequentes com sintomas intensos e persistentes. O tratamento frequentemente não é apropriado9.
Trabalho realizado em um centro brasileiro de oftalmologia avaliou 207 pacientes; destes, 38% foi diagnosticado com ceratoconjuntivite primaveril; 39% com ceratoconjuntivite atópica; 13% com conjuntivite alérgica perene e em 10% dos pacientes não houve diagnóstico definido. A presença de alergia extraocular foi maior em pacientes com conjuntivite atópica (91%), e menor em pacientes com primaveril (32%). Os sintomas mais intensos foram prurido e lacrimejamento em pacientes com ceratoconjuntivites, e houve correlação positiva entre a intensidade dos sintomas e dos sinais clínicos13.
DESENCADENANTES DA CONJUNTIVITE
As formas mais comuns de conjuntivite alérgica (CA) estão relacionadas ao tipo de alérgeno ao qual o paciente foi exposto e previamente sensibilizado, e incluem conjuntivite alérgica perene (CAP) ou sazonal (CAS). A diferença entre as duas é dada pela periodicidade ou persistência dos sintomas. A CAP é geralmente causada por alérgenos internos, como ácaros do pó doméstico, pelos de animais, baratas, esporos de fungos ou outros. A CAE geralmente é causada pelo pólen e é descrita com mais frequência em climas temperados, que se caracterizam por ter quatro estações bem diferenciadas durante o ano e apresentar chuvas nos meses de inverno, clima presente na América Anglo-Saxônica, onde uma maior prevalência de CAS é relatada.
A presença de polens e outros alérgenos sazonais, como fungos extradomiciliares (por exemplo: Cladosporium, Aspergillus) depende de fatores geográficos e meteorológicos; principalmente da temperatura e umidade relativa do ambiente. Alérgenos domiciliares menores, como os de gatos, cães e roedores, tendem a se tornar voláteis e permanecer suspensos no ar por mais tempo, o que lhes dá a capacidade de produzir sintomas graves ou incômodos4. Em contraste, os ácaros do pó doméstico ou alérgenos de baratas, devido ao seu tamanho maior, só podem permanecer suspensos por alguns minutos no ar. Muitos pacientes são sensibilizados a mais de um alérgeno, ou seja, são polissensibilizados e podem apresentar sintomas permanentes com exacerbações sazonais. Ser polissensibilizado parece estar associado à persistência e gravidade das doenças alérgicas14.
O papel da alergia mediada por IgE foi claramente demonstrado em CAS e CAP, e duas fases da inflamação foram caracterizadas. A fase inicial, mediada por IgE, começa alguns segundos ou minutos após a exposição ao alérgeno e dura de 20 a 30 minutos. A fase tardia, que começa algumas horas depois, é responsável pela inflamação contínua, com sintomas persistentes e risco de danos. Os testes de provocação de alérgenos conjuntivais são reproduzíveis e usados para confirmar o diagnóstico de CA por alérgenos sazonais e perenes, tanto em estudos de pesquisa, quanto na prática clínica.
ALERGIA OCULAR AO PÓLEN NA AMÉRICA LATINA
Os sintomas oculares (SO) associados à CAS ocorrem quando o pólen dissolve-se no filme lacrimal e atravessa a conjuntiva. Vinte por cento dos indivíduos com polinose submetidos à provocação nasal polínica apresentam SO, sugerindo que o mesmo pode ocorrer sem o contato direto do alérgeno na conjuntiva15.
A polinose é comum em regiões onde existe um inverno rigoroso, de baixas temperaturas, seguido de uma primavera exuberante (clima temperado ou subtropical). Assim, na América Latina, é prevalente em países como Argentina, Chile, Uruguai e Sul do Brasil (PR, SC, RS). Entretanto, pode-se considerar, eventualmente, também em regiões tropicais onde existam elevadas altitudes compensando as baixas latitudes.
A maioria dos estudos concentra-se na rinite, e poucos têm examinado sintomas oculares como entidade independente. Muitas vezes, descrevem-se SO como sintomas de alergia nasal, usando a expressão "rinoconjuntivite alérgica" ou simplesmente "rinite alérgica" ou combinam todos os sintomas dos olhos como SO16. Isso, naturalmente, vem dificultar estudos sobre a epidemiologia da CAS, não somente na América Latina, como também em outras partes do mundo17,18.
No Brasil, a polinose por gramíneas é encontrada, basicamente, nos estados do Sul (PR, SC, RS), onde predomina o clima subtropical, com estações climáticas bem-definidas, diferentemente do restante do país, com clima tropical. As gramíneas são o principal agente associado a modificações do meio ambiente externo nas últimas décadas, pelo aumento da população e a vegetação natural sendo substituída por atividades agrícolas e pastoris. Aqui se pode incluir o Lolium multiflorum (azevém) de intensa atividade alergênica, afora o Cynodon dactylon e Paspalum notatum.
Estudo retrospectivo sobre a CAS, envolvendo 876 pacientes com polinose na área de Caxias do Sul, RS, Brasil, onde a totalidade estava sensibilizada a antígenos de pólen de gramíneas mix, a CAS ocorreu em 86,2% dos casos, sendo classificada como grave em 24,8%, com "sintomas difíceis de tolerar interferindo nas atividades diárias e no sono"19.
Na cidade de Bahía Blanca (AR), o pólen aéreo começou a ser registrado a partir de 1995. Ao longo dos anos seguintes, foram realizados estudos aerobiológicos intermitentes e outros continuamente nas cidades de Buenos Aires, Bariloche, Córdoba, Neuquén (Valle del Rio Negro), Mar del Plata, Paraná, Santa Fé, Santa Rosa, Mendoza e, recentemente, na cidade de Trelew. Na cidade de Bahía Blanca, como em Buenos Aires, a sensibilidade cutânea através de testes com alérgenos correspondeu às contagens aerobiológicas e à representação geográfico-regional das espécies estudadas. Atualmente, segue-se com a coleta de dados de algumas cidades, e novos desafios e questões estão se abrindo para serem revelados em pesquisas futuras.
Muitos dos estudos realizados até agora podem ser encontrados resumidos no Atlas Alergopalinológico da República Argentina, publicado em 2019 pela Associação Argentina de Alergia e Imunologia Clínica.
A prevalência das diferentes espécies de plantas é mencionada de acordo com estudos aerobiológicos. Associa-se a sensibilidade cutânea alérgica ao pólen, ou a sorológica, na rinoconjuntivite alérgica e/ou asma.
A subdivisão das Gymnospermae quanto ao pólen aéreo é representada pela ordem Pinales, que compreende as Cupressaceae que são uma família de coníferas da ordem Cupressales de grande importância econômica e paisagística mundial. Essas espécies estão presentes em quase todas as cidades da Argentina e se destacam, principalmente, na cordilheira patagônica, sendo uma das espécies polínicas mais abundantes na cidade de Bariloche. Nothofagus, também conhecidas como "faias do sul", é um gênero de várias espécies de árvores e arbustos nativos do hemisfério sul da América e na Australásia.
Em geral, a sensibilidade ao pólen das Cupressaceas representa baixa sensibilidade aos testes cutâneos; entretanto, tornam-se sintomatologicamente importantes, pois são os primeiros polens a aparecer em abundância. O aparecimento incipiente desses polens faz com que os pacientes experimentem os primeiros sintomas da estação polínica, que, às vezes, causam o efeito priming, que é o aumento da sensibilidade para outras espécies que florescem mais tarde. Além disso, na família Cupressaceae, são muitas as espécies que mantêm uma polinização de várias semanas. No estudo, existe sensibilidade alérgica a proteínas de Nothofagus, a qual ainda necessita ser determinada20-23.
A ordem Lamiales, que inclui várias subfamílias, é representada pelas Oleaceae, constituídas de variedades de Fraxinus spp (fresno), com alta polinização aérea, mas baixa sensibilidade cutânea. Encontraram-se, aqui, a Olea europae (oliveira) e várias espécies de Ligustrum (ligustro) que representam um grande número de grãos de pólen e acompanham a floração das gramíneas como aquela precoce no início do verão. O ligustro e a oliveira mostraram sensibilização significativa em pacientes alérgicos tanto regional quanto globalmente. A oliveira é importante na região de Bahía Blanca pelo seu uso na produção de azeite e na arborização urbana. O mesmo ocorre na cidade de Mendoza, predominantemente para fins comerciais. A elevada sensibilização ao pólen das oliveiras foi demonstrada na cidade de Bahía Blanca. Em outras cidades, como Rosário e Buenos Aires, o ligustro representa uma prevalência maior em sensibilidade cutânea e pólen aéreo24-27.
A ordem dos Proteales, representada por Platanus spp., é uma espécie abundante nas cidades de Buenos Aires e La Plata, principalmente nas árvores lineares urbanas. Apesar de apresentarem uma quantidade moderada de grãos no ar, mostraram que o pólen provoca maior sensibilidade em pacientes com rinoconjuntivite alérgica em CABA e, na cidade de Londres, é responsável por sintomas alérgicos de moderados a graves. Seu período de polinização (da ordem de duas semanas) pode ser um fator que agrava ou induz a uma maior sensibilização a outros polens, pois parece dar continuidade à floração de freixos e ciprestes28,29.
A ordem Fagales, dentro da família Betulaceae, representantes como Castanea nativa (castanha, Quercus spp. - carvalho) e Alnus spp. (amieiro), possuem períodos de polinização de menos de um mês, e, em alguns casos, somente duas semanas. Portanto, nenhum deles representa um agente causador persistente de rinoconjuntivite, entretanto em pacientes polissensibilizados, devido a reações cruzadas, podem contribuir para a exacerbação dos sintomas alérgicos30.
Poaceae, ou ragmíneas, são os polens mais representativos em estudos aerobiológicos em quase todas as cidades da Argentina, assim como no resto do mundo, onde mostram ser a causa mais comum de alergias sazonais31.
É considerado como sendo a causa mais comum de sintomas de rinoconjuntivite, especialmente no início do verão, causados pela subfamília Pooideae e, a seguir, no final do verão, pela floração das subfamílias Chloridoideae e Panicoideae. A subfamília Chloridoideae está bem representada por Cynodon dactylon, e também por Distichils spicata na cidade de Bahía Blanca, que demonstrou sensibilidade cutânea em pacientes com rinoconjuntivite alérgica. Esta última erva é uma espécie herbácea perene, nativa da América, do Canadá, do Chile e da Argentina. A segunda família, Panicoideae, é representada pelo Paspalum notatum e Sorghum halepense, chamado "elatior" na classificação taxonômica moderna. As espécies das duas últimas subfamílias são chamadas de "subtropicais", possuem fotossíntese e comportamento fenológico diferentes, com floração posterior a das Pooideae, que são chamadas de "temperadas". As gramíneas subtropicais têm um grau significativamente semelhante às gramíneas temperadas. Estudos recentes dessas espécies subtropicais descrevem seus próprios alérgenos que não compartilham com as Pooideae32,33.
Existe uma grande variedade de espécies que não pertencem a árvores e gramíneas, que geralmente é chamada de "grupo de ervas daninhas", ou weeds, em inglês. Esse é um grupo que engloba grande número de gêneros, sendo difícil usar um único nome taxonômico. Nesse grupo, estão as Asteraceae, a família das Angiospermas com maior riqueza e diversidade biológica. Na República da Argentina, são predominantes, especialmente nas regiões pampeana e patagônica, na costa Leste do continente: Salsola Kali , Kochia scoparia , Chenopodium spp, e outras se destacam entre elas.
Em outros países latino-americanos, podem ser listados vários pesquisadores que mostram resultados em contagens aerobiológicas e em estudos de sensibilização cutânea a polens. No Chile, Pedro Mardones demonstrou, em vários estudos, a prevalência de árvores e gramíneas. No Uruguai, existem vários trabalhos multidisciplinares sobre a flora alergógena e pólen aéreo na cidade de Montevideo e Concepción del Uruguay34. No México, há o Centro de Estudos Aerobiológicos que possui vários centros onde monitoram o pólen no ar de diferentes espécies. Deve-se mencionar que esse país latino-americano está localizado no hemisfério norte.
Países como Colômbia, junto com a Venezuela e o Equador, estão localizados no Equador propriamente dito, e têm como patrimônio uma grande diversidade vegetal, a qual está em estudo.
No Paraguai, durante três anos, na cidade de Assunção, um grupo de alergistas formado por Perla Alcaráz, Cinthia Perez, Rosmary Stanley e Pedro Piraino, tem estudado o pólen aéreo e apresentam dados importantes como a presença moderada de grãos de pólen ao longo do ano. Destaca-se, especialmente, o pólen da espécie Cecropia adenopus, que, antes, era classificada como uma árvore das Moraceae, mas, atualmente, está na família Urticaceae. Também chamada de ambay, é uma árvore pertencente à família botânica das Cecropiaceae. Ela cresce nas florestas marginais dos rios do Brasil, na região amazônica da Bolívia e do Paraguai e no Nordeste da Argentina. Pode medir até 15 metros de altura, e seu tronco tem um diâmetro entre 20 e 30 centímetros. O pólen dessa espécie é o mais prevalente em quantidade e frequência, com persistência quase anual. Até o momento, não há estudos sorológicos ou de sensibilidade cutânea.
No Peru, Oscar Calderón tem encontrado pólen em várias cidades, há mais de um ano, cujos resultados serão publicados em breve. Da mesma forma, na Bolívia, recentemente, Fabiola Ramallo passou a monitorar os polens de Santa Cruz de la Sierra. Em pouco tempo, essas publicações deverão ser complementadas com estudos de sensibilidade alérgica aos polens encontrados.
MUDANÇAS CLIMÁTICAS, POLUIÇÃO E CONJUNTIVITE
As conjuntivas oculares são ricamente vascularizadas e estão constantemente expostas a fatores externos. São vulneráveis à influência adversa de bactérias, vírus, alérgenos, produtos químicos e poluentes do ar, que podem causar sua inflamação35. A poluição atmosférica é um dos fatores de risco mais importante que afetam as pessoas em todo o mundo36, sobretudo as mais vulneráveis: crianças e idosos35.
Os olhos são vulneráveis à poluição do ar, seja por exposição aguda, de curto prazo, ou crônica38. Indivíduos que vivem em áreas com alto nível de poluição experimentam sintomas de conjuntivite com mais frequência. Os olhos humanos são protegidos apenas por uma fina camada de filme lacrimal, e as inervações presentes na superfície ocular são muito sensíveis a substâncias químicas ambientais39,40.
Os poluentes atmosféricos incluem: material particulado (PM10, PM2,5), partículas de exaustão de diesel (DEPs), gases (NOx, SO2, O3, CO e oxidantes) além de compostos orgânicos e partículas metálicas8. Nas grandes cidades, a principal fonte de poluentes está relacionada ao tráfego de veículos automotores, e os poluentes dele decorrente (TRAPs) são uma mistura de PM derivados da combustão, DEPs e emissões gasosas, NOx, CO, oxidantes e aerossóis orgânicos41.
O aumento da exposição a concentrações elevadas (> 10 µg/m3) de CO, NO2, SO2, O3 ou PM, seja nos dias anteriores ou no dia de atendimento em unidade de urgência, tem sido acompanhado por aumento significante de atendimentos por conjuntivite, assim como dos sintomas42-47. Além disso, o clima quente e os ventos fortes, aliados à disseminação de alérgenos do pólen, podem potencializar esses efeitos levando à instabilidade da superfície ocular48.
Geralmente as formas mais graves de conjuntivite se associam a maiores danos relacionados à poluição ambiental41. Metanálise recente confirma a poluição do ar como um fator importante de risco para conjuntivite. O NO2 seguido pelo O3 foram os relacionados a maior impacto, sobretudo entre as mulheres menores de 18 anos49.
Fatores meteorológicos (umidade, temperatura) também podem afetar a saúde ocular. À exposição a ambiente controlado com baixa umidade documentou-se sobre o filme lacrimal efeitos adversos na taxa de evaporação, espessura da camada lipídica, estabilidade e produção de lágrimas, gerando desconforto ocular significativo50. Por outro lado, o aumento da temperatura pode não induzir diretamente desconforto nos olhos como a baixa umidade, mas pode levar à exacerbação da conjuntivite alérgica ao elevar os níveis de pólen51.
Relação entre conjuntivite e poluição: mecanismos
Até o momento, os mecanismos fisiopatológicos subjacentes da conjuntivite causada por poluentes atmosféricos ainda não são claros. Como os olhos humanos estão diretamente expostos à poluição do ar, alguns estudos especulam que as partículas de PM2.546,52,53 e PM1054 poderiam facilmente causar a inadaptabilidade das células epidérmicas intraoculares, levando à morte celular e inflamação tecidual49.
Em segundo lugar, NO2 e O3 têm fortes efeitos de estresse oxidativo, que podem estimular a inflamação das células conjuntivais49. O NO2 é um gás ácido, que ao entrar nos olhos, muda facilmente o ambiente das células internas da epiderme ocular, quebra a função das células oculares e causa inflamação55,56. É plausível que a associação entre poluição do ar e o risco de eventos de conjuntivite seja decorrente desses mecanismos potenciais49.
A exposição crônica aos poluentes presentes no ar favorece os danos celulares, como a hiperplasia das células caliciformes do epitélio na superfície ocular57. A exposição aos DEPs aumenta a expressão de citocinas, quimiocinas e fatores de crescimento nas células do epitélio da conjuntiva, o que significa ativação da inflamação conjuntival39.
Todos esses poluentes podem danificar diretamente a superfície ocular pela redução do pH do líquido lacrimal ou por sua oxidação. Além disso, o PM10 pode causar respostas desreguladas das células T e inflamação41, e estar significativamente associado à contagem reduzida de células Tregs, como demostrado em estudo de coorte de nascimentos58.
Doenças associadas à poluição do ar
As condições associadas à poluição do ar são principalmente: irritação ocular, desconforto, conjuntivite, síndrome do olho vermelho e disfunção da glândula meibomiana.
Síndrome do olho seco
A síndrome do olho seco (SOS) é a condição oftalmológica mais comum59 e tem frequência de 11% a 58%. Muitos fatores podem ter influência na ocorrência de sintomas de SOS: fumar, consumir álcool, baixa umidade, poluição do ar, exposição à luz solar, fatores sociodemográficos, cirurgias oftalmológicas no passado e uso de lentes de contato (neste grupo a influência da poluição do ar é mais perceptível)60.
Entre indivíduos moradores em grandes cidades, distúrbios de filme lacrimal ocorrem com maior frequência61. Estudo realizado no Brasil mostrou associação entre a exposição à alta concentração de NO2 e distúrbios do filme lacrimal, além de sensação de desconforto ocular40.
Disfunção da glândula meibomiana
As glândulas meibomianas são glândulas sebáceas, cuja excreção é o componente mais externo do filme lacrimal e evita que as lágrimas evaporem da superfície do olho. Os sintomas relatados por pacientes com disfunção das glândulas meibomianas (DGM) são: prurido ocular, sensação de desconforto, sensação de olhos secos e vermelhidão dos olhos. A DGM é uma das causas mais comuns de SOS.
Muitos fatores influenciam os distúrbios da função das glândulas, entre outros: blefarite crônica, uso de lentes de contato, síndrome de Sjögren, acne rosácea, umidade e qualidade do ar57, principalmente as altas concentrações de NO240.
Blefarite
Blefarite é um estado inflamatório que cobre as bordas e a pele das pálpebras, glândulas do tarso e folículos dos cílios. A causa da blefarite é mecânica (por exemplo: por poeira, fumaça), e também por infecção bacteriana. A conexão entre a blefarite e a poluição do ar não é bem examinada. Estudo realizado no Brasil demostrou correlação significante entre exposição a altas concentrações de PM10 e CO no ar e aumento da incidência de blefarite, no dia da exposição62.
Influência sobre a córnea
A córnea está constantemente exposta a fatores externos, como poluentes atmosféricos, radiação ultravioleta e fumaça de cigarro. O estresse oxidativo, que é um efeito desses fatores, favorece os danos à córnea e a deficiência visual. As concentrações de PM2,5 entre 20 µg/mL e 200 µg/mL é genotóxico, estimula danos ao DNA e diminui a eficiência das células do epitélio corneano52.
Catarata
A frequência da catarata é maior nos países em desenvolvimento, e os fatores que auxiliam a sua formação são: idade, sexo, tabagismo ativo, exposição à radiação ultravioleta e diabetes. Indivíduos expostos à queima doméstica de biomassa (carvão, madeira, fezes de animais), sobretudo para cocção de alimentos, apresentaram maior frequência de catarata, principalmente entre as mulheres63. No caso do uso de fogões movidos a gás liquefeito de petróleo ou biogás, o risco de catarata foi muito menor. A falta de ventilação na cozinha foi um fator de risco independente para catarata64.
Influência na microcirculação na retina
A poluição do ar tem sido identificada como um fator de risco independente para o desenvolvimento e progressão da doença cardiovascular, todavia a sua influência sobre a microcirculação ainda é pouco estudada. Comparativamente às mudanças da macro e da microcirculação coronariana, justifica-se lesões patológicas nos vasos da retina, indicativos de arteriosclerose.
Estudo brasileiro avaliou a associação entre poluição do ar e o estreitamento dos vasos na retina e demonstrou estreitamento do equivalente arteriolar central da retina (CRAE) em 0,8 µm em resposta à exposição crônica (2 anos) a PM2,5 (3 µg/m3) em mais de 4.500 indivíduos65. À exposição aguda, no dia prévio à avaliação, a concentração mais elevada de PM2,5 (7 µg/m3) determinou estreitamento do CRAE em 0,4 µm. Louwies e cols.66 mediram o diâmetro dos vasos retinais em 85 indivíduos saudáveis e avaliaram como a exposição de curto prazo ao PM10 e poeira de carbono os afeta. O estreitamento da CRAE em 0,93 µm e o estreitamento do equivalente venular central da retina (CRVE) em 0,86 µm foi observado a cada 10 µg/m3 de aumento da concentração de PM10.
Essas descobertas chamam a atenção para o fato de que não apenas a exposição crônica, mas também a de curto prazo aos poluentes atmosféricos causa anormalidades na microcirculação da retina, podendo causar distúrbios na nutrição e oxigenação da retina, o que pode levar à deficiência visual. Os distúrbios da microcirculação retiniana também podem impactar em incidentes cardiovasculares no futuro38.
COMORBIDADES
A CA pode ter impacto significativo na qualidade de vida, afetando o sono e causando problemas emocionais e comprometimento de atividades da vida diária ou social, como produtividade no trabalho ou desempenho escolar. A CA ocorre concomitantemente com a rinite alérgica (RA) e outras doenças alérgicas na maioria dos pacientes, pelo menos 60% dos pacientes com conjuntivite alérgica podem ter rinite67. Os sintomas oculares também podem estar presentes sem envolvimento nasal em 2 a 7% dos pacientes com CA68,69. Asma e dermatite atópica são outras comorbidades comuns. Em adolescentes, a maioria dos dados epidemiológicos, incluindo dados de diferentes fases do Estudo Internacional de Asma e Alergias na Infância (ISAAC), associam os sintomas oculares aos nasais, dificultando a separação da prevalência de CA da rinite alérgica.
Um estudo realizado em Xangai analisou a prevalência de sintomas de alergia ocular, rinite alérgica, asma, dermatite atópica e sensibilização a ácaros, pólen e alimentos em uma população de crianças e adolescentes. A prevalência geral de sintomas de RA, asma diagnosticada e dermatite atópica diagnosticada foi de 40,4%, 11,6% e 16,7%, respectivamente. Crianças pequenas tiveram uma prevalência maior de diagnóstico de rinite alérgica e dermatite atópica do que adolescentes. Houve diferenças associadas ao gênero na prevalência de rinite alérgica e asma entre crianças pequenas, mas não entre adolescentes. A sensibilização a ácaros, alimentos e pólen foi associada a uma maior prevalência de doenças alérgicas70.
Uma pesquisa conduzida pelo American College of Allergy, Asthma and Immunology descobriu que 35% das famílias entrevistadas tiveram alergias, das quais mais de 50% relataram sintomas oculares associados71. A importância da CA se deve principalmente à sua frequência, que varia de 5% a 22% da população72.
Estudo realizado por Geraldini M. e cols., que incluiu 3.120 pacientes entre 12 e 18 anos, obteve prevalência de sintomas de conjuntivite alérgica de 20,7%. Pelo menos uma comorbidade (asma, rinite ou eczema atópico) foi relatada por 75,3% das crianças com CA. Rinite foi a comorbidade mais frequente (64,6%). A asma apareceu em 31,4%, e eczema atópico em 13,1%. O percentual de crianças com nenhuma, uma, duas ou três comorbidades relacionadas à conjuntivite alérgica, foi 24,7%, 44,7%, 27% e 3,6%, respectivamente. Aqueles pacientes com sintomas perenes foram mais frequentemente associados às três comorbidades em comparação com aqueles com sintomas sazonais (66,7% versus 56,9%; p = 0,034), enquanto asma e eczema tópico não diferiram entre os dois grupos (33,1% versus 24,8%; p = 0,062) e (12,3% versus 16%; p = 0,25), respectivamente. A probabilidade de um adolescente com CA apresentar asma, rinite e eczema atópico foi (OR = 5,7; IC 95%: 4,5 a 7,1); (OR = 3,6, IC 95% 3,0 a 4,3) e (OR = 2,6, IC 95% 2,0 a 3,5), respectivamente. A associação entre asma e CA foi maior entre aqueles com CA e rinite do que entre aqueles com CA isolada (36,8% versus 20,5%; p < 0,01)1.
CLASSIFICAÇÃO DA CONJUNTIVITE ALÉRGICA
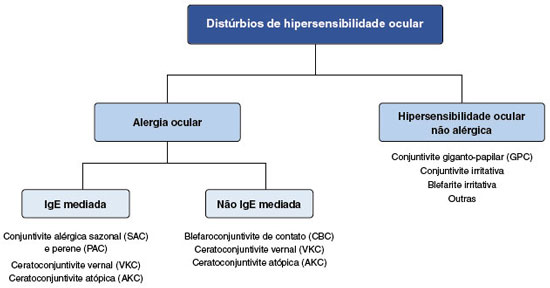
Até à data, já foram propostos vários métodos e nomenclaturas para classificar as diferentes formas de hipersensibilidade ocular, sendo a classificação mais aceita e utilizada e adotada pela European Academy of Allergy and Clinical Immunology (EAACI)73, que engloba dois grupos: hipersensibilidade ocular não alérgica e alergia ocular, que por sua vez, se subdivide em formas mediadas pela IgE - como a conjuntivite alérgica sazonal (CAS) e perene (CAP) e a mais de metade dos casos de queratoconjuntivite vernal (VKC) e atópica (AKC) - e formas não IgE mediadas, que incluem alguns casos das últimas duas formas, bem como a blefaroconjuntivite de contacto (CBC) (Figura 2).
Os diferentes distúrbios de hipersensibilidade ocular vão desde situações ligeiras, geralmente intermitentes e com sintomas agudos (CAS, CAP e CBC) até formas moderadas a graves, geralmente crônicas e que podem afetar a visão (conjuntivite giganto-papilar, VKC e AKC).
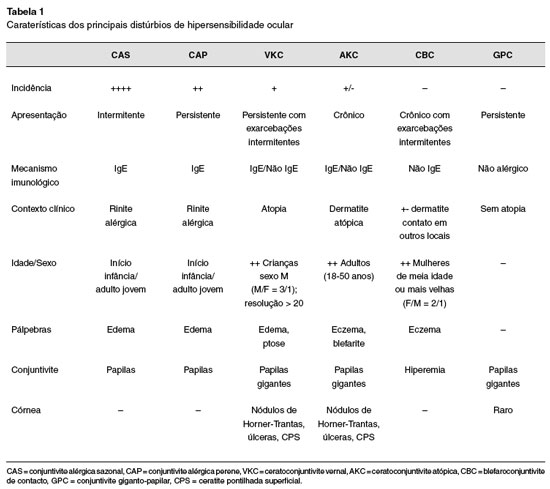
As principais caraterísticas diferenciadoras dos diferentes distúrbios de hipersensibilidade ocular encontram-se sumariadas na Tabela 1.
Conjuntivite alérgica
A conjuntivite alérgica é a forma de alergia ocular mais frequente e envolve mecanismos IgE mediados, originando sintomas oculares bilaterais que se associam habitualmente à presença de rinite. O sintoma mais característico é o prurido ocular, podendo também ocorrer com frequência queixas de lacrimejo, hiperemia conjuntival, edema palpebral e ligeira hipertrofia papilar da conjuntiva tarsal73. O envolvimento da córnea é raro, mas pode ocorrer visão turva8.
Consoante à periodicidade dos sintomas, subdivide-se em conjuntivite alérgica sazonal (CAS) e conjuntivite alérgica perene (CAP).
Na CAS os sintomas são intermitentes e mais prevalentes na primavera e outono, quando os níveis de polens são mais elevados. Na CAP os sintomas são persistentes e surgem relacionados com a exposição e sensibilização a alergênios peranuais, tais com os ácaros do pó, faneras e fungos ou devido à presença de múltiplas sensibilizações.
Ceratoconjuntivite vernal
A ceratoconjuntivite vernal (VKC) corresponde a uma forma de alergia ocular rara, persistente e grave, que ocorre principalmente em zonas com clima quente, tais como a bacia do Mediterrâneo, Norte da África e Oriente Médio. É tipicamente sazonal (primavera até ao fim do verão) e acomete com maior frequência crianças do sexo masculino (ratio sexo masculino/feminino 3/1), com idades compreendidas entre os 4-12 anos, desaparecendo após a puberdade. Aproximadamente 50% dos doentes não apresenta história de doença atópica ou sensibilização alérgica, o que sugere que a VKC não é uma patologia totalmente IgE mediada8.
O primeiro sintoma a surgir é o intenso prurido ocular bilateral, habitualmente desencadeado por estímulos não específicos como o vento, poeira, luz forte ou esforço físico, ao qual se segue extrema fotofobia, queimor e sensação de corpo estranho e, muitas vezes, visão turva. Observa-se injeção conjuntival, ptose, secreção mucosa e cremosa e blefarospasmo.
Existem três formas major de doença: tarsal, límbica e mista. Nos países ocidentais a forma tarsal é a mais frequente, enquanto que nos países subtropicais predomina a forma límbica, também conhecida como limboconjuntivite endêmica tropical. A forma tarsal é caraterizada pela presença de papilas gigantes (entre 7 a 8 mm de diâmetro) na conjuntiva tarsal superior que se assemelham a pedras de calçada (coblestones), infiltradas por fibrina e muco (pseudomembrana). Na forma límbica ocorrem papilas límbicas com excrescências brancas nos ápices, com um aspecto gelatinoso - nódulos de Horner-Trantas. Surge envolvimento corneano: ceratopatia punctiforme ou úlcera redonda "em escudo", e há uma alta incidência de ceratocone nestes doentes, podendo os casos mais graves originar cegueira.
Ceratoconjuntivite atópica
A ceratoconjuntivite atópica (AKC) é uma patologia ocular inflamatória crônica, com atingimento bilateral em nível das pálpebras, conjuntiva e possivelmente da córnea. Corresponde à entidade com maior risco de cegueira e ocorre em adultos (18-50 anos) que apresentam manifestações sistêmicas de atopia, nomeadamente dermatite atópica. A sua prevalência nos doentes com dermatite atópica varia entre os 20% e 77%, e corresponde a uma das complicações oftalmológicas mais graves da dermatite atópica. Geralmente há história familiar de outras doenças atópicas com níveis elevados de IgE sérica. Na sua patogênese estão envolvidos mecanismos IgE mediados, Th2 e Th1. Ao contrário da VKC, que raramente ultrapassa os 5-10 anos de evolução, a AKC pode durar décadas.
Clinicamente é semelhante à conjuntivite vernal, com formação de papilas (menores) no tarso superior. Um sinal caraterístico é o eczema no nível palpebral que tende a endurecer e fissurar, estando as pálpebras frequentemente inflamadas, maceradas e com crostas - blefarite crônica. Pode associar-se à colonização palpebral por Staphylococcus aureus e disfunção da glândula meibomiana. O desenvolvimento de queratopatia com neovascularização é particularmente grave, e, com relativa frequência, complica-se por cataratas, herpes simples, queratocone, blefarite crônica, fibrose conjuntival e descolamento da retina, com deterioração sustentada da visão.
Blefaroconjuntivite de contacto
A blefaroconjuntivite de contacto (CBC) é uma forma de alergia ocular não IgE-mediada em que ocorre dermatite de contacto no nível das pálpebras, com ou sem dermatite extraocular e com possível atingimento da conjuntiva. Frequentemente afeta mulheres de meia-idade ou mais velhas9.
Surge associada ao uso repetido de medicação ocular "conjuntivite medicamentosa", por toxicidade ou sensibilização de contacto aos constituintes dos medicamentos, habitualmente os conservantes. Além dos constituintes e conservantes dos tópicos oculares, também vários produtos de cosmética e metais podem estar envolvidos como agentes causais. Os cosméticos aplicados no cabelo, na face ou nas unhas podem ser inadvertidamente transferidos para os olhos, provocando sensibilização, por vezes sem qualquer sintoma no ponto de origem, onde a epiderme é mais espessa.
Os sintomas mais frequentes são prurido e sensação de queimor palpebral, com detecção ao exame físico de edema, eritema, eczema ou liquenificação na pele palpebral, hiperemia conjuntival e papilas.
Hipersensibilidade ocular não alérgica
A hipersensibilidade ocular não alérgica inclui várias entidades, nomeadamente a conjuntivite giganto-papilar (GPC), conjuntivite irritativa, blefarite irritativa, entre outras.
Conjuntivite papilar gigante
A conjuntivite papilar gigante (GPC) surge no contexto de hipersensibilidade não alérgica a produtos que contactem de forma crônica com a superfície ocular, mais frequentemente lentes de contacto e seus produtos de limpeza e conservantes, próteses oculares ou suturas pós-operatórias. O mecanismo envolvido relaciona-se com o trauma mecânico crônico.
Clinicamente assemelha-se a outras formas de hipersensibilidade ocular, podendo originar sintomas de prurido ocular, sensação de corpo estranho, visão turva e produção de secreções mucosas. Por vezes verifica-se agravamento dos sintomas na época da primavera. O doente desenvolve uma reação papilar na pálpebra superior (com ou sem queratopatia), que é mais comum com o uso de lentes de contacto macias (5-10%) em comparação com as rígidas (4%).
Habitualmente a GPC resolve com a interrupção do uso de lentes de contacto ou quando há remoção do corpo estranho que está em contacto com a superfície ocular.
DIAGNÓSTICO DA CONJUNTIVITE ALÉRGICA
Testes sorológicos e cutâneos na avaliação da alergia ocular
O diagnóstico das diferentes conjuntivites é clínico. A etiologia é determinada por pesquisa de IgE específica para aeroalérgenos. Teste in vivo, teste cutâneo alérgico ou de puntura, deve ser realizado por profissional treinado, sendo de fácil realização, baixo custo, alta sensibilidade e especificidade. Identifica-se IgE específica para ácaros, polens, epitélios de animais, baratas e fungos. A pesquisa de IgE específica no soro, in vitro, também pode ser utilizada para identificação de alergia aos mesmos aeroalérgenos que o teste cutâneo. Mais recentemente, foram desenvolvidas plataformas simples ou múltiplas de detecção de IgE para proteínas específicas das fontes de alérgenos, chamados de componentes, e isto tem nos aproximado à Medicina de Precisão. Há necessidade de laboratório especializado, custo maior, mas também com boa sensibilidade e especificidade74.
Os testes cutâneos de punctura (prick tests) ainda são a principal ferramenta no diagnóstico do fenótipo alérgico da doença das vias aéreas na prática diária do alergista. A IgE sérica total, por sua vez, parece estar correlacionada com a complexidade do repertório de IgE75, e a IgE sérica específica é muito útil na população pediátrica e como complemento ou substituição aos testes cutâneos76.
Contudo, a vasta maioria dos testes diagnósticos e extratos para vacinas disponíveis comercialmente usam alérgenos na fase sólida, obtidos da fonte original, através da extração e purificação proteica. A disponibilidade de um painel amplo de moléculas alergênicas recombinantes ou altamente purificadas para diagnóstico in vitro modificou profundamente o conhecimento básico na área, mas também as condutas na prática clínica77. Além disso, atualmente é possível definir o repertório de IgE do paciente usando essas moléculas alergênicas espécie-específicas e de retividade cruzada78. Isso se tornou uma brilhante solução, particularmente nos pacientes ditos "polissensibilizados", e não apenas na alergia alimentar ou a himenópteros, mas também na alergia respiratória76. Até o presente momento, há poucos dados na literatura a respeito do uso do diagnóstico resolvido por componentes (CRD), particularmente, com a tecnologia multiplex, nas doenças alérgicas das vias aéreas superiores (RA e conjuntivite alérgica), em especial com relação aos chamados "alérgenos perenes", como ácaros, fungos e epitélios de animais. Nessa seção, revisaremos as publicações disponíveis sobre CRD na rinoconjuntivite alérgica (RCA), particularmente estudos sobre perfil de sensibilização nesses pacientes, o que há de dados divididos por fontes de alérgeno, e algumas novidades sobre métodos que podem auxiliar na abordagem das conjuntivites mais graves através da detecção de IgE específica na lágrima.
Perfil de sensibilização em pacientes com rinoconjuntivite
Conforme já destacamos, a literatura é escassa em relação à RCA, em particular no que diz respeito ao perfil de sensibilização dessa população utilizando esse método. Duas casuísticas em populações asiáticas publicadas recentemente avaliaram a técnica multiplex de detecção de IgE por componentes em pacientes atópicos e a compararam com os tradicionais testes cutâneos ou o método FEIA79,80.
No estudo de Singapura, avaliou-se atópicos com RA, asma e DA e verificou-se que a sensibilização a ácaros foi associada ao fenótipo RA, enquanto asma e DA não tiveram predominância de um único Ag. Além disso, o ISAC não se mostrou útil como ferramenta de triagem caso a suspeita maior (clínica ou epidemiológica) fosse de monossensibilização80. No levantamento realizado na Coreia, mostrou-se que a concordância entre ISAC e FEIA é bastante elevada para os ácaros Dermatophagoides, mas o mesmo não ocorreu com os polens de bétula e com o fungo Alternaria alternata, para os quais a sensibilidade do FEIA foi superior ao ISAC79.
Em uma coorte britânica de nascidos vivos, reavaliados na idade de 11 anos, utilizou-se a técnica multiplex para avaliar os padrões de sensibilização e sua relação com as doenças atópicas apresentadas pelas crianças. Encontrou-se que crianças com rinoconjuntivite eram mais sensibilizadas a ácaros e polens, enquanto as asmáticas eram sensibilizadas, não só a essas duas fontes de Ag, mas também a epitélios de animais. Por fim, as portadoras de eczema eram mais sensibilizadas ao ovo e Ag bovinos81.
Um estudo em atletas de elite participantes das Olimpíadas de Pequim avaliou 72 indivíduos polissensibilizados (definidos com base em resultados de testes cutâneos) utilizando o método ImmunoCAP-ISAC. Os atletas foram classificados em quatro grupos de acordo com o quadro clínico apresentado: rinoconjuntivite alérgica, asma, alergia alimentar e assintomáticos. Além de se mostrar útil para diferenciar os verdadeiros polissensibilizados daqueles com testes positivos por Ag de reatividade cruzada, o método confirmou que o fenótipo rinoconjuntivite era mais associado à monossensibilização, ao passo que asmáticos eram mais frequentemente polissensibilizados82.
Em um estudo retrospectivo realizado na porção ocidental da República Tcheca, utilizando plataforma multiplex ImmunoCap-ISAC(r) para detecção de IgE específica, foram analisados os resultados de 1.331 pacientes atendidos entre dezembro de 2011 e junho de 2013. Observou-se que em 826 pacientes com mediana de idade de 32,6 anos, as amostras foram positivas para pelo menos um componente derivado de pólen, sendo 62% deles com diagnóstico de rinite. O maior índice de sensibilização foi aos componentes de gramíneas (81%), sendo o Phl p 1 (69,6%) o mais frequente, seguido dos componentes derivados de Betulaceae (54,8%), onde o Bet v 1 (54,2%) foi o mais prevalente. Sensibilização aos componentes derivados de Cupressaceae (14,1%), Oleaceae (10,8%) e de árvores Pla a 2 (15,5%), foram menos prevalentes83.
Em estudo com 120 pacientes atópicos com rinoconjuntivite e/ou asma, foi comparada a técnica de microarray (ISAC CRD 103) com FEIA (ImmunoCap) para o diagnóstico de alergia aos polens de gramíneas e cipreste. Ambos microarray e Cap apresentaram elevada sensibilidade (S) e especificidade (E) na detecção de alergia a gramíneas (ISAC: S = 97,7% e E = 92,3%; Cap: S = 95,3% e E = 96,1%) apresentando concordância entre as duas técnicas. Na detecção de alergia ao cipreste, o ISAC apresentou sensibilidade semelhante ao Cap, mas especificidade superior (ISAC: S=91,7% e E=91,3%; Cap: S=91,7% e E=80,4%, p=0,034)84.
Na Coreia do Sul, foram avaliados 168 pacientes adultos com rinite alérgica e comparou-se a detecção de IgE específica por ImmunoCap e ImmunoCap-ISAC(r) para polens de bétula e artemísia, entre outros aeroalérgenos. A sensibilidade por ImmunoCap para bétula foi de 86,9% contra 43,6% por ImmunoCap-ISAC(r), k = 0,511. No caso da artemísia, a sensibilidade por ImmunoCap foi de 92,3% contra 69,2% por ImmunoCap-ISAC(r), k = 0,67079.
Em estudo de 101 adultos com rinoconjuntivite na Alemanha, comparou-se a detecção de IgE específica para 8 componentes de gramínea (rPhl p 1, rPhl p 2, nPhl p 4, rPhl p 5b, rPhl p 6, rPhl p 7, rPhl p 11 e nPhl p 4) plataforma simples e multiplex, ImmunoCap e ImmunoCap-ISAC(r). O coeficiente de correlação foi significativo em sete componentes [0,88 (rPhl p 1), 0,96 (rPhl p 2), 0,70 (nPhl p 4), 0,94 (rPhl p 5b), 0,92 (rPhl p 6), 0,85 (rPhl p 11), e 0,78 (rPhl p 12)], sendo a exceção para o rPhl p 785.
Em Curitiba, 101 crianças com rinite alérgica realizaram teste cutâneo para o pólen de Lolium multiflorum, entre outros aeroalérgenos e dosagem de IgE específica por plataforma multiplex ImmunoCap ISAC versão 103. A sensibilização alérgica ao pólen de Lolium multiflorum determinada por teste cutâneo alérgico foi de 14,9%, já a sensibilização aos componentes de gramíneas mais frequentes foram Cyn d 1 em 16,8%, Phl p 1 e Phl p 4 em 14,8% e 12,9%, respectivamente86.
Aplicação clínica dos componentes na conjuntivite
Conforme já citado, o uso do chip multiplex na RCA com relação à sensibilização aos ácaros da poeira, tanto Dermatophagoides como Blomia tropicalis, mostrou acurácia comparável ao FEIA e testes de punctura. Além desses dados, mostrou-se que os componentes Der p 1 e Der p 2 se correlacionam com atopia e níveis séricos de IgE anti-Der p, diferentemente dos componentes Der p 10 e MUXF3 (bromelina)87,88. Outra aplicação do ImmunoCAP-ISAC em relação à sensibilização aos ácaros foi demonstrada num estudo francês publicado em 2012, no qual mostrou-se que a imunoterapia sublingual com extrato de Dermatophagoides pteronyssinus + farinae por um ano não induziu nova sensibilização aos três alérgenos do Der p (1, 2 e 10).
Em relação à sensibilização a fungos, não há estudos particularmente realizados em RCA utilizando a técnica microarray multiplex. Um estudo retrospectivo em crianças com RCA ou asma comparou o componente Alt a 1 dosado pelo método FEIA e a fonte de alérgeno Alternaria, e mostrou que a acurácia de ambos é bastante comparável, permitindo que qualquer um pudesse ser usado para diagnóstico dessa sensibilização89.
Por mais que os alérgenos de animais ditos "peludos" estejam mais associados à asma, há alguns dados publicados em relação à RCA e uso da técnica multiplex. O principal fato a ser conhecido pelo médico assistente ao paciente exposto ou sensibilizado a animais domésticos, particularmente cão e gato, é a de que as albuminas (exemplos Fel d 2, Can f 3) são proteínas que não acarretam sintomas e têm reatividade cruzada entre si, ao passo que as lipocalinas (Can f 1 e Can f 2) e secretoglobinas (Fel d 1) são associadas à reatividade clínica e não têm mimetismo molecular. Nesse contexto, foi sugerido que o ImmunoCAP-ISAC poderia ser indicado com vistas a diferenciar sensibilização de alergia, ou mesmo para avaliar indivíduos de maior risco para futura reatividade de acordo com o grau de exposição90. Nessa mesma linha, um estudo sueco de coorte recentemente publicado mostrou que os componentes Fel d 1 e Can f 1 documentados pelo chip multiplex eram melhores preditores da evolução da alergia ao longo do tempo do que os extratos de gato e cão91.
A plataforma multiplex tem sido utilizada na detecção de sensibilização precoce para componentes de polens e posterior desenvolvimento de rinite alérgica. Em uma coorte de nascimento alemã, seguida até os 13 anos de idade, foi aplicado questionário e coletado amostra de sangue de 820 crianças aos 1, 2, 3, 5, 6, 7, 10 e 13 anos. Diagnóstico de rinite alérgica sazonal relacionada ao polén foi realizado de acordo com sintomas nasais. Anticorpos IgE específicos para Phleum pratenses e 8 componentes foram realizados por FEIA e plataforma multiplex. Cento e setenta e sete desenvolveram rinite alérgica sazonal. A sensibilização ao Phl p 1 foi precoce e a mais comum (78%)92 nas crianças com rinite alérgica. A sensibilização aos 3 anos prediz a rinite alérgica aos 12 anos, VPP = 68% e VPP = 84%93. Em outro estudo em crianças que utilizou plataforma multiplex para detecção de IgE específica, foi avaliado o soro de 764 indivíduos para investigação da patogênese de IgE positiva para proteínas da família PR-10 e rinite alérgica à bétula aos 16 anos. Questionário e soro foram coletados aos 4, 8 e 16 anos de crianças em Estocolmo, e realizado ImmunoCap-ISAC. O risco de persistência de rinite alérgica ao Bet v 1 aos 16 anos foi oito vezes maior (OR = 8,2) quando a criança apresentava uma sensibilização a PR-10 aos 4 anos.
Detecção de IgE específica na lágrima
Dois estudos recentes utilizaram a técnica multiplex microarray de detecção dos componentes alergênicos na lágrima em pacientes com alergia ocular, sendo um deles um relato de caso94 e o outro artigo uma série de 10 pacientes com ceratoconjuntivite vernal95. Ambos mostraram que a IgE específica por componentes é quantificável pelo método ISAC na lágrima e pode diferir dos resultados da IgE específica sérica. Esses dados sugerem que, num futuro próximo, os CRD em secreções possam ser incorporados e colaborar no diagnóstico etiológico das doenças alérgicas, particularmente aquelas de difícil definição, como a ceratoconjuntivite vernal, por exemplo.
Teste de provocação conjuntival com alérgenos
O teste de provocação conjuntival com alérgenos (TPCA) é uma ferramenta diagnóstica para investigar as doenças de hipersensibilidade da superfície ocular externa mediadas por IgE, avaliando os efeitos inflamatórios causados pela aplicação conjuntival do alérgeno em um indivíduo previamente sensibilizado96. O objetivo do teste é reproduzir com precisão os sinais e sintomas (prurido ocular, hiperemia conjuntival, lacrimejamento, quemose e edema conjuntival/palpebral) de conjuntivite alérgica (CA). A hiper-reatividade conjuntival específica ao alérgeno (HRCe) desencadeada pelo TPCA é uma cascata de eventos inflamatórios típicos de uma hipersensibilidade mediada por IgE, que afeta a mucosa conjuntival de indivíduos previamente sensibilizados ao alérgeno testado e geneticamente predispostos. TPCA positivo provoca no olho testado os mesmos sinais e sintomas de CA que ocorrem durante a exposição natural ao alérgeno. Ao desencadear HRCe, o TPCA confirma o alérgeno testado como o fator etiológico da alergia ocular97.
Provocações conjuntivais com grãos de polens para diagnosticar polinose (hay fever) e mensurar a tolerância do paciente durante experimentos de dessensibilização com extratos de polens foram realizadas por Blackey, em 1873. Até a década de 1970, TPCA foi utilizado principalmente para fins diagnósticos, mas atualmente também tem sido empregado para o estudo da fisiopatologia da CA, avaliação de eficácia de medicamentos tópicos oculares e de imunoterapia alérgeno-específica98. Outra indicação do TPCA é como um teste alternativo para avaliar a reatividade mucosa em outras doenças alérgicas mediadas por IgE, como a rinite, a asma, a alergia alimentar e a alergia ao látex99.
Recentemente, uma publicação do Grupo de Interesse em Alergia Ocular da EAACI reuniu recomendações para a prática clínica do TPCA99.
Quando realizar
A maioria dos casos de alergia ocular é de conjuntivite benigna, mediada por IgE, de evolução intermitente (conjuntivite alérgica sazonal) ou persistente (conjuntivite alérgica perene), para os quais uma causa alérgica deve ser sempre pesquisada. A identificação dos aeroalérgenos é geralmente realizada pelos testes cutâneos de leitura imediata por puntura (TCA) ou pela dosagem sérica de IgE-específica ao alérgeno (S-IgE) total ou aos seus componentes moleculares100.
TCA e dosagem de IgE sérica ao alérgeno mostram boa correlação com TPCA. Abelson e cols.97 observaram 84% de TPCA positivos em 396 indivíduos com TCA positivo e história sugestiva de CA, sugerindo o uso rotineiro do teste cutâneo alérgico como ferramenta diagnóstica para alergia ocular. Reatividade ao mesmo alérgeno que apresentou TCA positivo foi detectada pelo TPCA em 94% dos indivíduos com queixas oculares, o que demonstra alto valor preditivo positivo do TCA em prever uma provocação conjuntival positiva ao alérgeno, quando existe história clínica sugestiva101.
Entretanto, TCA positivo e S-IgE elevada indicam apenas sensibilização a um alérgeno específico. Leonardi e cols.102 encontraram concordância de 81% de resultados positivos de TCA e S-IgE ao mesmo alérgeno com TPCA positivo. Nos casos em que não havia concordância, houve maior positividade dos testes cutâneos e/ou sorológicos (23%) em relação às provocações oculares (6%). Assim, o uso de testes cutâneos e sorológicos, sem comprovação por provocação ocular, poderia levar a um aumento no número de casos falso positivos de CA. É importante ressaltar que sensibilização sistêmica pode ocorrer sem alergia clínica, e sintomas locais podem ocorrer sem evidência de sensibilização sistêmica. Em outro estudo, correlação significativa de níveis lacrimais elevados de IgE-especifica ao alérgeno ocorreu apenas com provocação conjuntival positiva, e não com TCA e S-IgE. Estes achados sugerem a possibilidade da conjuntiva ser o único órgão alvo sensibilizado em indivíduos alérgicos103.
Para fins diagnósticos, TPCA é o único método que confirma uma resposta conjuntival específica a um alérgeno suspeito pela história clínica nos casos de CAS e, principalmente, de CAP.
O TPCA está particularmente indicado quando a sensibilização não é concordante com a história clínica, quando um paciente é polissensibilizado ou quando os testes cutâneos ou sorológicos são negativos ou contraditórios, apesar de história médica fortemente sugestiva que um alérgeno específico esteja envolvido na patologia ocular. Para CAS e PAC, a detecção do alérgeno mais relevante é fundamental antes de se iniciar imunoterapia alérgeno-específica99.
Na ceratoconjuntivite vernal (CCV), o TPCA não é prática rotineira, sendo usado para identificar alérgenos para imunoterapia nos casos resistentes a tratamento medicamentoso104.
O TPCA também é muito utilizado para o estudo da fisiopatologia das diversas formas de alergia ocular, para a coleta de células, dosagem de mediadores químicos, citocinas e outros biomarcadores inflamatórios105.
Outra indicação do TPCA é para o seguimento de imunoterapia alérgeno-específica e para a avaliação do efeito antialérgico de medicamentos tópicos para o tratamento da CA, sendo um método reconhecido pela Food and Drug Administration (FDA) para essas finalidades106.
Existem alguns estudos do uso de TPCA para confirmar alguns casos de alergia ocupacional ao látex e alergia alimentar. Em uma população de 174 crianças com suspeita de alergia alimentar a leite de vaca, ovo, amendoim e peixe, TPCA negativo excluiu alergia alimentar clínica, independentemente do valor da IgE sérica ao alérgeno. Da mesma forma, TPCA positivo confirmou alergia alimentar mediada por IgE107.
Recomendações práticas para a realização do TPCA
Antes da provocação conjuntival, os pacientes devem estar assintomáticos, sem conjuntivite ou rinite em atividade e asma instável. O TPCA deve ser evitado em indivíduos com história de cirurgia ocular e patologias oculares infecciosas e inflamatórias recentes (< 6 meses), gestantes e nutrizes, imunodeficiências, neoplasias, insuficiência hepática ou renal, doenças autoimunes, doenças cardiovasculares em uso de betabloqueadores ou que podem descompensar, caso seja necessária a aplicação de adrenalina para o tratamento de possível reação anafilática100.
Exame oftalmológico completo deve ser realizado antes da provocação para afastar qualquer inflamação conjuntival, sendo imprescindível nos casos de conjuntivite crônica, quando a presença do oftalmologista durante a provocação ocular, além do alergista, é necessária. O exame da conjuntiva para a detecção de quemose leve visível apenas à lâmpada de fenda pode evitar que doses altas de alérgenos sejam utilizadas durante a provocação, e assim, evitar o aparecimento de reação de fase tardia, que poderia causar exacerbação grave da conjuntivite crônica99.
Não há recomendação para a realização de TPCA em patologias da superfície ocular que não são causadas por hipersensibilidade mediada por IgE, como ceratoconjuntivite sicca, blefarite e blefaroconjuntivite, conjuntivite papilar gigante decorrente de intolerância a lentes de contato ou corpo estranho, blefaroconjuntivite de contato com suspeita de alergia a conservantes de colírios, medicamentos e cosméticos96.
O TPCA não pode ser realizado durante o período de exposição natural ao alérgeno, como por exemplo, durante a polinose97.
Medicamentos tópicos oculares e orais que podem interferir no resultado da reação conjuntival devem ser descontinuados antes do TPCA. Anti-histamínicos H1, estabilizadores de mastócitos e corticoides tópicos oculares devem ser interrompidos por pelo menos dois dias antes da provocação. Para ciclosporina e anti-inflamatórios não hormonais tópicos, o período de interrupção é por pelo menos uma semana. Anti-histamínicos orais devem ser suspensos uma semana antes do TPCA (três semanas para o cetotifeno), corticoides orais por duas semanas e antileucotrienos por três semanas.
Como em outros tipos de provocação in vivo, o Termo de consentimento informando os riscos e benefícios do TPCA deve ser fornecido, discutido e assinado pelos pacientes ou responsáveis legais antes da provocação conjuntival. TPCA pode ser realizado em crianças e adultos, mas exige cooperação e entendimento do procedimento para resultado confiável96,99.
O local para a realização do TPCA (consultórios e hospitais) deve contar com estrutura para o tratamento de possíveis efeitos adversos graves, como exacerbação de asma, urticária aguda e anafilaxia. Medicação de resgate, como anti-histamínico H1 e corticoide tópicos e sistêmicos, broncodilatador de ação curta e adrenalina, deve estar sempre disponível. Todo TPCA positivo deve ser tratado com anti-histamínico H1 tópico ocular, e o indivíduo deve permanecer no local do teste por 2 horas ou até o desaparecimento completo dos sintomas. Corticoide ocular e anti-histamínico H1 oral devem ser considerados nas reações intensas, que possam evoluir para reação de fase tardia. Esses indivíduos devem ser monitorados pela equipe médica por 24 horas99.
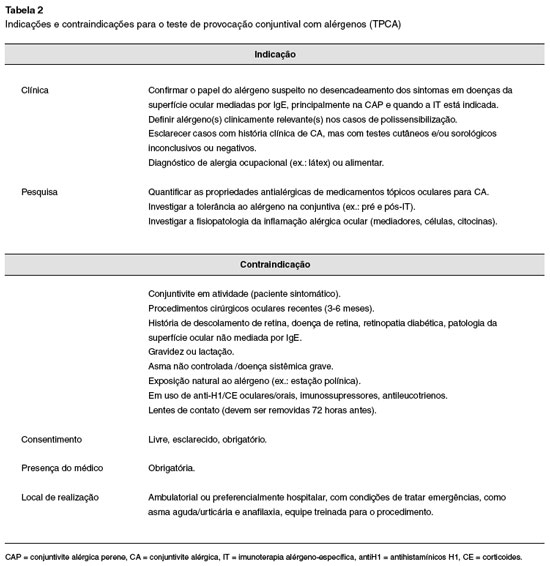
Um resumo das indicações e contraindicações do TPCA está disposto na Tabela 2.
Como realizar
O TPCA apresenta alta sensibilidade e especificidade ao alérgeno para o diagnóstico de conjuntivite alérgica na vigência de sintomas sugestivos, quando realizado com extratos alergênicos padronizados101,108.
A qualidade do extrato é fundamental para resultados confiáveis. Os extratos devem ser padronizados, preferencialmente liofilizados e sem conservantes. A quantidade de alérgenos maiores deve ser conhecida e pode variar de acordo com o fabricante. Extratos comerciais padronizados para TPCA, que atendam a todas essas especificações, são de alto custo, disponíveis apenas em alguns países e para poucos alérgenos, o que limita o uso rotineiro do TPCA na prática clínica. Para uso, os extratos são diluídos em solução salina ou diluente, em temperatura ambiente, de acordo com as instruções fornecidas pelo fabricante. Após a diluição, a estabilidade da solução é garantida por 6-24 horas. Mistura de diferentes alérgenos não deve ser utilizada99.
A técnica de referência para TPCA foi descrita por Abelson e cols.97. Com pipeta dosimetrada, 20-40 µL de doses crescentes do extrato alergênico diluído são instiladas no quadrante látero-inferior da conjuntiva bulbar de um olho, em intervalos de 15-20 minutos, até que ocorram sintomas de CA, quando o teste é interrompido e considerado positivo (Figura 3). Quando a dose máxima é aplicada e não ocorrem sintomas, TPCA é considerado negativo. O olho contralateral recebe apenas diluente ou solução salina fisiológica, e serve como controle da reação conjuntival no olho testado. Para o aumento das doses do alérgeno, podem ser utilizadas razões de diluição 10 (ex. 1:1000-1-100-1:10) ou 2 (ex. 1:32-1:16-1:8-1:4-1:2). A razão 2 parece ser mais apropriada, pois fornece aumento progressivo de doses, com reações mais específicas, seguras e confiáveis99.
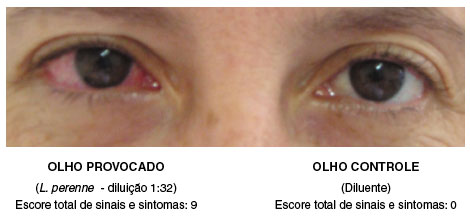
Figura 3
Teste de provocação conjuntival com alérgenos (TPCA) positivo no olho direito
A reação ocular é dose-dependente, com reações mais intensas na medida em que doses maiores de alérgeno são aplicadas na conjuntiva, o que pode levar a sintomas clínicos de reação de fase tardia, 6-12 horas após TPCA (Figura 4)109.
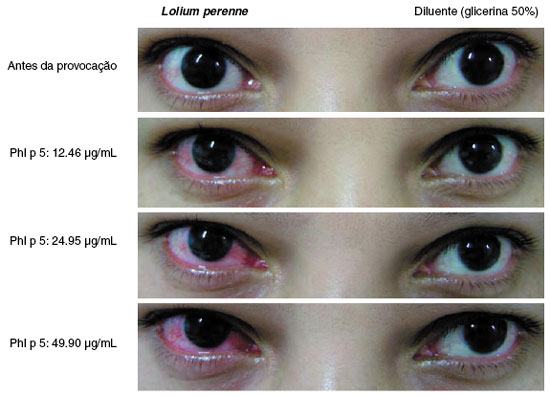
Figura 4
Progressão da hiperemia conjuntival com doses crescentes de alérgeno durante teste de provocação conjuntival com alérgenos (TPCA) com Lolium perenne. Adaptado de Mourão EMM et al.101
O TPCA é um teste reprodutível. O intervalo mínimo entre duas provocações oculares deve ser de 7 dias. Em nosso estudo, TPCA foi reprodutível em 78% dos indivíduos alérgicos com a mesma dose de alérgeno que desencadeou reação positiva no primeiro TPCA com intervalo de 1 semana, e em 21% com uma dose imediatamente maior101. Refratariedade de resposta a provocações conjuntivais repetidas em intervalos mais curtos (< que 1 semana), ou muitas vezes durante um período de tempo prolongado, foi observada110. É possível que a aplicação de doses crescentes de alérgenos em intervalos curtos e regulares promova uma diminuição da HRCe111.
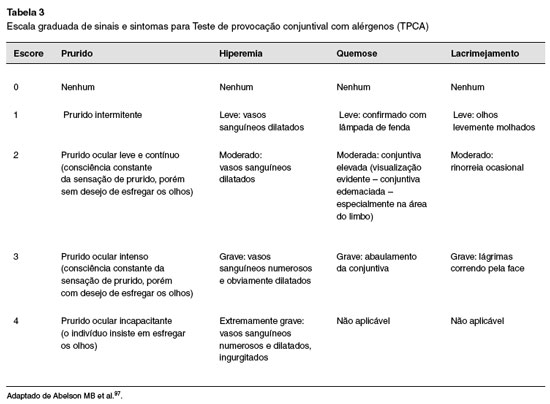
Como avaliar uma resposta positiva
Existe grande variação na graduação da resposta ocular durante o TPCA. Até o momento, não existe consenso universal sobre um sistema único de graduação a ser seguido.
O TPCA é considerado positivo quando desencadeia prurido e hiperemia conjuntival de intensidade moderada. Prurido ocular é o critério principal a ser avaliado durante o TPCA, ocorrendo em 96% dos testes positivos101, e é reconhecido pela FDA para avaliação de eficácia clínica a medicamentos antialérgicos e imunoterapia99. Prurido ocular e periocular espontâneo é o sintoma mais precoce da HRCe, aparecendo 3-5 minutos após a exposição ao alérgeno, com pico em torno de 10-15 minutos e desaparecendo gradualmente após 20 minutos. Hiperemia conjuntival é também um sinal primário de HRCe, ocorrendo 5 minutos após a exposição ao alérgeno, atingindo pico de intensidade em 20 minutos e começando a desaparecer após 30 minutos101. Em nossa série de provocações oculares, prurido espontâneo antes de hiperemia conjuntival foi relatado pelos indivíduos alérgicos em 66% de TPCA positivos com uma dose imediatamente menor de alérgeno. Alguns protocolos de provocação conjuntival para fins diagnósticos de CA utilizam o prurido como o único critério de positividade para o TPCA100.
Devido à subjetividade da resposta, uma vez que a intensidade do prurido é informada pelo paciente, é recomendado para TPCA o uso de outros sinais e sintomas da HRCe, como hiperemia conjuntival, lacrimejamento e quemose, que são avaliados pelo médico. Estes quatro sinais e sintomas são avaliados por uma escala de escore cumulativo97. O TPCA é considerado positivo quando a soma dos escores de prurido, hiperemia, lacrimejamento e quemose é ≥ 5, com pelo menos 2 graus de intensidade em prurido e em hiperemia (Tabela 3). Esse escore é calculado antes e após 15 minutos da aplicação da dose do alérgeno no olho testado. Esse escore total de sinais e sintomas oculares pode variar de 0 a 13 pontos (Figura 5). Alguns estudos sugerem também um escore complementar para edema palpebral, que pode ocorrer em 53% dos TPCA positivos101.
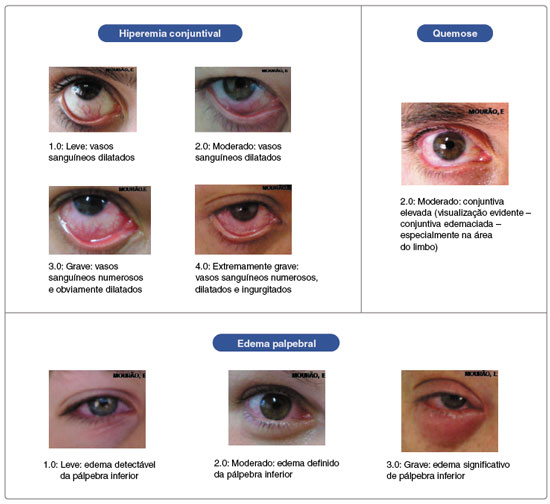
Figura 5
Referências fotográficas durante teste de provocação conjuntival com alérgenos (TPCA) positivo Adaptado de Mourão EMM et al.101
Esforços têm sido feitos para reduzir a subjetividade das observações dos sinais e sintomas oculares durante as provocações conjuntivais como o uso de fotografia digital, termometria e estesiomêtro, mas nenhum método até o momento foi incorporado na prática do TPCA112.
Segurança e efeitos adversos
Apesar de pouco relatados na literatura médica, efeitos adversos de provocações oculares, como rinoconjuntivite aguda, edema periorbital, urticária, broncoespasmo e anafilaxia, podem ocorrer. Estas reações são na sua maioria leves e autolimitadas, relacionadas com a reação de fase imediata da inflamação alérgica99.
Em uma série de 950 provocações oculares, houve apenas duas reações sistêmicas leves em indivíduos sensibilizados, um caso de urticária de aparecimento tardio e um episódio de sibilos em um indivíduo asmático. Um caso de anafilaxia foi relatado em outro estudo97.
Em uma série de 77 TPCA positivos com extratos padronizados (Alk Abelló) de Dermatophagoides pteronyssinus (83,8 µg/mL de Der p 1), Blomia tropicalis (42,4 ng/mL de Blo t 5) e Lolium perenne (399,2 µg/mL de Phl p 5), 88% dos indivíduos apresentaram prurido nasal, espirros, obstrução nasal e coriza com resolução espontânea em 1 hora113. Isso ocorre por drenagem direta dos alérgenos para o nariz através do ducto nasolacrimal. Para minimizar a absorção do alérgeno e reduzir o risco de eventos adversos, Anderson e cols. recomendam a oclusão do ducto nasolacrimal durante TPCA114. Edema palpebral foi observado em 53% de TPCA positivos. Um indivíduo sensível a Lolium perenne desenvolveu reação de fase tardia, com edema periorbital intenso no olho provocado (25 µg/mL de Phl p 5) com duração de 48 horas, necessitando tratamento oral com corticoide e anti-histamínico H1. Outros dois indivíduos também sensíveis a Lolium apresentaram edema moderado de pálpebra inferior, com duração de 3 horas mesmo após tratamento tópico e oral com anti-histamínico H1. As doses de provocação foram 25 e 12,5 µg/mL de Phl p 5, respectivamente. Um paciente apresentou quemose acentuada na dose de 12,5 µg/mL de Phl p 5, seguido por epífora e prurido ocular intenso, sendo tratado com tampão ocular por 8 horas, anti-histamínicos H1 oral e tópico, e corticoide tópico ocular. Todos esses pacientes apresentavam diâmetro de pápula ≥ 10 mm para Lolium perenne no TCA. Ainda em nosso estudo, um indivíduo asmático controlado, sensível a Blomia tropicalis (diâmetro de pápula ≥ 8 mm no TCA), apresentou episódio de broncoespasmo e falta de ar com a dose de 28,9 ng/mL de Blo t 5), sendo tratado com beta 2-agonista aerossol, corticoide e anti-histamínico H1 orais113.
Apesar de ser considerado seguro mesmo com doses altas de alérgenos, risco potencial de reações graves e com risco de vida podem ocorrer, o que justifica a realização de TPCA por equipe treinada com o método, em ambiente hospitalar ou equipado para o tratamento de anafilaxia99,100,113.
Concluindo, o TPCA é um método simples, rápido e seguro para avaliar doenças alérgicas oculares mediadas por IgE, principalmente nos casos de conjuntivite alérgica perene, em indivíduos polissensibilizados ou quando não existe concordância entre os sintomas e o alérgeno suspeito. Com isto, sugerimos um protocolo de realização do TPCA, como demonstrado na Figura 6.
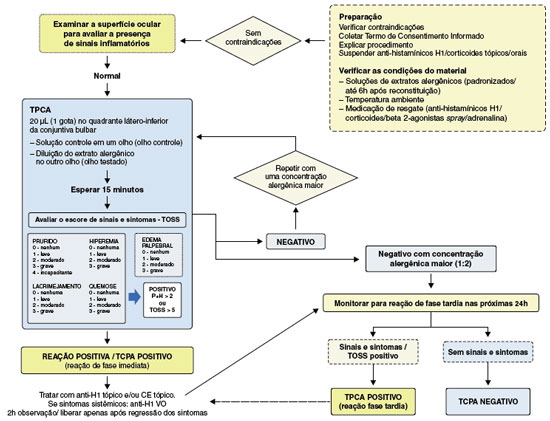
Figura 6
Teste de provocação conjuntival com alérgenos (TPCA) - Fluxograma de investigação de conjuntivite alérgica
DIAGNÓSTICO DIFERENCIAL
O olho vermelho é um sinal comum e que muitos consideram a "marca registrada" de todas as formas de conjuntivite, embora também possa estar presente pelo comprometimento de outras estruturas do olho que não a conjuntiva, como por exemplo, esclerite, uveíte e glaucoma agudo (Figura 7).
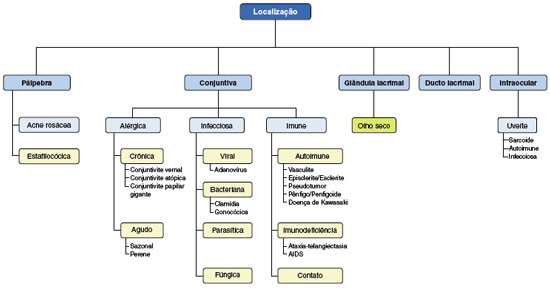
Figura 7
O diagnóstico diferencial de doenças alérgicas oculares inclui uma variedade de outras causas, como alérgica, infecciosa, autoimune e mecânica ou inespecíficas que desencadeiam a resposta de hipersensibilidade de tecidos extraoculares e intraoculares imunologicamente ativos. Adaptado de Bielory et al.7
Estes incluem condições alérgicas agudas e crônicas (por exemplo conjuntivite papilar gigante, conjuntivite vernal, ceratoconjuntivite atópica, conjuntivite límbica superior, conjuntivite folicular; causas infecciosas - por exemplo, doença de clamídia, molusco contagioso, síndrome oculoglandular pirinaud); e vários distúrbios como ceratoconjuntivite sicca, acne rosacea, penfigoide ocular e blefaroconjuntivite115.
CONJUNTIVITES NOS ERROS INATOS DA IMUNIDADE
Erros inatos de imunidade (EII), ou imunodeficiências primárias (IDP), manifestam-se como suscetibilidade aumentada a doenças infecciosas, autoimunidade, doenças autoinflamatórias, alergia e/ou malignidade. Até o momento existem 430 defeitos genéticos descritos, associados a erros inatos de imunidade116.
Embora o envolvimento ocular não seja comum, uma variedade de manifestações oftálmicas pode se desenvolver e, em alguns casos, pode até mesmo preceder os sintomas típicos de uma síndrome de imunodeficiência específica117.
O conhecimento dos mecanismos envolvidos nas manifestações oculares em pacientes com IDP permite o diagnóstico precoce e o tratamento específico, levando à redução ou prevenção de morbidades visuais graves.
Existem poucos relatos de casos e algumas revisões descrevendo as manifestações oculares em pacientes com EII. Nesses pacientes, as conjuntivites podem resultar do aumento da suscetibilidade às infecções e autoimunidade118.
Existem poucas revisões e relatos de casos de conjuntivites em pacientes com imunodeficiência primária. Um estudo prévio em 90 pacientes com IDP, observou uma recorrência de conjuntivite não folicular e não purulenta em 9% dos casos, e uma maior predisposição naqueles com baixos níveis ou ausência das principais imunoglobulinas séricas. Entre as IDP associadas às conjuntivites, as principais foram a imunodeficiência combinada grave, a agamaglobulinemia ligada ao X, e a imunodeficiência comum variável. A ausência de IgA na lagrima, por si só, não foi um fator preditivo para presença de conjuntivite ou ceratoconjuntivite119.
Imunodeficiência combinada grave (SCID) é o termo aplicado ao grupo de doenças raras, graves e fatais, caracterizadas por defeitos nas respostas de células T e B, resultando em ausência de resposta imune adaptativa. A SCID representa a forma mais grave de IDP, com sinais e sintomas que aparecem nos primeiros meses de vida, e é caracterizada pelo atraso no crescimento associado a infecções bacterianas, virais e fúngicas recorrentes, incluindo aumento de suscetibilidade a infecção por microrganismos oportunistas. A maioria das manifestações oculares é um resultado direto desta suscetibilidade. Outras anormalidades oculares descritas são associadas à infecção por citomegalovírus (CMV) ou após transplante de medula óssea. Esses achados incluem coriorretinite, retinite associada a CMV e neurite óptica120-122. Infecções oportunistas em pacientes com SCID incluem coriorretinite por toxoplasmose, ceratite e/ou endoftalmite fúngicas e conjuntivite e coriorretinite por Pneumocystis jirovecii119.
A agamaglobulinemia ligada ao X (ALX) é causada por mutações no gene que codifica a Bruton tirosina quinase (BTK). Como a BTK desempenha importante papel no desenvolvimento de células B, pacientes com ALX não geram células B maduras, o que resulta em ausência de plasmócitos e, consequentemente, agamaglobulinemia. Sintomas aparecem usualmente precocemente na infância e consistem em infecções bacterianas respiratórias e cutâneas, sepse e meningite. Além disso, pacientes com ALX são susceptíveis a infecções por enterovírus e podem desenvolver doenças autoimunes. A conjuntivite e ceratoconjuntivite bacterianas por Haemophilus influenzae e Chlamydia trachomatis têm sido observadas123,124.
A imunodeficiência comum variável (IDCV) é uma doença heterogênia e multissistêmica caracterizada por hipogamaglobulinemia e pobre resposta humoral a antígenos vacinais e outros antígenos devido à diferenciação anormal de linfócitos B e/ou defeitos na interação entre células T e B. As manifestações mais importantes são as infecções respiratórias e gastrointestinais recorrentes, aumento da incidência de doenças autoimunes e malignidades. Embora as manifestações oculares em pacientes com IDCV não sejam comuns, estas podem ocorrer devido às infecções recorrentes e manifestações autoimunes. As infecções oculares podem envolver todas as estruturas do olho. Nos casos de conjuntivite bacteriana, tem sido identificado S. pneumoniae , H. influenzae , Staphylococcus epidermidis , Staphylococcus aureus e outras bactérias multi-drogas-resistentes125,126. Outras manifestações oculares descritas em pacientes com IDCV incluem ceratite, uveíte com inflamação granulomatosa, vasculite retiniana, coroidite, neurite optica bilateral, corioretinite127.
A deficiência de Imunoglobulina A (IgA) é a IDP mais comum, sendo que a maioria dos pacientes são assintomáticos. Apesar disso, existe um aumento da incidência de doenças autoimunes e infecções respiratórias e gastrointestinais recorrentes. Em pacientes com deficiência de IgA, as doenças oculares raramente têm sido descritas, e podem afetar principalmente a conjuntiva128.
A deficiência de IgM isolada ou deficiência seletiva de IgM é uma desgamaglobulinemia primária rara definida pelo nível de IgM menor de 20 ng/dL em crianças, e menores que 2 desvios padrões abaixo do normal em adultos, e níveis normais das demais imunoglobulinas. Alta frequência de manifestações pulmonares, incluindo infecções recorrentes do trato respiratório superior, asma e rinite alérgica, tem sido descrita. Algumas manifestações oftálmicas na deficiência seletiva de IgM, como hordéolo recorrente, conjuntivites e blefarites por Staphalococcus aureus, têm sido documentadas129.
A doença granulomatosa crônica (DGC) é uma doença hereditária, com herança ligada ao X ou autossômica recessiva, na qual os fagócitos são incapazes de gerar compostos reativos do oxigênio para combater organismos catalase-positivos. Como resultado, pacientes com DGC são propensos a infecções bacterianas e fúngicas recorrentes. Além disso, as DGC estão associadas com aumento do risco de doenças autoimunes. Blefaroconjuntivite tem sido consistentemente descrita em pacientes com DGC, e pode resultar em ceratite puntata e formação de panus130-132. Outras manifestações oftálmicas na DGC incluem uveíte133, ceratite por cândida glabrata, ceratite ulcerativa com formação de granulomas no limbus, descolamento de retina, palidez de nervo óptico e úlceras e cicatrizes da córnea130,131.
Deficiência de adesão leucocitária (LAD) tipo 1 é uma doença autossômica recessiva causada por expressão anormal de Beta 2 integrina (CD11/CD18) em leucócitos. As principais manifestações clínicas da LAD-1 incluem queda tardia do coto umbilical, infecções bacterianas recorrentes, periodontites e pobre cicatrização de feridas. Manifestações oculares têm sido descritas em poucos casos, incluindo celulites de pálpebras, conjuntivites134 e necrose da superfície medial causada por Pseudomonas aeruginosa135.
A candidíase mucocutânea crônica (CMC) engloba um grupo heterogênio de doenças caracterizadas por candidíases recorrentes ou persistentes na pele, mucosas e unhas. CMC pode ocorrer como sintoma isolado, porém é frequentemente acompanhada por doenças sistêmicas, como na Poliendocrinopatia Autoimune, Candidíase, Distrofia Ectodérmica (APECED). Recentemente, vários genes relacionados à geração de IL-17 e IL-22 foram identificados e suas mutações resultam em CMC autossômica recessiva (CARD9, DOCK8, IL17F, IL17RA) ou CMC autossômica dominante (mutações de STAT3 e ganho de função de STAT1). Uma anormalidade imunológica subjacente é responsável pelo prejuízo na função de linfócitos T, que resulta em inabilidade de produção de citocinas como IL-17 e IL-22, que são essenciais para expressão da imunidade mediada por célula contra cândida. Ceratite bilateral, ceratoconjuntivite e alterações córneas são as complicações mais comuns na APECED causada por mutações no gene regulador de autoimunidade e síndromes APECED-like. Olho seco, blefaroespasmos e fotofobia podem ser resultados diretos da ceratite. Alterações córneas caracterizam-se por úlceras, cicatrizes e vascularização estromal podem afetar a acuidade visual. A ceratite pode preceder as endocrinopatias136. Outras anormalidades oftálmicas associadas à CMC incluem opacidades da lente, iridociclite bilateral, descolamento de retina, atrofia óptica, retinite pigmentosa, ambliopia anisométrica, miopia e redução na produção de lágrimas. A perda de cílios e sombrancelhas tem sido atribuída à infecção crônica por cândida ou alopecia areata137.
A síndrome de Chediak-Higashi (CHS), uma imunodeficiência autossômica recessiva rara causada por mutações no gene LYST, é caracterizada por formação anormal de grânulos em neutrófilos e melanócitos. Achados clínicos característicos incluem albinismo oculocutaneo parcial, imunodeficiência grave, defeitos na coagulação e neuropatia progressiva. Pacientes afetados com esta síndrome frequentemente sofrem com infecções bacterianas recorrentes. O albinismo ocular é considerado a principal manifestação visual em pacientes com CHS, que sofrem de fotofobia e nistagmo138. O albinismo oculocutaneo é visto em algumas outras IDP, como síndrome de Griselli tipo 2, Síndrome de Hermansky-Pudlak tipo 2 (HPS2) e deficiência de p14139.
A ataxia-telangiectasia (AT) é uma doença autossômica recessiva, neurodegenerativa, devido a mutações no gene ATM, caracterizada por ataxia cerebelar, deficiência neurológica progressiva e telangiectasias. Outra manifestação característica inclui imunodeficiência causando infecções sinopulmonares, predisposição a malignidades, radiosensibilidade aumentada e esterilidade. Manifestações oculares são classificadas como telangiectasia conjuntival e distúrbios de movimentos oculares. Telangiectasias ou vasos torcidos e dilatados, a segunda característica proeminente, são vistos na conjuntiva bulbar e palpebral e fórnice da conjuntiva. Normalmente, eles aparecem mais tarde na idade de 3-6 anos em comparação com a ataxia, mas ocasionalmente são observados mais cedo, particularmente em crianças com uma história familiar positiva140. Essas alterações vasculares não causam disfunção ocular.
A síndrome de Bloom (BS) é doença autossômica recessiva rara com reparo de DNA causada por mutação no gene BLM. BS é caracterizada por baixa estatura, eritema cutâneo facial, lesões cutâneas hiper e hipopigmentadas, imunodeficiência, hipogonadismo e um aumento da incidência de doenças malignas e diabetes. A patologia relacionada ao olho é altamente variável e pode incluir drusas retinianas de início precoce (descritas principalmente como manchas semelhantes ao corpo coloide), eritema telangiectásico, que pode se estender às pálpebras e conjuntiva bulbar, conjuntivite, retinoblastoma unilateral, perda de cílios, alterações de pigmento da íris e opacidades do cristalino subcapsular. Retinopatia diabética não proliferativa acompanhada de retinite hemorrágica devido à leucemia aguda e hipoplasia do nervo óptico bilateral também foi relatada141.
A síndrome de Wiskott-Aldrich (WAS) é uma imunodeficiência ligada ao X caracterizada pela tríade de infecções bacterianas recorrentes, eczema e diátese hemorrágica associada com trombocitopenia congênita e plaquetas pequenas. Os pacientes possuem maior risco de desenvolver manifestações autoimunes e malignidades. As complicações oftálmicas são consequências da diátese hemorrágica ou do aumento da suscetibilidade a infecções, e incluem conjuntivite, blefaroconjuntivite, úlceras conjuntivais e de córnea, episclerite, ceratite ulcerativa, erupções palpebrais necrosantes e eczema palpebral. Os vírus do molusco contagioso e do herpes simplex estão associados à blefaroconjuntivite142. A necrose retiniana aguda relacionada ao vírus varicela zoster se apresenta como uveíte difusa, vasculite retiniana e retinite aguda, e pode causar sequela visual séria. O defeito plaquetário pode levar à hemorragia ocular, como sangramento periorbital, hemorragia na conjuntiva, subconjuntiva, retina, disco óptico e vítreo142.
TRATAMENTO
Tratamento não farmacológico
Medidas gerais
O tratamento não farmacológico da conjuntivite alérgica inclui medidas gerais que são úteis para a maioria dos pacientes. Os pacientes e/ou cuidadores devem receber suporte educativo sobre a duração prevista e prognóstico da alergia ocular, e possíveis complicações sobre o controle inadequado da doença.
Cuidados básicos com a visão
Os pacientes devem ser orientados a não esfregar os olhos, pois a fricção pode causar degranulação mecânica dos mastócitos e piora dos sintomas. A aplicação de colírios de lágrimas artificiais ou soluções oculares sem conservantes são úteis para diluir e remover antígenos da superfície ocular, reduzindo a concentração de mediadores no filme lacrimal, e consequentemente os sintomas alérgicos. Por outro lado, a lavagem frequente dos olhos com água corrente deve ser evitada, uma vez que pode reduzir a estabilidade da camada lacrimal143.
Embora a aplicação de lágrimas artificiais e compressas frias não tenha efeito profilático sobre a resposta alérgica ocular, estes procedimentos podem atenuar sinais oculares de inflamação, como hiperemia conjuntival e aumento da temperatura da superfície ocular, em especial durante um episódio agudo de conjuntivite alérgica. Estudo envolvendo a exposição controlada ao pólen de gramíneas em pacientes com conjuntivite alérgica sazonal (CAS) mostrou que a combinação da aplicação de lágrimas artificiais e compressas frias, em conjunto com colírio de anti-histamínico, foi superior ao uso isolado da medicação para a redução do tempo e intensidade dos sintomas144.
De um modo geral, os pacientes devem reduzir ou interromper o uso de lentes de contato durante os períodos sintomáticos, devido à propensão dos alérgenos de aderir às superfícies das lentes de contato. Os agentes de limpeza de lentes, juntamente com as soluções de armazenamento e enxágue devem ser isentos de conservantes, uma vez que as reações de hipersensibilidade a estas substâncias podem contribuir para a reação inflamatória. Soluções salinas caseiras não são recomendadas, devido ao risco de contaminação bacteriana145.
Essas medidas são especialmente úteis em pacientes portadores de conjuntivite papilar gigante (CPG) desencadeada por lentes de contato, cujo tratamento primário baseia-se na remoção da fonte de irritação mecânica. Neste caso, aprimorar a limpeza e o armazenamento das lentes para evitar a aderência de antígenos, reduzir o tempo de uso, aumentar a frequência de sua substituição e alterar o tipo e/ou modelo das mesmas são importantes medidas auxiliares do tratamento farmacológico146.
Controle ambiental
A identificação dos alérgenos específicos para cada caso e a instituição de medidas inerentes para sua prevenção constituem importantes etapas para a abordagem adequada da alergia ocular. Do mesmo modo, ações que minimizem a exposição a gatilhos inespecíficos, como a exposição ao sol, vento e água salgada, como o uso de óculos escuros, chapéus com viseiras e óculos de natação, devem ser implementadas.
Como na maioria das vezes a conjuntivite alérgica está associada à rinite, as medidas preventivas devem abordar ambas patologias. Assim, em pacientes com conjuntivite alérgica perene (CAP) devido aos ácaros da poeira domiciliar, atenção especial deve ser reservada ao dormitório, que deve ser bem ventilado e ensolarado. Os reservatórios de poeira, como móveis estofados, cortinas e tapetes muito pesados, devem ser removidos ou ser aspirados com frequência no mínimo semanal. Os pisos devem ser preferencialmente laváveis (cerâmica, vinil e madeira), e as cortinas do tipo persianas ou de material que possa ser limpo com pano úmido. Medidas adicionais incluem a substituição de travesseiros, cobertores e colchões de paina e/ou penas pelos de espuma, fibra ou látex, lavar regularmente as roupas de cama e cobertores com detergente e temperaturas elevada (> 55 °C), secagem ao sol ou ar quente e utilizar capas impermeáveis para travesseiros, edredons e colchões147,148.
Quando os principais alérgenos envolvidos são os epitélios de animais de pelo, deve-se evitar a presença dos mesmos no quarto e, especialmente, na cama do paciente. Caso não seja possível restringir o animal a uma única área da moradia, é recomendável utilizar purificadores do tipo Hight Efficiency Particulate Air (HEPA)147,148.
Medidas preventivas para redução dos sintomas da conjuntivite alérgica sazonal (CAS) produzida por polens, presentes em países de clima temperado e também no Sul do Brasil, incluem a redução da exposição ao ar livre, especialmente nos períodos de alta contagem de polens, entre 5 e 10 horas da manhã e em dias secos, quentes e com ventos. As janelas de casa e automóveis devem permanecer fechadas durante as estações de pico do pólen e, se possível, os sistemas de ventilação de casa e do carro devem ser equipados com filtros especiais para evitar estes alérgenos143,147,148. Medidas adicionais incluem a inspeção regular do ambiente visando a redução dos focos de umidade e o extermínio de baratas, além de evitar irritantes inespecíficos, com destaque para a fumaça de cigarro, inseticidas, perfumes e desodorantes, principalmente na forma de sprays147,148.
Tratamento farmacológico
Os regimes de tratamento farmacológicos incluem o uso de agentes terapêuticos, como agentes orais ou tópicos, incluindo anti-histamínicos e, se necessário, descongestionantes tópicos, estabilizadores de mastócitos, agentes de ação múltipla e agentes anti-inflamatórios.
Anti-histamínicos orais podem oferecer alívio dos sintomas de alergia ocular, mas têm um tempo de início de ação prolongado. Os antagonistas H1 de segunda geração causam menos sedação e menos efeitos anticolinérgicos (olho seco) do que os de primeira geração149. Medicamentos com atividade dupla anti-histamínica e bloqueadora de mastócitos fornecem a abordagem mais vantajosa no tratamento da conjuntivite alérgica, com alívio sintomático, início de ação rápida e ação modificadora da doença. Em geral, as crianças não gostam de preparações oftálmicas tópicas, pois muitas vezes se queixam de ardor ou queimação. É importante não contaminar os medicamentos oculares tópicos se a ponta do aplicador entrar em contato com o olho ou a pálpebra ou usar um frasco para vários membros da família (especialmente com potencial de contaminação com COVID-19). Os descongestionantes tópicos atuam como vasoconstritores locais, reduzem o eritema, a congestão vascular e o edema palpebral, mas não têm efeito na prevenção da resposta alérgica ou do prurido como sintoma primário. O uso crônico de vasoconstritores tópicos leva à instabilidade do filme lacrimal e irritação da conjuntiva, com subsequente queimação ou ardência e até hiperemia de rebote. O termo "conjuntivite medicamentosa" tem sido descrito pelo uso excessivo e crônico de vasoconstritores tópicos no olho150. O uso combinado de anti-histamínico e vasoconstritor demonstrou ser mais eficaz do que o uso de qualquer um dos agentes isoladamente. O uso de corticosteroides tópicos nasais para rinoconjuntivite alérgica diminui os sintomas oculares, presumivelmente por meio de um reflexo naso-ocular e mais efetivamente para a conjuntivite alérgica sazonal do que as formas perenes de conjuntivite alérgica. Os efeitos do uso crônico em longo prazo dos corticoides nasais nos sintomas oculares não foram bem estudados, portanto, eles não devem ser usados para o tratamento de alergia ocular na ausência de sintomas nasais7.
Antagonistas dos receptores de leucotrienos são úteis no tratamento da rinite alérgica, e, apesar de ter sido demonstrado que eles podem diminuir os níveis de óxido nítrico na conjuntiva, seu uso para alergia ocular é limitado147,151.
Anti-inflamatórios não hormonais bloqueiam a enzima ciclooxigenase e a produção de prostaglandinas do ácido araquidônico. Reduzem sintomas oculares, porém, podem provocar reações sistêmicas, desconforto à instilação e, ocasionalmente, perfuração de córnea; portanto, seu uso deve ser monitorado. O cetorolaco é uma apresentação disponível para uso tópico ocular150.
Corticosteroides tópicos (ou raramente orais) podem ser usados para os casos agudos mais graves que requerem terapia de 3-5 dias. O uso crônico de esteroides para distúrbios oculares só deve ser realizado em conjunto com um oftalmologista. A administração local de corticosteroides tópicos pode estar associada ao aumento da pressão intraocular. Existe algumas formas de pró-drogas, como o loteprednol, que demonstrou ter efeito mínimo no desenvolvimento de aumento de pressão intraocular ou catarata. No entanto, todos os esteroides tópicos podem predispor a infecções virais e devem ser usados com cautela, especialmente se o paciente tiver história suspeita de exposição viral ou conjuntivite unilateral. Medicamentos imunomoduladores, como tacrolimo tópico ou ciclosporina tópica, são usados como poupadores de corticoides e não apresentam perfil de efeitos adversos quando comparados aos corticoides152. A Tabela 4 apresenta uma visão geral do tratamento da alergia ocular.
Imunossupressão
Imunomodulação tópica
Os inibidores de calcineurina tópicos são os tratamentos mais frequentemente usados como agentes poupadores de corticoides em casos de VKC e AKC dependentes de corticoides. Duas revisões sistemáticas sobre o uso de ciclosporina tópica (CsA) em VKC e AKC154,155 mostraram que a CsA tópica é eficaz no alívio dos sinais e sintomas de VKC e AKC, reduz a dependência de colírios de corticoides tópicos, mantendo segurança semelhante à do placebo154. O segundo estudo destacou a relativa escassez de ensaios clínicos randomizados avaliando a eficácia da CsA tópica em AKC, e sugeriu que CsA fornece melhora clínica e sintomática e pode ajudar na redução do uso de corticoides ópicos em pacientes cortico-dependentes, ou não responsivos a corticoides155.
A ciclosporina A (CsA) é o primeiro imunomodulador tópico usado para o tratamento de VKC grave desde os anos 1990156. Já naquela época, a CsA era considerada um substituto eficaz dos corticosteroides, com excelente atividade anti-inflamatória em pacientes com VKC cortico-dependente e corticosteroide resistente156. A CsA é lipofílica e, portanto, deve ser dissolvida em uma base de álcool-óleo. Por muitos anos, a indisponibilidade de uma preparação comercial de CsA tópica e dificuldades técnicas na dispensação de colírios impediam seu uso generalizado para o tratamento de VKC. A formulação a 2% foi a primeira usada no tratamento de VKC, mas concentrações mais baixas (1%, 0,5%, 0,1%, 0,05%) foram usadas e mostraram-se eficazes para o tratamento de VKC moderada a grave157,158. Quando necessário, podem ser usados corticoides tópicos adicionais em ciclos curtos. A absorção sistêmica não foi detectada por métodos laboratoriais159, o que exclui a possibilidade de efeitos colaterais locais ou sistêmicos pela CsA. Ardor e irritação são efeitos colaterais frequentes, mas raramente é necessário interromper o tratamento com o medicamento. O tratamento pode ser prescrito sazonal ou perene, reduzindo-se as doses nas fases não ativas da doença. Eventos adversos, como infecções bacterianas ou virais, são raros, enquanto alterações de pressão intraocular não foram relatadas.
CsA 1% quatro vezes ao dia reduziu significativamente em duas semanas os sinais e sintomas e os níveis lacrimais de proteína catiônica eosinofílica em um grupo de pacientes com VKC160, e foi relatado como a concentração mínima eficaz no tratamento de úlceras de córnea, com recorrência observada com concentrações mais baixas161. Os efeitos da baixa concentração de CsA 0,05% são controversos, mas considerados um eficaz agente poupador de corticoides162,163 e eficaz na prevenção de recidivas de CVC164. Em um estudo clínico prospectivo e observacional em 594 pacientes, o CsA 0,1% mostrou-se eficaz e seguro para o tratamento de VKC165.
O CsA tópico 0,1% em emulsão catiônica (CE) foi recentemente aprovado na União Europeia e no Canadá como um medicamento órfão para o tratamento de VKC grave com base nos resultados do estudo VEKTIS. O estudo atingiu seu desfecho primário, demonstrando a superioridade do tratamento com CsA-CE 4 vezes por dia e CsA-CE 2 vezes por dia sobre o veículo, em uma pontuação de eficácia durante o período de tratamento de quatro meses. Este benefício foi impulsionado pela diminuição na pontuação da fluoresceína da córnea (CFS) (refletindo menos danos à córnea) e pela redução no uso de dexametasona como medicação de resgate em caso de exacerbações. Além disso, o CsA-CE 0,1% melhorou significativamente a qualidade de vida (QV) dos pacientes avaliada pelo questionário específico QUICK166. As melhorias na ceratite, sintomas e qualidade de vida alcançadas com CsA-CE durante os quatro meses iniciais de tratamento foram mantidas durante o período de acompanhamento de oito meses subsequentes, com ambos os regimes de dosagem de CsA-CE exibindo perfis de segurança favoráveis ao longo do período de tratamento, fornecendo mais evidências de que a CsA-CE tópica é uma opção terapêutica viável para crianças e adolescentes com VKC grave167.
O tacrolimo é uma droga potente semelhante à CsA em seu modo de ação, mas quimicamente distinta. Uma pomada cutânea de tacrolimus é licenciada para o tratamento de doenças palpebrais atópicas moderadas a graves e pode ter benefícios secundários para AKC168-170. A aplicação conjuntival de pomada de tacrolimus 0,03% e 0,1% foi eficaz, bem tolerada e segura no tratamento da conjuntivite alérgica grave169,171. Em um ensaio multicêntrico, duplo-cego e controlado por placebo, a suspensão oftálmica de tacrolimo 0,1% demonstrou ser eficaz no tratamento da conjuntivite alérgica grave. A dose foi baseada nos resultados de um estudo anterior de variação da dose em que a suspensão oftálmica de tacrolimo 0,1% mostrou melhora mais evidente e perfil de segurança semelhante em comparação com 0,01% e 0,03%. Os pacientes tratados duas vezes ao dia por 4 semanas com tacrolimo 0,1% melhoraram significativamente os sinais e sintomas. O evento adverso mais frequente relacionado ao tacrolimo foi irritação ocular172. Demonstrações sobre a qualidade, segurança e eficácia das diferentes preparações manipuladas usadas nos diferentes estudos clínicos serão necessárias antes que o tacrolimo seja considerado como medicamento órfão para VKC e AKC.
No entanto, uma preparação comercial de colírio está disponível na Ásia com a indicação de AKC e VKC graves. Uma revisão, com um escore de evidência de qualidade criticamente baixo, destacou os benefícios do tacrolimus sobre o placebo em dois ensaios randômicos controlados e quatro séries de casos173. Em um estudo prospectivo duplo-mascarado comparativo randômico para comparar a eficácia da pomada oftálmica de tacrolimo 0,1% com CsA 2% mostrou que ambos foram igualmente eficazes no tratamento de VKC174. Em um segundo estudo, pacientes com VKC resistentes à CsA175, tratados com tacrolimo 0,1%, mostraram uma melhora significativa nos escores clínicos em relação à CsA 1%. Um estudo recente comparando o efeito do tacrolimo tópico a 0,1% sozinho ou em combinação com corticosteroides tópicos em doenças oculares alérgicas refratárias, também mostrou um potencial efeito poupador de corticoides176. Além disso, as pomadas cutâneas de tacrolimo 0,03% ou 0,1% demonstraram ser benéficas no tratamento do eczema palpebral em pacientes com AKC177-179.
Em doze pacientes tratados com tacrolimo tópico por uma média de 8 anos, foi mostrada eficácia de longo prazo nos sinais clínicos de AKC e VKC graves, embora metade dos pacientes não tenha sido capaz de descontinuar os corticoides tópicos completamente ao longo do tempo de tratamento. Deve-se notar que o aumento da pressão intraocular e infecções da córnea eram efeitos colaterais potenciais180. Portanto, a tolerabilidade dos inibidores de calcineurina tópicos é uma preocupação, pois a sensação de queimação é frequentemente relatada. As infecções por molusco contagioso, vírus do papiloma e herpes são raras, mas são riscos reconhecidos.
Imunomodulação sistêmica
Tratamento imunossupressor sistêmico pode ser prescrito na maioria dos casos refratários com risco de perda de visão por AKC. A ciclosporina foi o medicamento mais utilizado181. Azatioprina e micofenolato de mofetil são opções alternativas.
Imunoterapia para alérgenos
O paciente com conjuntivite alérgica quando procura um especialista em alergia nem sempre está satisfeito em ter que usar com frequência ou diariamente e até mais de uma vez por dia, medicamentos por via oral ou tópica, para controle de sintomas por tempo prolongado. Imunoterapia (IT) é a prática de administrar quantidades gradualmente maiores de um extrato alergênico em indivíduo alérgico para melhorar os sintomas associados à exposição subsequente ao mesmo alérgeno182. IT é um procedimento efetivo no tratamento de pacientes com doenças alérgicas mediadas por IgE para alérgenos definidos182,183.
Pela modificação da resposta biológica, influencia as respostas imunológicas iniciadas pelo alérgeno e restabelece parcialmente o desequilíbrio Th1/Th2 do indivíduo alérgico linfócitos B e T, células Treg, anticorpos bloqueadores, IL-10 e outras citocinas estão envolvidas na ação da IT183,184. IT com injeções de alérgenos é recomendada para pacientes com alergia respiratória mediada por anticorpos IgE, cujos sintomas respondem inadequadamente à terapêutica recomendada por diretrizes clínicas185.
A IT, quando adequada, deve ser usada em combinação a todas as formas de tratamento farmacológico e não farmacológico, com o objetivo de permitir que o paciente alérgico se torne assintomático o mais rápido possível. Diversos estudos, randomizados, duplo-cegos, controlados com placebo demonstraram a eficácia, segurança, indicações e contraindicações da IT no tratamento das doenças alérgicas186,187.
A IT com alérgenos está indicada para pacientes que apresentem doença com mecanismo dependente de anticorpos IgE específicos a alérgenos clinicamente relevantes. Portanto, não basta a demonstração da sensibilização alérgica por um teste cutâneo positivo, por exemplo, pois cerca de 1/3 da população tem teste positivo sem demonstrar sintomas de alergia182,183.
A administração subcutânea de alérgenos é a principal via de aplicação da IT no tratamento de doenças alérgicas. Imunoterapia sublingual (ITSL) é alternativa efetiva, segura e conveniente à SCIT.
Metanálises mostraram que a ITSL é um tratamento seguro, reduz sintomas e necessidade de medicação em pacientes com rinite alérgica e asma. Novas formulações, como comprimidos de dissolução sublingual e adjuvantes direcionados para a mucosa oral, aumentam a eficácia do tratamento com a ITSL. Apesar de estudos convincentes, ainda faltam mais informações sobre o mecanismo de ação, doses ótimas e comparação com o tratamento convencional por via subcutânea187.
Em relação à IT em CA, os estudos são muito limitados e insatisfatórios devido ao estudo de um tipo de alergia ocular, avaliação de um tipo de alérgeno, parâmetros de acompanhamento insuficientes, ou pequeno tamanho da amostra188.
A IT é um método seguro e eficaz no controle dos sintomas e previne exacerbações e o desenvolvimento de novas sensibilizações em pacientes com CA sem efeitos colaterais oculares ou sistêmicos. Deve ser considerada como uma alternativa ou mesmo um tratamento primário para pacientes com CA para evitar problemas oculares graves de efeito colateral dos esteroides tópicos, para reduzir ou evitar a farmacoterapia de longo prazo, e também para reduzir o ônus econômico dos medicamentos147.
Não há diferença significativa entre vias de administração SLIT ou SCIT para alcançar melhora clínica e imunológica, para que o paciente possa escolher seu método preferido de terapia. Sete dos oito artigos selecionados para revisão sistemática sobre pacientes com intensa CA recomendaram o uso de SLIT e SCIT para melhora dos sintomas oculares no tratamento de rinoconjuntivite alérgica147.
Duas outras revisões sistemáticas focando sintomas oculares concluíram que a evidência era moderada para SLIT e baixa para SCIT no tratamento de conjuntivite alérgica por pólen e por ácaros da poeira189,190.
Ceratoconjuntivite vernal (CCV) é uma doença conjuntival crônica alérgica mediada por mastócitos, linfócitos e células epiteliais. Aparece mais em meninos pré-púberes e melhora na terceira década de vida. CCV pode ter exacerbações sazonais: 50% a 60% dos pacientes apresentam teste cutâneo com aeroalérgenos positivos. Imunoterapia nessa doença não foi bem estudada, e não há indicação para este tratamento. IT para ceratoconjuntivite atópica também tem pouca evidência de benefício.
IT subcutânea com extrato de Dermatophagoides pteronyssinus (3 µg de Der p 1 por aplicação, por 12 a 16 semanas) em asmáticos com conjuntivite alérgica promoveu remissão de sintomas oculares em 17 de 19 pacientes com conjuntivite leve para moderada, demonstrando a eficácia e rapidez do início de ação da imunoterapia com extrato padronizado191.
A imunoterapia desempenha um papel mais importante no controle de "longo prazo" da rinoconjuntivite. Em alérgicos que tinham asma e rinoconjuntivite quando expostos a pelos de animais (por exemplo, alérgeno Fel d I), a imunoterapia demonstrou melhorar os sintomas gerais de rinoconjuntivite e diminuir o uso de medicamentos antialérgicos. Melhora clínica e uma redução na sensibilidade ao alérgeno também foi observada em estudo por período de 12 meses de imunoterapia usando uma preparação purificada e padronizada de Dermatophagoides farinae7.
Biológicos na conjuntivite alérgica
Omalizumabe
O omalizumabe é um anticorpo monoclonal anti-IgE indicado para o tratamento de asma grave e urticária crônica. É uma IgG1 humanizada capaz de se ligar seletivamente à IgE sérica livre, especificamente na região Ce3 do fragmento Fc, evitando a ligação da IgE ao receptor de alta afinidade FceRI de muitos tipos de células, incluindo basófilos e mastócitos, produzindo uma redução em IgE livre total, e consequente incapacidade de desencadear a liberação de mediadores desses tipos celulares. Além disso, a redução de IgE livre induz uma diminuição na expressão de FceRI na superfície de mastócitos, basófilos e células dendríticas, o que leva a uma diminuição da inflamação alérgica e, em última análise, a uma menor produção de IgE.
Diferentes estudos compararam o efeito de omalizumabe vs. placebo no tratamento da conjuntivite alérgica, mostrando uma redução significativa dos sintomas nasais e oculares (olhos vermelhos, lacrimejantes e comichão) no grupo omalizumabe em comparação com o placebo após 12 e 16 semanas. No entanto, o omalizumabe não foi estudado no tratamento da conjuntivite alérgica fora da pesquisa sobre rinite alérgica147,192,193.
Há relatos de casos que mostram um bom efeito do omalizumabe no tratamento de ceratoconjuntivite atópica e ceratoconjuntivite primaveril com melhora parcial ou completa, mas em casos muito graves em relatos em crianças a melhora não foi significativa ou duradoura194. Entretanto, não há indicação formal na alergia ocular.
Dupilumabe
O dupilumabe é um anticorpo monoclonal humano direcionado contra a subunidade alfa do receptor de IL-4 que bloqueia a sinalização de IL-4 e IL-13 e demonstrou eficácia significativa em pacientes com dermatite atópica moderada a grave. O dupilumabe é aprovado para o tratamento de DA moderada a grave, asma com perfil inflamatório do tipo 2 ou corticosteroide oral dependente moderada a grave e rinossinusite crônica com pólipos nasais. Não há estudos relatando seu uso para terapia da doença ocular alérgica.
A conjuntivite foi relatada como um efeito adverso desta, descrita como inflamação da conjuntiva anterior e hiperemia do limbo. A incidência varia de 5 a 28% nos grupos tratados com dupilumabe em comparação com 2-11% nos grupos com placebo. A conjuntivite alérgica pré-existente parece ser um fator de risco, e a conjuntivite relacionada ao dupilumabe parece responder a 0,1% de fluorometolona, colírio ou indicação não marcada de tacrolimus em 0,03% de pomada oftálmica195. O aparecimento de ectrópio cicatricial foi relatado em um paciente tratado com ele para dermatite atópica196.
Os agentes biológicos direcionados à IL-5, como mepolizumabe, reslizumabe ou benralizumabe, ainda não foram estudados no contexto da conjuntivite alérgica.
Tratamentos alternativos
Tratamentos alternativos e complementares (MACs) são chamados de qualquer intervenção terapêutica fora dos ditames da medicina convencional. Embora os MACs sejam usados por aproximadamente 80% da população mundial, principalmente nos países orientais, seu uso está se espalhando para o Ocidente197. Esse aumento é baseado em seu baixo custo, perfis de segurança favoráveis, nos quais são geralmente considerados como alternativas de tratamentos "naturais" em contraste com a aversão a medicamentos de uso crônico (especialmente corticosteroides) e os resultados às vezes ruins nessa doença crônica com terapias convencionais. Vale ressaltar que apesar de seu uso difundido, existem poucos estudos randomizados de controle com placebo mostrando sua eficácia, o que faz com que estas alternativas não sejam implementadas nas diretrizes internacionais197.
Quando alergistas foram consultados sobre o uso de MACs por seus pacientes, uma alta porcentagem relatou que os faziam. Dentre eles, os mais populares foram: plantas medicinais, vitaminas, probióticos, acupuntura, ioga, meditação, massagens corporais, homeopatia, medicina ayurvédica, etc., para citar os mais frequentes198.
Terapia com plantas medicinais
Também chamada de fitomedicina ou fitoterapia, utiliza certas plantas que possuem atividade anti-inflamatória199.
Butterbur (Petasites hybricus): é uma erva nativa da Europa, Norte da África e Sudeste Asiático. Foi demonstrado que as petasinas in vitro inibem a síntese de leucotrienos, bloqueiam a ligação da histamina aos receptores H1 e a degranulação dos mastócitos200. Em um estudo duplo-cego randomizado, demonstrou a mesma eficácia da cetirizina, com menos efeitos colaterais201.
Euphrasia (Euphasia officinalis): faz parte das terapias antroposóficas, de grande popularidade na Europa Central. Entre seus princípios ativos estão taninos, flavonoides e ácido fenolcarboxílico, que lhe conferem capacidade adstringente, antisséptica e anti-inflamatória. Seu uso em gotas demonstrou eficácia significativa na redução dos sintomas oculares, embora mais estudos sejam necessários para determinar sua utilidade.
Argemone mexicana (berberina, cardose ou papoula): é uma planta nativa da América202, da qual se extrai um líquido leitoso que contém alcaloides, e tem efeitos anti-inflamatórios e antibióticos, o que levou ao seu uso no tratamento da conjuntivite203.
Lycopus lucidus (licopeno da China): é uma planta nativa da China e da América do Norte, amplamente utilizada na medicina tradicional coreana. Possui compostos que inibem a desgranulação dos mastócitos, reduzindo as reações alérgicas imediatas204.
Flavonoides: são metabólitos polifenólicos amplamente encontrados em vegetais e frutas que compõem a dieta habitual (frutas cítricas, cebolas, chá verde, vinhos, etc.), com comprovada capacidade anti-inflamatória e antioxidante, com inúmeros benefícios à saúde (arteriosclerose, obesidade, Parkinson, demência e doenças alérgicas, etc.). Eles suprimem a adesão de leucócitos e degranulação neutrofílica, diminuem a liberação de histamina de mastócitos e basófilos e inibem a produção de IL-4 e IL-13, agindo assim em doenças alérgicas. Os flavonoides mais estudados para o tratamento da conjuntivite alérgica são a quercetina, a isoquercetina e a catequina205.
A aplicação de extratos de Artemisia abrotanum L (possui alto teor de quercetina), grânulos de Yupingfeng (uma mistura de raízes vegetais amplamente utilizada na medicina tradicional chinesa) e Perilla frutescens (família da hortelã) por via nasal ou conjuntival foram avaliados por estudos duplo-cego, randomizados, evidenciando alívio dos sintomas da conjuntivite alérgica, com boa tolerância7,205.
Canabioides: a estimulação dos receptores canabioides presentes na conjuntiva ocular (receptores CB1 e CB2) produz um efeito analgésico e anti-inflamatório, reduzindo também a pressão intraocular. O uso de flavonoides e canabioides abre uma série de oportunidades terapêuticas devido à sua eficácia comprovada com poucos efeitos colaterais205.
Outras ervas amplamente utilizadas na medicina tradicional chinesa (Biminna, Bu-Zhong-yi-Qi-Tang, Shi-Bi-Li) ou japonesa (Sho-seiryu-to) demonstraram eficácia in vivo, porém mais estudos são necessários para corroborar sua utilidade clínica206.
Medicina ayurvédica indiana
Existe bibliografia, embora escassa, sobre o uso da medicina ayurvédica, utilizando uma mistura de ervas e comparada com placebo ou medicação. A eficácia e segurança de Triyushnadi Anjana e gotas de cromoglicato foram comparadas, e melhora significativa foi observada no grupo que utilizou medicamento ayurvédico em relação ao cromoglicato, sem efeitos colaterais significativos207. Outras fórmulas com misturas de ervas foram testadas (Aller-7) e comparadas com prednisona e ibuprofeno, com excelentes resultados em animais, mas não há relato de sua eficácia em humanos206.
Acupuntura
A acupuntura é uma das formas mais difundidas da medicina tradicional chinesa no mundo. Segundo ela, a colocação de agulhas em locais já definidos consegue uma redistribuição da energia vital (Qui ou Chi) que constitui o organismo. Tem demonstrado efeito significativo no tratamento da rinoconjuntivite alérgica, melhorando os sintomas oculares e a qualidade de vida, quando comparado ao placebo em estudos randomizados com placebo-controle208-210. A Academia Americana de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço sugere como uma opção de tratamento em pacientes que não desejam utilizar os tratamentos da medicina convencional211. No entanto, devido a potenciais erros metodológicos (padronização de locais, técnica, etc.) e à escassez de disponibilidade de estudos duplo-cegos controlados com placebo que comprovem sua utilidade, pode-se concluir que mais evidências e melhores níveis de padronização são necessários para o tratamento da rinoconjuntivite alérgica206.
Medicina energética
São necessários estudos controlados que possam demonstrar o benefício do uso de técnicas de canalização de energia (Reiki, Qigong), uma vez que seu papel no tratamento de doenças alérgicas ainda não foi demonstrado206.
Homeopatia: a homeopatia parte do princípio de que se a substância que produz um sintoma for incorporada ao corpo em soluções extremamente diluídas do mesmo, consegue-se a resolução da patologia212. Sua prática é amplamente difundida em todo o mundo, e há farta bibliografia sobre sua utilidade no tratamento das doenças alérgicas, embora algumas dessas publicações apresentem problemas metodológicos que dificultam sua comparação. Numerosas publicações mostraram uma melhora significativa quando a administração da homeopatia foi comparada com o placebo ou uma redução no uso de anti-histamínicos e anti-inflamatórios para tratar a rinoconjuntivite alérgica quando administrados junto com eles, tanto em crianças como em adultos e com medicamentos de longa duração de efeito terapêutico213-219. A imunoterapia homeopática, na qual são fornecidas extensas diluições de alérgenos (ácaros, polens), também tem demonstrado sua utilidade no tratamento da conjuntivite alérgica, com rápida resposta terapêutica e baixo custo214-220. Apesar de seu uso difundido em todo o mundo, os MACs oferecem uma resposta clínica aceitável, com poucos efeitos colaterais e menor custo que os medicamentos convencionais, mas geralmente as doses e os procedimentos de administração não são padronizados e a bibliografia em alguns casos é escassa e metodologicamente pobre. Mais estudos de qualidade são necessários para determinar o mecanismo exato de ação, padronizar suas doses e oferecer margens de segurança adequadas.
Probióticos
Estudos recentes avaliaram os efeitos de diferentes preparações de probióticos sobre os sintomas oculares e a qualidade de vida em pacientes com conjuntivite alérgica. Apesar dos efeitos benéficos observados, o pequeno número de estudos e de pacientes envolvidos não permite a generalização destes resultados221,222.
Psicoterapia
Pacientes com formas graves de alergia ocular, como a ceratoconjuntivite vernal (CCV) e ceratoconjuntivite atópica (CCA), podem necessitar de apoio psicológico em função do impacto na qualidade de vida e das limitações impostas pela doença. Uma abordagem colaborativa entre o médico de família, o médico especialista e o psicólogo deve ser considerada nestes casos223.
AVALIAÇÃO DO CONTROLE
O objetivo do tratamento na conjuntivite alérgica é minimizar os efeitos inflamatórios associados à resposta alérgica, promovendo alívio nos sintomas e prevenindo as complicações associadas com o prolongamento dessa inflamação ocular192.
Podemos definir o controle como o estado da doença na qual as manifestações clínicas estão ausentes ou quase completamente resolvidas com a terapia instituída224. A avaliação do controle é parte imprescindível no acompanhamento das doenças crônicas, uma vez que melhoram a tomada de decisão médica e, consequentemente, o tratamento dos pacientes. No caso da conjuntivite alérgica, o acompanhamento deve ser multidisciplinar e realizado, sempre que possível, em conjunto com o oftalmologista. Ainda assim, é importante que os médicos clínicos envolvidos no tratamento (especialistas e generalistas) saibam avaliar de forma uniformizada o controle do paciente sem a necessidade de ferramentas específicas, muitas vezes disponíveis apenas no consultório oftalmológico. Com esse objetivo, foram desenvolvidos questionários clínicos, que podem ser respondidos diretamente pelo paciente (ou pelo seu cuidador, nos casos pediátricos), sendo curtos, de fácil compreensão e de simples execução.
Os questionários de controle para doenças crônicas podem ser baseados em sintomas objetivos e/ou subjetivos, mas também devem, idealmente, avaliar a qualidade de vida do paciente. Como a conjuntivite alérgica frequentemente acontece em associação com outras doenças como asma e rinite alérgica, alguns questionários desenvolvidos para estas patologias também contemplam o controle da conjuntivite alérgica. Podemos citar o RQLQ (Rhinoconjunctivitis Quality of Life Questionnaire)225, o RCAT (Rhinitis Control Assessment Test)226, o escore de sintomas nasais e extranasais (ESN), e a escala visual analógica (EVA). Nesta última, os sintomas são graduados individualmente, em uma escala numérica de 0-10 cm e pontuadas pelo próprio paciente, sendo considerada uma forma simples e prática de avaliação de controle, porém não considera aspectos de qualidade de vida. Quando aplicados em quadros associados com rinite alérgica, os sintomas podem ser graduados em: moderado/grave > 5 e leve ≤ 5227. No caso do RCAT, há versões validadas e traduzidas para várias línguas, além de possuir versões específicas tanto para adultos como para crianças. O documento ARIA (Allergic Rhinitis and its Impact on Asthma)228 apenas sugere a classificação da alergia ocular graduando gravidade e persistência dos sintomas. A gravidade pode ser classificada como "leve", "moderada" ou "grave", com base na presença ou ausência de distúrbios visuais, comprometimento nas atividades cotidianas e outros sintomas que gerem incômodo (Troublesome symptoms).
Porém, quando consideramos a ocorrência apenas da conjuntivite alérgica, a literatura é escassa para ferramentas que a avaliem exclusivamente. A avaliação dos quatro sintomas principais: hiperemia, prurido, edema e lacrimejamento constituem um questionário não validado, chamado TOSS229 (Total Ocular Symptom Score) e que pode, de maneira semelhante ao ESN, avaliar gravidade e monitoramento de tratamento. O único questionário disponível para avaliação de qualidade de vida foi desenvolvido para aplicação em crianças com ceratoconjuntivite vernal, e é denominado QUICK230. Esse questionário gradua frequência dos sintomas de alergia ocular em uma escala de 3 pontos (1 - nunca, 2 - de vez em quando, 3 - sempre), mas pode ser utilizada apenas em uma situação específica da alergia ocular.
Recentemente, Sánchez-Hernandez e cols.231 validaram um questionário (Tabela 5) para avaliação de gravidade e controle clínico da conjuntivite alérgica. Nesse questionário são avaliados: sintomas oculares, escala visual analógica e hiperemia. A avaliação deste último item é realizada através da hiperemia conjuntival e limbar separadamente, utilizando a escala de Efron232 (Figura 8).
Além da escassez de questionários clínicos, a dificuldade para graduação dos sintomas oculares, também ocorre por ser uma avaliação observador-dependente. Por essa razão, recomenda-se que, independentemente da ferramenta escolhida, o médico esteja habituado a utilizar sempre a mesma, conhecendo seus pontos fortes e fracos, melhorando a troca de informações entre os membros da equipe multidisciplinar e beneficiando o acompanhamento do paciente.
Frente ao exposto, há ainda grande necessidade de avançarmos no desenvolvimento de questionários mais completos, que possam mensurar a gravidade e controle dos diferentes tipos de conjuntivite alérgica e nas diferentes faixas etárias233, favorecendo um melhor acompanhamento e controle dos pacientes com alergia ocular.
COMPLICAÇÕES DA CONJUNTIVITE ALÉRGICA
As complicações dependem fortemente do fenótipo da doença e das apresentações clínicas: conjuntivite alérgica sazonal e perene, conjuntivite papilar gigante e conjuntivite de contato bleforralérgica, enquanto outras nem sempre são explicadas pela exposição a alérgenos, como ceratoconjuntivite primaveril e ceratoconjuntivite atópica234.
Existem manifestações clínicas associadas a esta condição com a presença de lesões oculares frequentemente encontradas, tais como: edema do fundo de saco conjuntival, papilas na conjuntiva tarsal, defeito do filme lacrimal, pigmentação peri-límbica, defeito do epitélio da córnea, blefarite, pontos de Horner-Trantas, conjuntivite infecciosa agregada e pterígio235.
Conjuntivite alérgica sazonal ou conjuntivite alérgica perene são acompanhadas por laceração do tipo hialina, edema palpebral e quemose e, dependendo da duração dos sintomas, as complicações associadas são infecciosas, além da síndrome do olho seco que, embora pareça uma complicação não tão séria, pode causar graves lesões da superfície ocular, afetando a qualidade de visão e de vida dos pacientes, com alto custo no atendimento médico devido à alta frequência de consultas e tratamentos235.
Ceratoconjuntivite vernal apresenta complicações como ceratopatia puntiforme, úlceras de córnea, infiltrados conjuntivais e papilas gigantes na conjuntiva tarsal em até 6% dos pacientes. Outras possíveis sequelas são ambliopia e ceratocone, que em casos graves podem necessitar de transplante de córnea. Papilas gigantes que não respondem ao tratamento médico podem ser removidas cirurgicamente em caso de envolvimento da córnea e úlcera em escudo com placa inflamatória, podendo ser necessário debridamento cirúrgico com ou sem transplante de membrana amniótica. A deficiência de células-tronco límbicas, uma complicação rara, pode ser tratada com um aloenxerto limbo conjuntival236.
Na ceratoconjuntivite atópica encontramos achados semelhantes à conjuntivite alérgica, com agravamento do dano palpebral. O acréscimo de alterações inflamatórias crônicas na superfície ocular (cicatriz corneana e neovascularização) e alterações variadas nas pálpebras e na pele periorbital, que vão desde dermatite atópica leve até liquenificação. Complicações: blefaroconjuntivite estafilocócica e ceratite por herpes simplex, catarata, deficiência de células-tronco do limbo, ceratocone, glaucoma, descolamento de retina e tumores da córnea ou conjuntiva236.
OUTRAS COMPLICAÇÕES
Um dos problemas mais comuns é a infecção conjuntival; frequentemente encontramos germes autoinoculantes, como Staphylococcus aureus , Hemophilus influenzae e outros estreptococos.
As infecções virais induzem quadros como conjuntivite folicular aguda, tanto em crianças quanto em adultos, e os vírus associados são adenovírus que induzem ceratoconjuntivite epidêmica e febre, com transmissão por contato direto e se manifesta uma semana após a exposição afetando um dos olhos, e posteriormente em ambos os olhos, causando erosões puntiformes que variam de 1-50 mm com infiltrado epitelial e subepitelial, e o manejo geralmente está relacionado ao uso adequado de esteroides.
A conjuntivite de inclusão é causada por Chlamydia trachomatis e está relacionada a pessoas sexualmente ativas por ser uma doença óculo-genital, pois o nome indica que há inclusão do germe de forma sistêmica, portanto, o manejo oral com macrolídeos é recomendado.
As infecções por herpes vírus também induzem conjuntivite folicular, mas ocasionalmente as manifestações são poucas e devem ser evidenciadas com técnicas de anticorpos fluorescentes. Infecções por vírus Epstein Barr causam conjuntivite folicular ou membranosa com ou sem hemorragias, e os sintomas são típicos de mononucleose associada à febre, linfadenopatia, etc. E quando essa condição aparece, é muito semelhante à ceratite por adenovírus. Eles também podem estar associados a outros vírus de RNA, como Paramyxoviridae, Orthomyxovirida, Togaviridae e Flaviviridae.
Existem complicações por esfregar os olhos cronicamente. Essas complicações são devido a processos biomecânicos que são expressos por mudanças estruturais da córnea e distúrbios ectáticos da córnea, como ceratocone, ceratoglobulina e degeneração marginal pelúcida, com uma predominância evidente de ceratocone causando remodelamento da córnea.
Algumas das complicações são resultado da fricção; como exemplo de glaucoma, uma vez que os picos de pressão intraocular estão relacionados ao atrito. Outro exemplo é hidropisia com ou sem perfuração, prolapso da íris, ruptura da cápsula do cristalino e deslocamento do cristalino intraocular, e descolamento da retina234.
REFERÊNCIAS
1. Geraldini M, Neto HJC, Riedi CA, Rosário NA. Epidemiology of ocular allergy and co-morbidities in adolescents. J Pediatr (Rio J.). 2013;89:354-60. doi: 10.1016/j.jped.2013.01.001.
2. Dinowitz M, Rescigno R, Bielory L. Ocular Allergic Diseases: Differential Diagnosis, Examination Techniques and Testing. In: Kemp SF, Lockey RF, eds. Diagnostic Testing of Allergic Disease, vol. 1. 1ª ed. Basel: Marcel Dekker eds.; 2000. p. 127-50.
3. Shoji J. Ocular allergy test and biomarkers on the ocular surface: Clinical test for evaluating the ocular surface condition in allergic conjunctival diseases. Allergology International. 2020;69:496-504. doi: 10.1016/j.alit.2020.05.003.
4. Dupuis P, Prokopich CL, Hynes A, Kim H. A contemporary look at allergic conjunctivitis. Allergy Asthma Clin Immunol. 2020;16:5. doi: 10.1186/s13223-020-0403-9.
5. Kuruvilla M, Kalangara J, Eun-Hyung Lee F. Neuropathic Pain and Itch Mechanisms Underlying Allergic Conjunctivitis. J Investig Allergol Clin Immunol. 2019;29(5):349-56. doi: 10.18176/jiaci.0320.
6. Meng X-T, Shi Y-Y, Zhang H, Zhou H-Y. The Role of Th17 Cells and IL-17 in Th2 Immune Responses of Allergic Conjunctivitis. Journal of Ophthalmology. 2020;2020:1-9. doi: 10.1155/2020/6917185.
7. Bielory L, Delgado L, Katelaris CH, Leonardi A, Rosario N, Vichyanoud P. ICON. Ann Allergy Asthma Immunol. 2020;124:118-34. doi: 10.1016/j.anai.2019.11.014.
8. Gelardi M, Leo ME, Quaranta VN, Iannuzzi L, Tripodi S, Quaranta N, et al. Clinical characteristics associated with conjunctival inflammation in allergic rhinoconjunctivitis. J Allergy Clin Immunol Pract. 2015;3(3):387-91.e1. doi: 10.1016/j.jaip.2015.01.006.
9. Leonardi A, Castegnaro A, Valerio ALG, Lazzarini D. Epidemiology of allergic conjunctivitis. Curr Opin Allergy Clin Immunol. 2015;15:482-8. doi: 10.1097/ACI.0000000000000204.
10. Hesselmar B, Åberg B, Eriksson B, Åberg N. Allergic rhinoconjunctivitis, eczema, and sensitization in two areas with differing climates. Pediatr Allergy Immunol. 2001;12:208-15. doi: 10.1034/j.1399-3038.2001.012004208.x.
11. Rosário CS, Cardozo CA, Chong-Neto HJ, Chong-Silva DC, Riedi CA, Rosario-Filho NA. Understanding eye allergy. Arq Asma Alerg Imunol. 2020;4(1):78-84. doi: 10.5935/2526-5393.20200006.
12. Bonini S, Coassin M, Aronni S, Lambiase A. Vernal keratoconjunctivitis. Eye. 2004;18:345-51. doi: 10.1038/sj.eye.6700675.
13. Marback PMF, Freitas D de, Paranhos Junior A, Belfort Junior R. Aspectos clínicos e epidemiológicos da conjuntivite alérgica em serviço de referência. Arquivos Brasileiros de Oftalmologia. 2007;70:312-6. doi: 10.1590/S0004-27492007000200022.
14. Bousquet J, Anto JM, Akdis M, Auffray C, Keil T, Momas I, et al. Paving the way of systems biology and precision medicine in allergic diseases: the Me
15. Abelson MB, Schaefer K. Conjunctivitis of allergic origin: Immunologic mechanisms and current approaches to therapy. Survey of Ophthalmology. 1993;38:115-32. doi: 10.1016/0039-6257(93)90036-7.
16. Bielory L. Differential diagnoses of conjunctivitis for clinical allergist-immunologists. Ann Allergy Asthma Immunol. 2007;98:105-15. doi: 10.1016/S1081-1206(10)60681-3.
17. Rosario Filho NA. Reflexões sobre polinose: 20 anos de experiência. Rev Bras Alergia Imunopatol.1997;20:210-3.
18. Vieira FAM. Polinose no Brasil. In: Negreiros B, Unguier C, eds. Alergologia Clínica, vol. I. 1ª ed. Rio de Janeiro: Atheneu; 1995. p. 106-11.
19. Vieira FM, Motta VT. Conjuntivite alérgica polínica em Caxias do Sul, Brasil. Rev Bras Alerg Imunopatol. 2007;31:56-9.
20. Geller-Bernstein C, Portnoy JM. The Clinical Utility of Pollen Counts. Clin Rev Allergy Immunol. 2019;57(3):340-349. doi: 10.1007/s12016-018-8698-8.
21. Bianchi MM, Olabuenaga SE. A 3-year airborne pollen and fungal spores record in San Carlos de Bariloche, Patagonia, Argentina. Aerobiologia. 2006;22:247-57. doi: 10.1007/s10453-006-9037-8.
22. Charpin D, Pichot C, Belmonte J, Sutra J-P, Zidkova J, Chanez P, et al. Cypress Pollinosis: from Tree to Clinic. Clin Rev Allergy Immunol. 2019;56:174-95. doi: 10.1007/s12016-017-8602-y.
23. Núñez R, Carballada F, Lombardero M, Jimeno L, Boquete M. Profilin as an Aeroallergen by Means of Conjunctival Allergen Challenge with Purified Date Palm Profilin. Int Arch Allergy Immunol. 2012;158:115-9. doi: 10.1159/000330822.
24. Pendino P, Agüero C, Cavagnero P, Lopez K, Kriunis I, Molinas J. Aeroallergen sensitization in wheezing children from Rosario, Argentina. World Allergy Organ J. 2011;4:159-63. doi: 10.1097/WOX.0b013e318232df96.
25. Ramon G, Bronfen S, Villamil C, Ferrerlic N, Apphatie S, Barzon S. 1025 Relevant pollens in the etiology of seasonal allergic rhinitis in the city of Bahía Blanca (Argentina) and its surrounding area. J Allergy Clinic Immunol. 1996;97:439. doi: 10.1016/S0091-6749(96)81243-7.
26. Murray MG, Galán C. Effect of the meteorological parameters on the Olea europaea L. pollen season in Bahía Blanca (Argentina). Aerobiologia. 2016;32:541-53. doi: 10.1007/s10453-016-9431-9.
27. Pajarón MJ, Vila L, Prieto I, Resano A, Sanz ML, Oehling AK. Cross-reactivity of Olea europaea with other Oleaceae species in allergic rhinitis and bronchial asthma. Allergy. 1997;52:829-35. doi: 10.1111/j.1398-9995.1997.tb02154.x.
28. Heinzerling L, Frew AJ, Bindslev-Jensen C, Bonini S, Bousquet J, Bresciani M, et al. Standard skin prick testing and sensitization to inhalant allergens across Europe - a survey from the GA2LEN network*. Allergy. 2005;60:1287-300. doi: 10.1111/j.1398-9995.2005.00895.x.
29. Cariñanos P, Ruiz-Peñuela S, Valle AM, de la Guardia CD. Assessing pollination disservices of urban street-trees: The case of London-plane tree (Platanus x hispanica Mill. ex Münchh). Sci Total Environ. 2020 Oct 1;737:139722. doi: 10.1016/j.scitotenv.2020.139722.
30. Balugo Lopez V, Hernandez Garcıa de la Barrena E. Relevance of Clinical Sensitization to Quercus Pollen in Spain? J Allergy Clin Immunol. 2016;137(2 Suppl):AB122. doi: 10.1016/j.jaci.2015.12.528.
31. Ramon GD, Arango N, Barrionuevo LB, Reyes MS, Adamo M, Molina O, et al. Comparison of Grass Pollen Levels in 5 Cities of Argentina. J Allergy Clin Immunol. 2016;137(2 Suppl):AB122. doi: 10.1016/j.jaci.2015.12.530.
32. Ramon GD, Barrionuevo LB, Viego V, Vanegas E, Felix M, Cherrez-Ojeda I. Sensitization to subtropical grass pollens in patients with seasonal allergic rhinitis from Bahia Blanca, Argentina. World Allergy Organ J. 2019 Sep 30;12(9):100062. doi: 10.1016/j.waojou.2019.100062.
33. Ramón GD, Croce VH, Chérrez Ojeda I. Anaphylaxis in a 4-year-old male caused by contact with grasses: a case report. World Allergy Organ J. 2017;10:5. doi: 10.1186/s40413-016-0133-0.
34. Marcó LN, Pirovani M. Relevamiento de flora alergógena en Concepción del Uruguay. Arch alerg inmunol clin. 2009;40(2):44-50.
35. Chang C-J, Yang H-H, Chang C-A, Tsai H-Y. Relationship between Air Pollution and Outpatient Visits for Nonspecific Conjunctivitis. Invest Ophthalmol Vis Sci. 2012;53:429-33. doi: 10.1167/iovs.11-8253.
36. Sun Z, Zhu D. Exposure to outdoor air pollution and its human health outcomes: A scoping review. Plos One. 2019;14:e0216550. doi: 10.1371/journal.pone.0216550.
37. Schraufnagel DE, Balmes JR, Cowl CT, de Matteis S, Jung S-H, Mortimer K, et al. Air Pollution and Noncommunicable Diseases. Chest. 2019;155:409-16. doi: 10.1016/j.chest.2018.10.042.
38. Łatka P, Nowakowska D, Nowomiejska K, Rejdak R. How air pollution affects the eyes - a review. Ophthalmology Journal. 2018;3:58-62. doi: 10.5603/OJ.2018.0032.
39. Fujishima H, Satake Y, Okada N, Kawashima S, Matsumoto K, Saito H. Effects of diesel exhaust particles on primary cultured healthy human conjunctival epithelium. Ann Allergy Asthma Immunol. 2013;110:39-43. doi: 10.1016/j.anai.2012.10.017.
40. Novaes P, do Nascimento Saldiva PH, Kara-José N, Macchione M, Matsuda M, Racca L, et al. Ambient Levels of air pollution induce goblet-cell hyperplasia in human conjunctival epithelium. Environ Health Perspect. 2007;115:1753-6. doi: 10.1289/ehp.10363.
41. Miyazaki D, Fukagawa K, Fukushima A, Fujishima H, Uchio E, Ebihara N, et al. Air pollution significantly associated with severe ocular allergic inflammatory diseases. Scientific Reports. 2019;9:18205. doi: 10.1038/s41598-019-54841-4.
42. Lee H, Kim EK, Kim HY, Kim T. Effects of exposure to ozone on the ocular surface in an experimental model of allergic conjunctivitis. Plos One. 2017;12:e0169209. doi: 10.1371/journal.pone.0169209.
43. Nucci P, Sacchi M, Pichi F, Allegri P, Serafino M, dello Strologo M, et al. Pediatric conjunctivitis and air pollution exposure: a prospective observational study. Seminars in Ophthalmology. 2017;32:407-11. doi: 10.3109/08820538.2015.1115088.
44. Zhong J-Y, Lee Y-C, Hsieh C-J, Tseng C-C, Yiin L-M. Association between the first occurrence of allergic conjunctivitis, air pollution and weather changes in Taiwan. Atmospheric Environment. 2019;212:90-5. doi: 10.1016/j.atmosenv.2019.05.045.
45. Lee J-Y, Kim J-W, Kim E-J, Lee M-Y, Nam C-W, Chung I-S. Spatial analysis between particulate matter and emergency room visits for conjunctivitis and keratitis. Ann Occup Environ Med. 2018;30:41. doi: 10.1186/s40557-018-0252-x.
46. Mimura T, Ichinose T, Yamagami S, Fujishima H, Kamei Y, Goto M, et al. Airborne particulate matter (PM2.5) and the prevalence of allergic conjunctivitis in Japan. Science of The Total Environment. 2014;487:493-9. doi: 10.1016/j.scitotenv.2014.04.057.
47. Fu Q, Mo Z, Lyu D, Zhang L, Qin Z, Tang Q, et al. Air pollution and outpatient visits for conjunctivitis: A case-crossover study in Hangzhou, China. Environmental Pollution. 2017;231:1344-50. doi: 10.1016/j.envpol.2017.08.109.
48. Bourcier T. Effects of air pollution and climatic conditions on the frequency of ophthalmological emergency examinations. Br J Ophthalmol. 2003;87:809-11. doi: 10.1136/bjo.87.7.809.
49. Chen R, Yang J, Zhang C, Li B, Bergmann S, Zeng F, Wang H, Wang B. Global Associations of Air Pollution and Conjunctivitis Diseases: A Systematic Review and Meta-Analysis. Int J Environ Res Public Health. 2019 Sep 28;16(19):3652. doi: 10.3390/ijerph16193652.
50. Abusharha AA, Pearce EI. The Effect of Low Humidity on the Human Tear Film. Cornea. 2013;32:429-34. doi: 10.1097/ICO.0b013e31826671ab.
51. Stapleton F, Alves M, Bunya VY, Jalbert I, Lekhanont K, Malet F, et al. TFOS DEWS II Epidemiology Report. The Ocular Surface. 2017;15:334-65. doi: 10.1016/j.jtos.2017.05.003.
52. Gao Z-X, Song X-L, Li S-S, Lai X-R, Yang Y-L, Yang G, et al. Assessment of DNA Damage and Cell Senescence in Corneal Epithelial Cells Exposed to Airborne Particulate Matter (PM2.5) Collected in Guangzhou, China. Invest Ophthalmol Vis Sci. 2016;57:3093. doi: 10.1167/iovs.15-18839.
53. Chen R, Hu B, Liu Y, Xu J, Yang G, Xu D, et al. Beyond PM2.5: The role of ultrafine particles on adverse health effects of air pollution. Biochim Biophys Acta. 2016;1860:2844-55. doi: 10.1016/j.bbagen.2016.03.019.
54. Li J, Tan G, Ding X, Wang Y, Wu A, Yang Q, et al. A mouse dry eye model induced by topical administration of the air pollutant particulate matter 10. Biomedicine & Pharmacotherapy. 2017;96:524-34. doi: 10.1016/j.biopha.2017.10.032.
55. Singh P, Tyagi M, Kumar Y, Gupta K, Sharma P. Ocular chemical injuries and their management. Oman Journal of Ophthalmology. 2013;6:83. doi: 10.4103/0974-620X.116624.
56. Callejo G, Castellanos A, Castany M, Gual A, Luna C, Acosta MC, et al. Acid-sensing ion channels detect moderate acidifications to induce ocular pain. Pain. 2015;156:483-95. doi: 10.1097/01.j.pain.0000460335.49525.17.
57. Chang C-J, Yang H-H, Chang C-A, Tsai H-Y. Relationship between Air Pollution and Outpatient Visits for Nonspecific Conjunctivitis. Invest Ophthalmol Vis Sci. 2012;53:429. doi: 10.1167/iovs.11-8253.
58. Baïz N, Slama R, Béné M-C, Charles M-A, Kolopp-Sarda M-N, Magnan A, et al. Maternal exposure to air pollution before and during pregnancy related to changes in newborn's cord blood lymphocyte subpopulations. The EDEN study cohort. BMC Pregnancy and Childbirth. 2011;11:87. doi: 10.1186/1471-2393-11-87.
59. Zhang X, M VJ, Qu Y, He X, Ou S, Bu J, et al. Dry eye management: targeting the ocular surface microenvironment. Int J Mol Sci. 2017;18:1398. doi: 10.3390/ijms18071398.
60. Hwang SH, Choi Y-H, Paik HJ, Wee WR, Kim MK, Kim DH. Potential importance of ozone in the association between outdoor air pollution and dry eye disease in South Korea. JAMA Ophthalmology. 2016;134:503. doi: 10.1001/jamaophthalmol.2016.0139.
61. Saxena R, Srivastava S, Trivedi D, Anand E, Joshi S, Gupta SK. Impact of environmental pollution on the eye. Acta Ophthalmologica Scandinavica. 2003;81:491-4. doi: 10.1034/j.1600-0420.2003.00119.x.
62. Malerbi FK, Martins LC, Saldiva PHN, Braga ALF. Ambient levels of air pollution induce clinical worsening of blepharitis. Environmental Research. 2012;112:199-203. doi: 10.1016/j.envres.2011.11.010.
63. Ravilla TD, Gupta S, Ravindran RD, Vashist P, Krishnan T, Maraini G, et al. Use of Cooking Fuels and Cataract in a Population-Based Study: The India Eye Disease Study. Environ Health Perspect. 2016;124:1857-62. doi: 10.1289/EHP193.
64. Pokhrel AK, Smith KR, Khalakdina A, Deuja A, Bates MN. Case-control study of indoor cooking smoke exposure and cataract in Nepal and India. Int J Epidemiol. 2005;34:702-8. doi: 10.1093/ije/dyi015.
65. Adar SD, Klein R, Klein BEK, Szpiro AA, Cotch MF, Wong TY, et al. Air Pollution and the Microvasculature: A Cross-Sectional Assessment of In Vivo Retinal Images in the Population-Based Multi-Ethnic Study of Atherosclerosis (MESA). PLoS Medicine. 2010;7:e1000372. doi: 10.1371/journal.pmed.1000372.
66. Louwies T, Panis LI, Kicinski M, de Boever P, Nawrot TS. Retinal Microvascular Responses to Short-Term Changes in Particulate Air Pollution in Healthy Adults. Environ Health Perspect. 2013;121:1011-6. doi: 10.1289/ehp.1205721.
67. Cortés-Morales G, Velasco-Medina AA, Arroyo-Cruz ME, Velázquez-Sámano G. Frecuencia de sensibilización a aeroalergenos en pacientes con conjuntivitis alérgica estacional y perenne [Frequency of sensitization to aeroallergens in patients with seasonal and perennial allergic conjunctivitis]. Rev Alerg Mex. 2014 Jul-Sep;61(3):141-6.
68. Singh K, Axelrod S, Bielory L. The epidemiology of ocular and nasal allergy in the United States, 1988-1994. J Allergy Clin Immunol. 2010 Oct;126(4):778-83.e6. doi: 10.1016/j.jaci.2010.06.050.
69. Ojeda P, Sastre J, Olaguibel JM, Chivato T; investigators participating in the National Survey of the Spanish Society of Allergology and Clinical Immunology Alergológica 2015. Alergológica 2015: A National Survey on Allergic Diseases in the Adult Spanish Population. J Investig Allergol Clin Immunol. 2018 Jun;28(3):151-64. doi: 10.18176/jiaci.0264.
70. Feng Y, Wang X, Wang F, Liu R, Chen L, Wu S, et al. The Prevalence of Ocular Allergy and Comorbidities in Chinese School Children in Shanghai. Biomed Res Int. 2017;2017:1-11. doi: 10.1155/2017/7190987.
71. Stahl JL, Barney NP. Ocular allergic disease. Curr Opin Allergy Clin Immunol. 2004;4:455-9. doi: 10.1097/00130832-200410000-00020.
72. Weeke ER. Epidemiology of hay fever and perennial allergic rhinitis. Monographs in Allergy. 1987;21:1-20.
73. Leonardi A, Bogacka E, Fauquert JL, Kowalski ML, Groblewska A, Jedrzejczak-Czechowicz M, et al. Ocular allergy: recognizing and diagnosing hypersensitivity disorders of the ocular surface. Allergy. 2012;67:1327-37. doi: 10.1111/all.12009.
74. Chong Neto HJ, Rosário NA. Studying specific IgE: in vivo or in vitro. Allergologia et Immunopathologia. 2009;37:31-5. doi: 10.1016/S0301-0546(09)70249-6.
75. Willumsen N, Holm J, Christensen LH, Würtzen PA, Lund K. The complexity of allergic patients' IgE repertoire correlates with serum concentration of allergen-specific IgE. Clin Exp Allergy. 2012;42:1227-36. doi: 10.1111/j.1365-2222.2012.04009.x.
76. Melioli G, Passalacqua G, Canonica GW, Baena-Cagnani CE, Matricardi P. Component-resolved diagnosis in pediatric allergic rhinoconjunctivitis and asthma. Curr Opin Allergy Clin Immunol. 2013;13:446-51. doi: 10.1097/ACI.0b013e32836274d8.
77. Melioli G, Bonifazi F, Bonini S, Maggi E, Mussap M, Passalacqua G, et al. The ImmunoCAP ISAC molecular allergology approach in adult multi-sensitized Italian patients with respiratory symptoms. Clinical Biochemistry. 2011;44:1005-11. doi: 10.1016/j.clinbiochem.2011.05.007.
78. Rossi RE, Monasterolo G, Operti D, Operti R, Berlen R. Evaluation of IgE antibodies to recombinant pollen allergens(Phl p 1, Phl p 2, and Phl p 5) in a random sample of patients withspecific IgE to Phleum pratense. Allergy. 2000;55:181-4. doi: 10.1034/j.1398-9995.2000.00320.x.
79. Jung JH, Kang IG, Kim ST. Comparison of Component-Resolved Diagnosis by Using Allergen Microarray With the Conventional Tests in Allergic Rhinitis Patients: The First Using in Korea. Clinical and Experimental Otorhinolaryngology. 2015;8:385. doi: 10.3342/ceo.2015.8.4.385.
80. Santosa A, Andiappan AK, Rotzschke O, Wong HC, Chang A, Bigliardi Qi M, et al. Evaluation of the applicability of the Immuno solid phase allergen chip (ISAC) assay in atopic patients in Singapore. Clin Transl Allergy. 2015;5:9. doi: 10.1186/s13601-015-0053-z.
81. Prosperi MCF, Belgrave D, Buchan I, Simpson A, Custovic A. Challenges in interpreting allergen microarrays in relation to clinical symptoms: A machine learning approach. Pediatr Allergy Immunol. 2014;25:71-9. doi: 10.1111/pai.12139.
82. Bonini M, Marcomini L, Gramiccioni C, Tranquilli C, Melioli G, Canonica GW, et al. Microarray evaluation of specific IgE to allergen components in elite athletes. Allergy. 2012:n/a-n/a. doi: 10.1111/all.12029.
83. Panzner P, Vachová M, Vítovcová P, Brodská P, Vlas T. A Comprehensive Analysis of Middle-European Molecular Sensitization Profiles to Pollen Allergens. Int Arch Allergy Immunol. 2014;164:74-82. doi: 10.1159/000362760.
84. Cabrera-Freitag P, Goikoetxea MJ, Beorlegui C, Gamboa P, Gastaminza G, Fernández-Benítez M, et al. Can component-based microarray replace fluorescent enzimoimmunoassay in the diagnosis of grass and cypress pollen allergy? Clin Exp Allergy. 2011;41:1440-6. doi: 10.1111/j.1365-2222.2011.03818.x.
85. Ahlgrim C, Gutermuth J, Onell A, Borres MP, Schäffner I, Darsow U, et al. Comparison of Molecular Multiplex and Singleplex Analysis of IgE to Grass Pollen Allergens in Untreated German Grass Pollen-Allergic Patients. J Investig Allergol Clin Immunol. 2015;25:190-5.
86. Araujo LML, Rosario NA, Mari A. Molecular-based diagnosis of respiratory allergic diseases in children from Curitiba, a city in Southern Brazil. Allergologia et Immunopathologia. 2016;44:18-22. doi: 10.1016/j.aller.2015.03.001.
87. Zeng G, Luo W, Zheng P, Wei N, Huang H, Sun B, et al. Component-Resolved Diagnostic Study of Dermatophagoides Pteronyssinus Major Allergen Molecules in a Southern Chinese Cohort. J Investig Allergol Clin Immunol. 2015;25:343-51.
88. Bronnert M, Mancini J, Birnbaum J, Agabriel C, Liabeuf V, Porri F, et al. Component-resolved diagnosis with commercially available D. pteronyssinus Der p 1, Der p 2 and Der p 10: relevant markers for house dust mite allergy. Clin Exp Allergy. 2012;42:1406-15. doi: 10.1111/j.1365-2222.2012.04035.x.
89. Nieto M, Lafuente I, Calderon R, Uixera S, Pina R, Calaforra S, et al. Component-resolved diagnosis: Performance of specific IgE to Alternaria compared to Alt a 1. Pediatr Allergy Immunol. 2014;25:832-4. doi: 10.1111/pai.12305.
90. Liccardi G, Bilò MB, Manzi F, Piccolo A, di Maro E, Salzillo A. What could be the role of molecular-based allergy diagnostics in detecting the risk of developing allergic sensitization to furry animals? Eur Ann Allergy Clin Immunol. 2015;47:163-7.
91. Asarnoj A, Hamsten C, Wadén K, Lupinek C, Andersson N, Kull I, et al. Sensitization to cat and dog allergen molecules in childhood and prediction of symptoms of cat and dog allergy in adolescence: A BAMSE/MeDALL study. J Allergy Clin Immunol. 2016;137:813-821.e7. doi: 10.1016/j.jaci.2015.09.052.
92. Westman M, Lupinek C, Bousquet J, Andersson N, Pahr S, Baar A, et al. Early childhood IgE reactivity to pathogenesis-related class 10 proteins predicts allergic rhinitis in adolescence. J Allergy Clin Immunol. 2015;135:1199-1206.e11. doi: 10.1016/j.jaci.2014.10.042.
93. Hatzler L, Panetta V, Lau S, Wagner P, Bergmann RL, Illi S, et al. Molecular spreading and predictive value of preclinical IgE response to Phleum pratense in children with hay fever. J Allergy Clin Immunol. 2012;130:894-901.e5. doi: 10.1016/j.jaci.2012.05.053.
94. Baye A, Batellier L, Doan S, Bury T, Vitte J. Multiplex assay of specific IgE antibodies in tear fluids by means of microarray technology. Journal Français d'Ophtalmologie. 2016;39:e183-5. doi: 10.1016/j.jfo.2015.10.012.
95. Leonardi A, Borghesan F, Faggian D, Plebani M. Microarray-based IgE detection in tears of patients with vernal keratoconjunctivitis. Pediatr Allergy Immunol. 2015;26:641-5. doi: 10.1111/pai.12450.
96. Agache I, Bilò M, Braunstahl G-J, Delgado L, Demoly P, Eigenmann P, et al. In vivo diagnosis of allergic diseases-allergen provocation tests. Allergy. 2015;70:355-65. doi: 10.1111/all.12586.
97. Abelson MB, Chambers WA, Smith LM. Conjunctival allergen challenge. A clinical approach to studying allergic conjunctivitis. Arch Ophthalmol. 1990 Jan;108(1):84-8. doi: 10.1001/archopht.1990.01070030090035.
98. Friedlaender MH. Management of ocular allergy. Ann Allergy Asthma Immunol. 1995;75:212-22; quiz 223-4.
99. Fauquert J-L, Jedrzejczak-Czechowicz M, Rondon C, Calder V, Silva D, Kvenshagen BK, et al. Conjunctival allergen provocation test : guidelines for daily practice. Allergy. 2017;72:43-54. doi: 10.1111/all.12986.
100. Mortemousque B, Fauquert JL, Chiambaretta F, Demoly P, Helleboid L, Creuzot-Garcher C, et al. Le test de provocation conjonctival : recommandations pratiques pour le diagnostic des conjonctivites allergiques. Journal Français d'Ophtalmologie. 2006;29:837-46. doi: 10.1016/S0181-5512(06)73857-8.
101. Mourão EMM, Rosário Filho NA. Teste de provocação conjuntival com alérgenos no diagnóstico de conjuntivite alérgica. Rev Bras Alerg Immunopatol. 2011;34:90-6.
102. Leonardi A, Fregona IA, Gismondi M, Daniotti E, Carniel G, Secchi AG. Correlation between conjunctival provocation test (CPT) and systemic allergometric tests in allergic conjunctivitis. Eye. 1990;4:760-4. doi: 10.1038/eye.1990.109.
103. Leonardi A, Battista MC, Gismondi M, Fregona IA, Secchi AG. Antigen sensitivity evaluated by tear-specific and serum-specific IgE, skin tests, and conjunctival and nasal provocation tests in patients with ocular allergic disease. Eye. 1993;7:461-4. doi: 10.1038/eye.1993.93.
104. Leonardi A, Doan S, Fauquert JL, Bozkurt B, Allegri P, Marmouz F, et al. Diagnostic tools in ocular allergy. Allergy. 2017;72:1485-98. doi: 10.1111/all.13178.
105. Montan PG, van Hage-Hamsten M, Zetterström O. Sustained eosinophil cationic protein release into tears after a single high-dose conjunctival allergen challenge. Clin Exp Allergy. 1996;26:1125-30.
106. Abelson MB, Greiner JV. Comparative efficacy of olopatadine 0.1% ophthalmic solution versus levocabastine 0.05% ophthalmic suspension using the conjunctival allergen challenge model. Current Medical Research and Opinion. 2004;20:1953-8. doi: 10.1185/030079904X5724.
107. Krane Kvenshagen B, Jacobsen M, Halvorsen R. Can conjunctival provocation test facilitate the diagnosis of food allergy in children? Allergologia et Immunopathologia. 2010;38:321-6. doi: 10.1016/j.aller.2010.01.007.
108. Möller C, Björksten B, Nilsson G, Dreborg S. The Precision of the Conjunctival Provocation Test. Allergy. 1984;39:37-41. doi: 10.1111/j.1398-9995.1984.tb01931.x.
109. Bonini S, Bonini S, Bucci MG, Berruto A, Adriani E, Balsano F, et al. Allergen dose response and late symptoms in a human model of ocular allergy. J Allergy Clin Immunol. 1990;86:869-76. doi: 10.1016/S0091-6749(05)80148-4.
110. Leonardi A, Motterle L, Bortolotti M. Allergy and the eye. Clin Exp Immunol. 2008;153:17-21. doi: 10.1111/j.1365-2249.2008.03716.x.
111. Núñez JA, Cuesta U. Local conjunctival immunotherapy: the effect of dermatophagoides pteronyssinus local conjunctival immunotherapy on conjunctival provocation test in patients with allergic conjunctivitis. Allergol Immunopathol (Madr). 2000 Nov-Dec;28(6):301-6.
112. Mourão EMM, Rosário NA, Silva L, Shimakura SE. Ocular symptoms in nonspecific conjunctival hyperreactivity. Ann Allergy Asthma Immunol. 2011;107:29-34. doi: 10.1016/j.anai.2011.03.002.
113. Mourão EMM, Rosário NA. Adverse reactions to the allergen conjunctival provocation test. Ann Allergy Asthma Immunol. 2011;107:373-4. doi: 10.1016/j.anai.2011.07.015.
114. Anderson DF, McGill JI, Roche WR. Improving the safety of conjunctival provocation tests. J Allergy Clin Immunol. 1996;98:1000. doi: 10.1016/S0091-6749(96)80022-4.
115. Rodrigues J, Kuruvilla ME, Vanijcharoenkarn K, Patel N, Hom MM, Wallace D v. The spectrum of allergic ocular diseases. Ann Allergy Asthma Immunol. 2021;126:240-54. doi: 10.1016/j.anai.2020.11.016.
116. Tangye SG, Al-Herz W, Bousfiha A, Chatila T, Cunningham-Rundles C, Etzioni A, et al. Human Inborn Errors of Immunity: 2019 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2020;40:24-64. doi: 10.1007/s10875-019-00737-x.
117. Hosseinverdi S, Hashemi H, Aghamohammadi A, Ochs HD, Rezaei N. Ocular Involvement in Primary Immunodeficiency Diseases. J Clin Immunol. 2014;34:23-38. doi: 10.1007/s10875-013-9974-2.
118. Klotz SA, Penn CC, Negvesky GJ, Butrus SI. Fungal and Parasitic Infections of the Eye. Clinical Microbiology Reviews. 2000;13:662-85. doi: 10.1128/CMR.13.4.662.
119. Franklin RM, Winkelstein JA, Seto DSY. Conjunctivitis and Keratoconjunctivitis Associated with Primary Immunodeficiency Diseases. Am J Ophthalmol. 1977;84:563-6. doi: 10.1016/0002-9394(77)90453-6.
120. Boone WB, O'Reilly RJ, Pahwa S, Grimes E, Smithwick EM, Good RA. Acquired CMV chorioretinitis in severe combined immunodeficiency. Clin Immunol Immunopathol. 1978;9:129-33. doi: 10.1016/0090-1229(78)90129-0.
121. Perren BA, Raisanen J, Good WV, Crawford JB. Cytomegalovirus retinitis and optic neuritis in a child with severe combined immunodeficiency syndrome. Retina. 1996;16:117-21. doi: 10.1097/00006982-199616020-00005.
122. Baumal CR, Levin A v, Read SE. Cytomegalovirus retinitis in immunosuppressed children. Am J Ophthalmol. 1999;127:550-8. doi: 10.1016/S0002-9394(99)00031-8.
123. al Ghonaium A, Ziegler JB, Tridgell D. Bilateral chronic conjunctivitis and corneal scarring in a boy with X-linked hypogammaglobulinaemia. J Paediatr Child Health. 1996 Oct;32(5):463-5. doi: 10.1111/j.1440-1754.1996.tb00950.x.
124. Hansel TT, O'Neill DP, Yee ML, Gibson JM, Thompson RA. Infective conjunctivitis and corneal scarring in three brothers with sex linked hypogammaglobulinaemia (Bruton's disease). Br J Ophthalmol. 1990;74:118-20. doi: 10.1136/bjo.74.2.118.
125. Ooi KG-J, Joshua F, Broadfoot A. Recurrent multi-organism keratoconjunctivitis manifesting as a first presentation of common variable immune deficiency (CVID). Ocul Immunol Inflamm. 2007;15:403-5. doi: 10.1080/09273940701486449.
126. Chao J, Yumei Z, Zhiqun W, Yang Z, Xuguang S. Multidrug-resistant bacteria induce recurrent keratoconjunctivitis in a patient with common variable immunodeficiency. Cornea. 2013;32:S39-42. doi: 10.1097/ICO.0b013e3182a2c7e6.
127. Christensen L, McDonnell JT, Singh J. Ocular manifestations of allergic and immunologic diseases. In: Levin AV, Enzenauer RW, eds. The Eye in Pediatric Systemic Disease. Cham: Springer International Publishing; 2017. p. 51-78. doi: 10.1007/978-3-319-18389-3_3.
128. Aghamohammadi A, Cheraghi T, Gharagozlou M, Movahedi M, Rezaei N, Yeganeh M, et al. IgA Deficiency: Correlation Between Clinical and Immunological Phenotypes. J Clin Immunol. 2009;29:130-6. doi: 10.1007/s10875-008-9229-9.
129. Kıratlı HK, Akar Y. Multiple recurrent hordeola associated with selective IgM deficiency. J AAPOS. 2001;5:60-1. doi: 10.1067/mpa.2001.111018.
130. Palestine AG, Meyers SM, Fauci AS, Gallin JI. Ocular Findings in patients with Neutrophil Dysfunction. Am J Ophthalmol. 1983;95:598-604. doi: 10.1016/0002-9394(83)90377-X.
131. Grossniklaus HE, Frank EK, Jacobs G. Chorioretinal lesions in chronic granulomatous disease of childhood. Retina. 1988;8:270-4. doi: 10.1097/00006982-198808040-00009.
132. Panagiotopoulos M, Sönne H. Chronic granulomatous disease and serious unilateral keratitis with bilateral conjunctivitis: a rare case of external ocular disease. Acta Ophthalmologica. 2011;89:e296-7. doi: 10.1111/j.1755-3768.2009.01858.x.
133. Matsuura T, Sonoda K-H, Ohga S, Ariyama A, Nakamura T, Ishibashi T. A Case of Chronic Recurrent Uveitis Associated with Chronic Granulomatous Disease. Japanese Journal of Ophthalmology. 2006;50:287-9. doi: 10.1007/s10384-005-0313-x.
134. Kavehmanesh Z, Matinzadeh ZK, Amirsalari S, Torkaman M, Afsharpayman S, Javadipour M. Leukocyte adhesion deficiency: report of two family related newborn infants. Acta Medica Iranica. n.d.;48:273-6.
135. Ganesh A, Al-Zuhaibi SS, Bialasiewicz AA, Al-Abri R, Ahmed S, Al-Tamemi S, et al. Necrotizing Pseudomonas infection of the ocular adnexa in an infant with leukocyte adhesion defect. J Pediatr Ophthalmol Strabismus. 2007 Jul-Aug;44(4):199-200. doi: 10.3928/01913913-20070701-09.
136. Chang B, Brosnahan D, McCreery K, Dominguez M, Costigan C. Ocular complications of autoimmune polyendocrinopathy syndrome type 1. J AAPOS. 2006 Dec;10(6):515-20. doi: 10.1016/j.jaapos.2006.06.018.
137. Carboni I, Soda R, Bianchi L, Chimenti S. Chronic Mucocutaneous Candidiasis and Alopecia Areata as Cutaneous Expressions of Autoimmune Polyglandular Syndrome Type I. Acta Dermato-Venereologica. 2002;82:68-9. doi: 10.1080/000155502753600993.
138. Rescigno R, Dinowitz M. Ophthalmic manifestations of immunodeficiency states. Clin Rev Allergy Immunol. 2001;20:163-81. doi: 10.1007/s12016-001-0001-7.
139. Grønskov K, Ek J, Brondum-Nielsen K. Oculocutaneous albinism. Orphanet Journal of Rare Diseases. 2007;2:43. doi: 10.1186/1750-1172-2-43.
140. Moin M, Aghamohammadi A, Kouhi A, Tavassoli S, Rezaei N, Ghaffari S-R, et al. Ataxia-Telangiectasia in Iran: Clinical and Laboratory Features of 104 Patients. Pediatric Neurology. 2007;37:21-8. doi: 10.1016/j.pediatrneurol.2007.03.002.
141. Bhisitkul RB. Bloom syndrome: multiple retinopathies in a chromosome breakage disorder. Br J Ophthalmol. 2004;88:354-7. doi: 10.1136/bjo.2002.011643.
142. Podos SM, Einaugler RB, Albert DM, Blaese RM. Ophthalmic Manifestations of the Wiskott-Aldrich Syndrome. Archives of Ophthalmology. 1969;82:322-9. doi: 10.1001/archopht.1969.00990020324005.
143. Miyazaki D, Takamura E, Uchio E, Ebihara N, Ohno S, Ohashi Y, et al. Japanese guidelines for allergic conjunctival diseases 2020. Allergology International. 2020;69:346-55. doi: 10.1016/j.alit.2020.03.005.
144. Bilkhu PS, Wolffsohn JS, Naroo SA, Robertson L, Kennedy R. Effectiveness of nonpharmacologic treatments for acute seasonal allergic conjunctivitis. Ophthalmology. 2014;121:72-8. doi: 10.1016/j.ophtha.2013.08.007.
145. Forister JF, Forister EF, Yeung KK, Ye P, Chung MY, Tsui A, Weissman BA. Prevalence of contact lens-related complications: UCLA contact lens study. Eye Contact Lens. 2009 Jul;35(4):176-80. doi: 10.1097/ICL.0b013e3181a7bda1.
146. Elhers WH, Donshik PC. Giant papillary conjunctivitis. Curr Opin Allergy Clin Immunol. 2008 Oct;8(5):445-9. doi: 10.1097/ACI.0b013e32830e6af0.
147. Leonardi A, Silva D, Perez Formigo D, Bozkurt B, Sharma V, Allegri P, et al. Management of ocular allergy. Allergy. 2019;74:1611-30. doi: 10.1111/all.13786.
148. Rubini N de PM, Wandalsen GF, Rizzo MC v., Aun M v., Chong Neto HJ, Solé D. Guia prático sobre controle ambiental para pacientes com rinite alérgica. Arq Asma Alerg Imunol. 2017;1. doi: 10.5935/2526-5393.20170004.
149. Bousquet J, Schünemann HJ, Togias A, Bachert C, Erhola M, Hellings PW, et al. Next-generation Allergic Rhinitis and Its Impact on Asthma (ARIA) guidelines for allergic rhinitis based on Grading of Recommendations Assessment, Development and Evaluation (GRADE) and real-world evidence. J Allergy Clin Immunol. 2020;145:70-80.e3. doi: 10.1016/j.jaci.2019.06.049.
150. Spector SL, Raizman MB. Conjunctivitis medicamentosa. J Allergy Clin Immunol. 1994;94:134-6. doi: 10.1016/0091-6749(94)90081-7.
151. Papathanassiou M, Giannoulaki V, Tiligada E. Leukotriene antagonists attenuate late phase nitric oxide production during the hypersensitivity response in the conjunctiva. Inflammation Research. 2004;53. doi: 10.1007/s00011-004-1270-4.
152. Bielory L, Schoenberg D. Emerging Therapeutics for Ocular Surface Disease. Curr Allergy Asthma Rep. 2019 Feb 28;19(3):16. doi: 10.1007/s11882-019-0844-8.
153. Bielory L, Bielory BP, Wagner RS. Ocular Allergy. In: Leung DYM, Szefler SJ, Bonilla FA, Akdis CA, Sampson H, eds. Pediatric Allergy: Principles and Practice, vol. 1. 3ª ed. New York: Elsevier; 2015. p. 482-97.
154. Wan KH-N, Chen LJ, Rong SS, Pang CP, Young AL. Topical Cyclosporine in the Treatment of Allergic Conjunctivitis. Ophthalmology. 2013;120:2197-203. doi: 10.1016/j.ophtha.2013.03.044.
155. González-López JJ, López-Alcalde J, Morcillo Laiz R, Fernández Buenaga R, Rebolleda Fernández G. Topical cyclosporine for atopic keratoconjunctivitis. Cochrane Database Syst Rev. 2012. doi: 10.1002/14651858.CD009078.pub2.
156. Secchi AG, Tognon MS, Leonardi A. Topical Use of Cyclosporine in the Treatment of Vernal Keratoconjunctivitis. Am J Ophthalmol. 1990;110:641-5. doi: 10.1016/S0002-9394(14)77061-8.
157. Utine CA, Stern M, Akpek EK. Clinical Review: Topical Ophthalmic Use of Cyclosporin A. Ocul Immunol Inflamm. 2010;18:352-61. doi: 10.3109/09273948.2010.498657.
158. Pucci N, Novembre E, Cianferoni A, Lombardi E, Bernardini R, Caputo R, et al. Efficacy and safety of cyclosporine eyedrops in vernal keratoconjunctivitis. Ann Allergy Asthma Immunol. 2002;89:298-303. doi: 10.1016/S1081-1206(10)61958-8.
159. Pucci N, Caputo R, Mori F, de Libero C, di Grande L, Massai C, et al. Long-Term Safety and Efficacy of Topical Cyclosporine in 156 Children with Vernal Keratoconjunctivitis. Int J Immunopathol Pharmacol. 2010;23:865-71. doi: 10.1177/039463201002300322.
160. Leonardi A, Borghesan F, Faggian D, Secchi A, Plebani M. Eosinophil cationic protein in tears of normal subjects and patients affected by vernal keratoconjunctivitis. Allergy. 1995;50:610-3. doi: 10.1111/j.1398-9995.1995.tb01209.x.
161. Cetinkaya A, Akova YA, Dursun D, Pelit A. Topical cyclosporine in the management of shield ulcers. Cornea. 2004 Mar;23(2):194-200. doi: 10.1097/00003226-200403000-00014.
162. Daniell M. Randomised controlled trial of topical ciclosporin A in steroid dependent allergic conjunctivitis. Br J Ophthalmol. 2006;90:461-4. doi: 10.1136/bjo.2005.082461.
163. Ozcan AA, Ersoz TR, Dulger E. Management of severe allergic conjunctivitis with topical cyclosporin A 0.05% Eyedrops. Cornea. 2007;26:1035-8. doi: 10.1097/ICO.0b013e31812dfab3.
164. Lambiase A, Leonardi A, Sacchetti M, Deligianni V, Sposato S, Bonini S. Topical cyclosporine prevents seasonal recurrences of vernal keratoconjunctivitis in a randomized, double-masked, controlled 2-year study. J Allergy Clin Immunol. 2011;128:896-897.e9. doi: 10.1016/j.jaci.2011.07.004.
165. Ebihara N, Ohashi Y, Uchio E, Okamoto S, Kumagai N, Shoji J, et al. A large prospective observational study of novel cyclosporine 0.1% aqueous ophthalmic solution in the treatment of severe allergic conjunctivitis. J Ocul Pharmacol Ther. 2009 Aug;25(4):365-72. doi: 10.1089/jop.2008.0103.
166. Leonardi A, Doan S, Amrane M, Ismail D, Montero J, Németh J, et al. A Randomized, Controlled Trial of Cyclosporine A Cationic Emulsion in Pediatric Vernal Keratoconjunctivitis. Ophthalmology. 2019;126:671-81. doi: 10.1016/j.ophtha.2018.12.027.
167. Bremond-Gignac D, Doan S, Amrane M, Ismail D, Montero J, Németh J, et al. Twelve-month results of cyclosporine a cationic emulsion in a randomized study in patients with pediatric vernal keratoconjunctivitis. Am J Ophthalmol. 2020;212:116-26. doi: 10.1016/j.ajo.2019.11.020.
168. Rikkers SM, Holland GN, Drayton GE, Michel FK, Torres MF, Takahashi S. Topical tacrolimus treatment of atopic eyelid disease. Am J Ophthalmol. 2003;135:297-302. doi: 10.1016/S0002-9394(02)01982-7.
169. Vichyanond P, Tantimongkolsuk C, Dumrongkigchaiporn P, Jirapongsananuruk O, Visitsunthorn N, Kosrirukvongs P. Vernal keratoconjunctivitisResult of a novel therapy with 0.1% topical ophthalmic FK-506 ointment. J Allergy Clin Immunol. 2004;113:355-8. doi: 10.1016/j.jaci.2003.10.065.
170. Virtanen HM, Reitamo S, Kari M, Kari O. Effect of 0.03% tacrolimus ointment on conjunctival cytology in patients with severe atopic blepharoconjunctivitis: a retrospective study. Acta Ophthalmologica Scandinavica. 2006;84:693-5. doi: 10.1111/j.1600-0420.2006.00699.x.
171. Attas-Fox L, Barkana Y, Iskhakov V, Rayvich S, Gerber Y, Morad Y, et al. Topical Tacrolimus 0.03% Ointment for Intractable Allergic Conjunctivitis: An Open-Label Pilot Study. Current Eye Research. 2008;33:545-9. doi: 10.1080/02713680802149115.
172. Ohashi Y, Ebihara N, Fujishima H, Fukushima A, Kumagai N, Nakagawa Y, et al. A Randomized, Placebo-Controlled Clinical Trial of Tacrolimus Ophthalmic Suspension 0.1% in Severe Allergic Conjunctivitis. J Ocul Pharmacol Ther. 2010;26:165-74. doi: 10.1089/jop.2009.0087.
173. Zhai J, Gu J, Yuan J, Chen J. Tacrolimus in the Treatment of Ocular Diseases. BioDrugs. 2011;25:89-103. doi: 10.2165/11587010-000000000-00000.
174. Labcharoenwongs P, Jirapongsananuruk O, Visitsunthorn N, Kosrirukvongs P, Saengin P, Vichyanond P. A double-masked comparison of 0.1% tacrolimus ointment and 2% cyclosporine eye drops in the treatment of vernal keratoconjunctivitis in children. Asian Pac J Allergy Immunol. 2012;30:177-84.
175. Pucci N, Caputo R, di Grande L, de Libero C, Mori F, Barni S, et al. Tacrolimus vs. cyclosporine eyedrops in severe cyclosporine-resistant vernal keratoconjunctivitis: A randomized, comparative, double-blind, crossover study. Pediatr Allergy Immunol. 2015;26:256-61. doi: 10.1111/pai.12360.
176. Miyazaki D, Fukushima A, Ohashi Y, Ebihara N, Uchio E, Okamoto S, et al. Steroid-Sparing Effect of 0.1% tacrolimus eye drop for treatment of shield ulcer and corneal epitheliopathy in refractory allergic ocular diseases. Ophthalmology. 2017;124:287-94. doi: 10.1016/j.ophtha.2016.11.002.
177. Nivenius E, van der Ploeg I, Jung K, Chryssanthou E, van Hage M, Montan PG. Tacrolimus ointment vs steroid ointment for eyelid dermatitis in patients with atopic keratoconjunctivitis. Eye. 2007;21:968-75. doi: 10.1038/sj.eye.6702367.
178. Zribi H, Descamps V, Hoang-Xuan T, Crickx B, Doan S. Dramatic improvement of atopic keratoconjunctivitis after topical treatment with tacrolimus ointment restricted to the eyelids. Journal of the European Academy of Dermatology and Venereology. 2009;23:489-90. doi: 10.1111/j.1468-3083.2008.02933.x.
179. Al-Amri AM. Long-term Follow-up of Tacrolimus Ointment for Treatment of Atopic Keratoconjunctivitis. Am J Ophthalmol. 2014;157:280-6. doi: 10.1016/j.ajo.2013.10.006.
180. Yazu H, Fukagawa K, Shimizu E, Sato Y, Fujishima H. Long-term outcomes of 0.1% tacrolimus eye drops in eyes with severe allergic conjunctival diseases. Allergy Asthma Clin Immunol. 2021;17:11. doi: 10.1186/s13223-021-00513-w.
181. Hoang-Xuan T, Prisant O, Hannouche D, Robin H. Systemic Cyclosporine A in Severe Atopic Keratoconjunctivitis. Ophthalmology. 1997;104:1300-5. doi: 10.1016/S0161-6420(97)30144-4.
182. Agache I, Lau S, Akdis CA, Smolinska S, Bonini M, Cavkaytar O, et al. EAACI Guidelines on Allergen Immunotherapy: House dust mite-driven allergic asthma. Allergy. 2019 May;74(5):855-873. doi: 10.1111/all.13749.
183. Cox L, Nelson H, Lockey R, Calabria C, Chacko T, Finegold I, et al. Allergen immunotherapy: A practice parameter third update. J Allergy Clin Immunol. 2011;127:S1-55. doi: 10.1016/j.jaci.2010.09.034.
184. Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy. J Allergy Clin Immunol. 2007;119:780-9. doi: 10.1016/j.jaci.2007.01.022.
185. Scadding GK, Durham SR, Mirakian R, Jones NS, Leech SC, Farooque S, et al. BSACI guidelines for the management of allergic and non-allergic rhinitis. Clin Exp Allergy. 2007;38:19-42. doi: 10.1111/j.1365-2222.2007.02888.x.
186. Calderon MA, Alves B, Jacobson M, Hurwitz B, Sheikh A, Durham S. Allergen injection immunotherapy for seasonal allergic rhinitis. Cochrane Database Syst Rev. 2007. doi: 10.1002/14651858.CD001936.pub2.
187. Passalacqua G, Canonica GW. Sublingual immunotherapy for allergic respiratory diseases: efficacy and safety. Immunol Allergy Clin North Am. 2011;31:265-77. doi: 10.1016/j.iac.2011.03.002.
188. Sayed KM, Kamel AG, Ali AH. One-year evaluation of clinical and immunological efficacy and safety of sublingual versus subcutaneous allergen immunotherapy in allergic conjunctivitis. Graefes Arch Clin Exp Ophthalmol. 2019;257:1989-96. doi: 10.1007/s00417-019-04389-w.
189. Lin SY, Erekosima N, Kim JM, Ramanathan M, Suarez-Cuervo C, Chelladurai Y, et al. Sublingual Immunotherapy for the Treatment of Allergic Rhinoconjunctivitis and Asthma. JAMA. 2013;309:1278. doi: 10.1001/jama.2013.2049.
190. Shamji MH, Layhadi JA, Sharif H, Penagos M, Durham SR. Immunological Responses and Biomarkers for Allergen-Specific Immunotherapy Against Inhaled Allergens. J Allergy Clin Immunol Pract. 2021;9:1769-78. doi: 10.1016/j.jaip.2021.03.029.
191. Cohon A, Arruda LK, Martins MA, Guilherme L, Kalil J. Evaluation of BCG administration as an adjuvant to specific immunotherapy in asthmatic children with mite allergy. J Allergy Clin Immunol. 2007;120:210-3. doi: 10.1016/j.jaci.2007.04.018.
192. Dupuis P, Prokopich CL, Hynes A, Kim H. A contemporary look at allergic conjunctivitis. Allergy Asthma Clin Immunol. 2020;16:5. doi: 10.1186/s13223-020-0403-9.
193. Williams PB, Sheppard Jr JD. Omalizumab: a future innovation for treatment of severe ocular allergy? Expert Opinion on Biological Therapy. 2005;5:1603-9. doi: 10.1517/14712598.5.12.1603.
194. Doan S, Amat F, Gabison E, Saf S, Cochereau I, Just J. Omalizumab in Severe Refractory Vernal Keratoconjunctivitis in Children: Case Series and Review of the Literature. Ophtalmol Ther. 2017;6:195-206. doi: 10.1007/s40123-016-0074-2.
195. Wollenberg A, Ariens L, Thurau S, van Luijk C, Seegräber M, de Bruin-Weller M. Conjunctivitis occurring in atopic dermatitis patients treated with dupilumab-clinical characteristics and treatment. J Allergy Clin Immunol Pract. 2018;6:1778-1780.e1. doi: 10.1016/j.jaip.2018.01.034.
196. Barnes AC, Blandford AD, Perry JD. Cicatricial ectropion in a patient treated with dupilumab. Am J Ophthalmol. Case Rep. 2017;7:120-2. doi: 10.1016/j.ajoc.2017.06.017.
197. Qiu J, Grine K. Complementary and alternative treatment for allergic conditions. Primary Care. 2016;43:519-26. doi: 10.1016/j.pop.2016.04.012.
198. Land MH, Wang J. Complementary and Alternative Medicine Use Among Allergy Practices: Results of a Nationwide Survey of Allergists. J Allergy Clin Immunol Pract. 2018;6:95-98.e3. doi: 10.1016/j.jaip.2017.01.017.
199. Sharma P, Singh G. A review of plant species used to treat conjunctivitis. Phytotherapy Research. 2002;16:1-22. doi: 10.1002/ptr.1076.
200. Thomet OAR, Simon H-U. Petasins in the treatment of allergic diseases: results of preclinical and clinical studies. Int Arch Allergy Immunol. 2002;129:108-12. doi: 10.1159/000065884.
201. Schapowal A. Randomised controlled trial of butterbur and cetirizine for treating seasonal allergic rhinitis. BMJ. 2002;324:144-144. doi: 10.1136/bmj.324.7330.144.
202. Stoss M, Michels C, Peter E, Beutke R, Gorter RW. Prospective Cohort Trial of Euphrasia Single-Dose Eye Drops in Conjunctivitis. J Altern Complement Med. 2000;6:499-508. doi: 10.1089/acm.2000.6.499.
203. Rubio-Pina J, Vazquez-Flota F. Pharmaceutical applications of the benzylisoquinoline alkaloids from Argemone mexicana L. Curr Top Med Chem. 2013;13:2200-7. doi: 10.2174/15680266113139990152.
204. Shin T, Kim S, Suk K, Ha J, Kim I, Lee M, et al. Anti-allergic effects of on mast cell-mediated allergy model. Toxicol Appl Pharmacol. 2005;209:255-62. doi: 10.1016/j.taap.2005.04.011.
205. Bielory L, Tabliago NRA. Flavonoid and cannabinoid impact on the ocular surface. Curr Opin Allergy Clin Immunol. 2020;20:482-92. doi: 10.1097/ACI.0000000000000673.
206. Kapoor S, Bielory L. Allergic rhinoconjunctivitis: Complementary treatments for the 21st century. Curr Allergy Asthma Rep. 2009;9:121-7. doi: 10.1007/s11882-009-0018-1.
207. Dhiman K, Sharma G, Singh S. A clinical study to assess the efficacy of Triyushnadi Anjana in Kaphaja Abhishyanda with special reference to vernal keratoconjunctivitis. Ayu. 2010;31:466. doi: 10.4103/0974-8520.82044.
208. Xue CC, English R, Zhang JJ, da Costa C, Li CG. Effect of acupuncture in the treatment of seasonal allergic rhinitis: a randomized controlled clinical trial. Am J Chin Med. 2002;30:1-11. doi: 10.1142/S0192415X0200020X.
209. Xue CC, Li CG, Hügel HM, Story DF. Does acupuncture or Chinese herbal medicine have a role in the treatment of allergic rhinitis? Curr Opin Allergy Clin Immunol. 2006;6:175-9. doi: 10.1097/01.all.0000225156.29780.36.
210. Ng DK, Chow P, Ming S, Hong S, Lau S, Tse D, et al. A Double-blind, randomized, placebo-controlled trial of acupuncture for the treatment of childhood persistent allergic rhinitis. Pediatrics. 2004;114:1242-7. doi: 10.1542/peds.2004-0744.
211. Seidman MD, Gurgel RK, Lin SY, Schwartz SR, Baroody FM, Bonner JR, et al. Clinical Practice Guideline. Otolaryngology-Head and Neck Surgery. 2015;152:S1-43. doi: 10.1177/0194599814561600.
212. Bielory L, Heimall J. Review of complementary and alternative medicine in treatment of ocular allergies. Curr Opin Allergy Clin Immunol. 2003;3:395-9. doi: 10.1097/00130832-200310000-00013.
213. Bellavite P. Advances in homeopathy and immunology: a review of clinical research. Frontiers in Bioscience. 2011;S3:1363. doi: 10.2741/230.
214. Bellavite P, Ortolani R, Pontarollo F, Piasere V, Benato G, Conforti A. Immunology and Homeopathy. 4. Clinical Studies - Part 2. Evid Based Complement Alternat Med. 2006;3:397-409. doi: 10.1093/ecam/nel046.
215. Weiser M, Gegenheimer LH, Klein P. A randomized equivalence trial comparing the efficacy and safety of Luffa comp.-Heel nasal spray with cromolyn sodium spray in the treatment of seasonal allergic rhinitis. Complement Med Res. 1999;6:142-8. doi: 10.1159/000021239.
216. Goossens M, Laekeman G, Aertgeerts B, Buntinx F. Evaluation of the quality of life after individualized homeopathic treatment for seasonal allergic rhinitis. A prospective, open, non-comparative study. Homeopathy. 2009;98:11-6. doi: 10.1016/j.homp.2008.11.008.
217. Gründling C, Schimetta W, Frass M. Real-life effect of classical homeopathy in the treatment of allergies: A multicenter prospective observational study. Wiener Klinische Wochenschrift. 2012;124:11-7. doi: 10.1007/s00508-011-0104-y.
218. Ullman D, Frass M. A review of homeopathic research in the treatment of respiratory allergies. Altern Med Rev. 2010;15:48-58.
219. Rossi E, Picchi M, Bartoli P, Panozzo M, Cervino C, Nurra L. Homeopathic therapy in pediatric atopic diseases: short- and long-term results. Homeopathy 2016;105:217-24. doi: 10.1016/j.homp.2016.03.001.
220. Kim LS, Riedlinger JE, Baldwin CM, Hilli L, Khalsa SV, Messer SA, et al. Treatment of seasonal allergic rhinitis using homeopathic preparation of common allergens in the southwest region of the US: A randomized, controlled clinical trial. Annals of Pharmacotherapy. 2005;39:617-24. doi: 10.1345/aph.1E387.
221. Hara Y, Shiraishi A, Sakane Y, Takezawa Y, Kamao T, Ohashi Y, et al. Effect of mandarin orange yogurt on allergic conjunctivitis induced by conjunctival allergen challenge. Invest Ophthalmol Vis Sci. 2017;58:2922. doi: 10.1167/iovs.16-21206.
222. Dennis-Wall JC, Culpepper T, Nieves C, Rowe CC, Burns AM, Rusch CT, et al. Probiotics (Lactobacillus gasseri KS-13, Bifidobacterium bifidum G9-1, and Bifidobacterium longum MM-2) improve rhinoconjunctivitis-specific quality of life in individuals with seasonal allergies: a double-blind, placebo-controlled, randomized trial. Am J Clin Nutr. 2017;105:758-67. doi: 10.3945/ajcn.116.140012.
223. Burroni AG, Maio M. Ocular allergies: a psychodynamic approach. Curr Opin Allergy Clin Immunol. 2008;8:461-5. doi: 10.1097/ACI.0b013e32830f1dad.
224. Sánchez-Hernández MC, Montero J, Rondon C, Benitez del Castillo JM, Velázquez E, Herreras JM, et al. Consensus document on allergic conjunctivitis (DECA). J Investig Allergol Clin Immunol. 2015;25:94-106.
225. Juniper EF, Guyatt GH. Development and testing of a new measure of health status for clinical trials in rhinoconjunctivitis. Clin Exp Allergy. 1991 Jan;21(1):77-83. doi: 10.1111/j.1365-2222.1991.tb00807.x.
226. Schatz M, Meltzer EO, Nathan R, Derebery MJ, Mintz M, Stanford RH, et al. Psychometric validation of the Rhinitis Control Assessment Test: a brief patient-completed instrument for evaluating rhinitis symptom control. Ann Allergy Asthma Immunol. 2010;104:118-24. doi: 10.1016/j.anai.2009.11.063.
227. Bousquet PJ, Combescure C, Neukirch F, Klossek JM, Méchin H, Daures J-P, et al. Original article: Visual analog scales can assess the severity of rhinitis graded according to ARIA guidelines. Allergy. 2007;62:367-72. doi: 10.1111/j.1398-9995.2006.01276.x.
228. Bousquet J, Khaltaev N, Cruz AA, Denburg J, Fokkens WJ, Togias A, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008*. Allergy. 2008;63:8-160. doi: 10.1111/j.1398-9995.2007.01620.x.
229. Bielory L. Ocular symptom reduction in patients with seasonal allergic rhinitis treated with the intranasal corticosteroid mometasone furoate. Ann Allergy Asthma Immunol. 2008;100:272-9. doi: 10.1016/S1081-1206(10)60453-X.
230. Sacchetti M, Baiardini I, Lambiase A, Aronni S, Fassio O, Gramiccioni C, et al. Development and Testing of the Quality of Life in Children with Vernal Keratoconjunctivitis Questionnaire. Am J Ophthalmol. 2007;144:557-563.e2. doi: 10.1016/j.ajo.2007.06.028.
231. Sánchez-Hernández MC, Navarro AM, Colás C, del Cuvillo A, Sastre J, Mullol J, et al. Validation of the DECA criteria for allergic conjunctivitis severity and control. Clin Transl Allergy. 2020;10:43. doi: 10.1186/s13601-020-00349-4.
232. Efron N, Morgan PB, Katsara SS. Validation of grading scales for contact lens complications. Ophthalmic Physiol Opt. 2001 Jan;21(1):17-29.
233. Rodrigues J, Kuruvilla ME, Vanijcharoenkarn K, Patel N, Hom MM, Wallace D v. The spectrum of allergic ocular diseases. Ann Allergy Asthma Immunol. 2021;126:240-54. doi: 10.1016/j.anai.2020.11.016.
234. Villegas BV, Benitez-Del-Castillo JM. Current Knowledge in Allergic Conjunctivitis. Turk J Ophthalmol. 2021 Feb 25;51(1):45-54. doi: 10.4274/tjo.galenos.2020.11456.
235. Aguilar-Angeles D, Lima-Gómez V, Rojo-Gutiérrez MI, Bermejo-Guevara MA, González-Ibarra M, López-Valladares KE. [Ocular findings most frequently found in patients with allergic rhinoconjunctivitis]. Cir Cir. 2007 Jan-Feb;75(1):13-7.
236. Ben-Eli H, Erdinest N, Solomon A. Pathogenesis and complications of chronic eye rubbing in ocular allergy. Curr Opin Allergy Clin Immunol. 2019;19:526-34. doi: 10.1097/ACI.0000000000000571.