Número Atual: Outubro-Dezembro 2020 - Volume 4 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Metotrexato em crianças e adolescentes com dermatite atópica: série de casos
Methotrexate in children and adolescents with atopic dermatitis: a case series
Alana Ferraz Diniz; Dayanne Mota Veloso Bruscky; Ana Carla Augusto Moura Falcão; Ana Caroline Cavalcanti Dela Bianca Melo; Décio Medeiros Peixoto; Emanuel Sávio Cavalcanti Sarinho
DOI: 10.5935/2526-5393.20200068
Hospital das Clínicas da Universidade Federal de Pernambuco, Centro de Pesquisas em Alergia e Imunologia Clínica - Recife, PE, Brasil
Endereço para correspondência:
Alana Ferraz Diniz
E-mail: alanafdiniz@gmail.com
Submetido em: 02/11/2020
Aceito em: 27/11/2020
RESUMO
INTRODUÇÃO: A dermatite atópica é uma doença inflamatória crônica da pele que nas suas formas moderadas e graves afeta profundamente a qualidade de vida dos seus portadores e familiares. O metotrexato tem sido indicado off-label para casos graves e refratários em crianças e adolescentes, pois é uma opção terapêutica acessível e de baixo custo. Existe uma escassez de publicações envolvendo a medicação, sobretudo na faixa etária pediátrica.
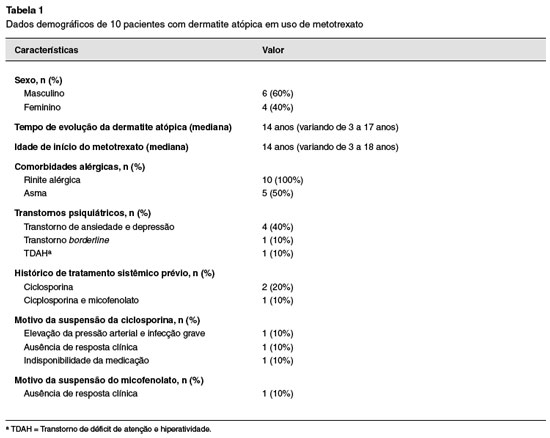
OBJETIVO E MÉTODO: O presente estudo busca avaliar as características clínicas das crianças e adolescentes em uso atual ou prévio de metotrexato para tratamento de dermatite atópica moderada ou grave. Foram incluídos 10 pacientes, 60% do gênero masculino, mediana de idade no início do metotrexato de 14 anos (variando de 3 a 18 anos), e mediana do tempo de evolução da dermatite atópica de 14 anos (variando de 3 a 17 anos). Rinite alérgica e asma em 100% e 50% casos, respectivamente, e transtornos psíquicos em 60%.
RESULTADOS: Seis pacientes obtiveram melhora clínica com mediana de tempo de 9 meses (variando de 4 a 14 meses) e mediana do Scoring Atopic Dermatitis inicial de 50,5 (IIQ 13,8) e de 32,5 (IIQ 24,3) após 12 a 15 meses de tratamento. Efeitos adversos foram observados em 20% dos casos, e suspensão do metotrexato em apenas um paciente.
CONCLUSÃO: Nesta série de casos com dez pacientes houve melhora clínica em seis, com poucos efeitos adversos, sendo uma alternativa terapêutica válida.
Descritores: Dermatite atópica, metotrexato, criança, adolescente
INTRODUÇÃO
A dermatite atópica é uma doença inflamatória crônica da pele com prevalência média no Brasil de 6,8% para escolares, 4,7% para adolescentes e até 18% dos casos são considerados graves1,2. Afeta profundamente a qualidade de vida dos seus portadores e familiares, principalmente em razão do prurido cutâneo, dos distúrbios do sono e do estigma social3,4.
Quando o acometimento cutâneo é significativo, o impacto na qualidade de vida dos pacientes pediátricos é comparado a outras doenças crônicas, como fibrose cística e encefalopatia hipóxico-isquêmica não progressiva, e estudos ressaltam a associação com transtorno de ansiedade e depressão, déficit de atenção e hiperatividade nas crianças e, inclusive, suicídios em adolescentes4-7. Acrescente-se que a repercussão social da doença moderada e grave é exacerbada pelo fato dos custos com o tratamento da dermatite atópica poderem ser substanciais8.
O metotrexato tem sido indicado off-label para casos graves e refratários na pediatria, pois é uma opção terapêutica acessível, de baixo custo, e assim algumas vezes é considerada para a criança ou adolescente com dermatite atópica9-12. Os efeitos adversos incluem fibrose pulmonar, estomatites, citopenias, aumento do risco infeccioso e intolerância gastrointestinal (sendo mais comuns náuseas) e elevação das enzimas hepáticas10,11.
Um estudo randomizado controlado para tratamento de dermatite atópica grave em crianças comparou a ciclosporina com metotrexato e ambas foram consideradas efetivas13. Existe uma escassez de publicações, sobretudo na faixa etária pediátrica, e apenas pequenos estudos têm avaliado a eficácia e segurança clínica do uso do metotrexato no grupo citado6,11,14. O presente estudo busca avaliar as características clínicas das crianças e adolescentes em uso atual ou prévio de metotrexato para tratamento de dermatite atópica moderada ou grave.
RELATOS DOS CASOS
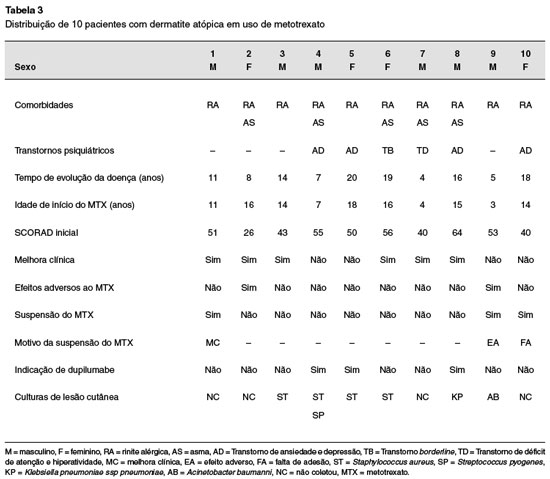
As características da série de casos estudada, os antecedentes pessoais e as particularidades do uso do metotrexato estão apresentados sumariamente nas Tabelas 1, 2 e 3. Incluídos 10 pacientes, 6 do sexo masculino, com mediana de idade no início do metotrexato de 14 anos (variação de 3 a 18 anos) e mediana do tempo de evolução da doença de 14 anos (variação de 3 a 17 anos). Doenças alérgicas associadas como rinite ocorreram em todos os casos, enquanto a asma esteve presente em 5 pacientes, e em 6 havia diagnóstico de transtornos psíquicos associados (quatro com transtorno de ansiedade e depressão, um com transtorno borderline, e um com transtorno de déficit de atenção e hiperatividade). Três pacientes foram submetidos a tratamentos sistêmicos prévios, dos quais todos fizeram uso de ciclosporina e apenas um paciente fez uso de micofenolato mofetil. A ciclosporina foi suspensa por elevação da pressão arterial e infecção grave em um paciente, e por ausência de resposta em outro paciente. O micofenolato mofetil foi suspenso por ausência de melhora clínica após dois anos de uso.
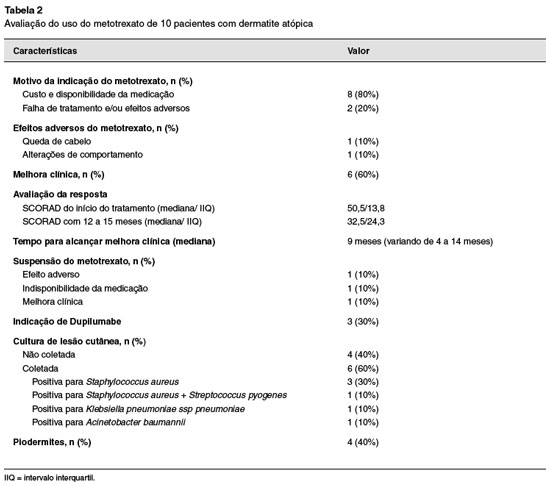
O motivo da indicação do metotrexato foi efeito adverso e falha terapêutica da terapia imunossupressora em dois casos, e indicado nos demais pacientes pelo custo da medicação e acessibilidade. Todos os pacientes realizaram reposição de ácido fólico e exames laboratoriais de controle a cada 3 meses, a dose inicial foi de 0,2 mg/kg/semana progredindo 0,7 mg/kg/semana (máximo de 25 mg/semana), sendo o ajuste de doses realizado de acordo com a evolução clínica, SCORAD e ausência de efeitos adversos. A terapia básica com hidratação e controle de fatores exacerbantes foi mantida, e os pacientes fizeram uso de corticoterapia tópica e antibioticoterapia sistêmica, quando necessário.
Melhora clínica foi observada em 6 pacientes com mediana de tempo para alcançá-la de 9 meses (variação de 4 a 14 meses), e a mediana do SCORAD inicial caiu de 50,5 (IIQ 13,8) para 32,5 (IIQ 24,3) após 12 a 15 meses de tratamento.
Não foram registrados episódios infecciosos graves nestes 10 pacientes. Durante o período analisado, seis pacientes realizaram cultura de lesão cutânea, das quais três foram positivos para Staphylococcus aureus, um foi positivo para S. aureus associado a Streptococcus pyogenes (o mesmo paciente apresentou culturas positivas isoladamente para S. aureus), outro foi positivo para Klebsiella pneumoniae spp pneumoniae e outro para Acinetobacter baumannii. Quatro pacientes apresentaram piora das lesões cutâneas compatíveis com piodermites.
Efeitos adversos foram observados em dois pacientes, relatados queda de cabelo e alteração de comportamento. Em relação à alteração de comportamento, uma paciente apresentou irritabilidade excessiva e humor depressivo, com piora cerca de 12 a 24h após a ingestão da medicação e desaparecimento dos sintomas após suspensão do metotrexato.
Até a finalização do estudo, sete pacientes continuavam a fazer uso do metotrexato e a indicação de imunobiológico ocorreu em três pacientes.
DISCUSSÃO
O metotrexato tem sido frequentemente prescrito em crianças apesar dos estudos limitados nessa faixa etária14. Purvis e cols., em estudo observacional descritivo publicado em 2019, mostraram que o uso de metotrexato para dermatite atópica grave em crianças e adolescentes foi efetivo em 83% dos casos7. Da mesma forma, Anderson e cols. também em 2019, mostraram efetividade de 76,4%6. Taieb e cols. e Deo e cols. mostraram 53% e 75% de melhora respectivamente, e, em consonância com a literatura, observamos melhora clínica em seis pacientes9,15.
A taxa de efeitos adversos com o uso do metotrexato nessa faixa etária mostrou-se bastante variável entre os estudos com metodologia semelhante (de 9% a 50,9% dos pacientes), com suspensão da droga em apenas uma pequena parcela dos casos, principalmente por alterações hematológicas, náuseas e alterações de enzimas hepáticas6,7,9,15. O nosso estudo mostrou casuísta de eventos adversos dentro do encontrado na literatura, levando à descontinuação da medicação em apenas um paciente, ressaltando a boa tolerabilidade do metotrexato neste grupo de crianças. É interessante observar que nenhum paciente do estudo apresentou os efeitos adversos mais comuns relatados do metotrexato. Talvez o controle laboratorial rigoroso, o aumento da dose condicionada a resultados laboratoriais dentro da normalidade e o seguimento regular desses pacientes foram determinantes para esse achado.
Dvorakova e cols., em estudo retrospectivo, observaram que o metotrexato tinha um início de ação mais longo do que a ciclosporina, mas com tempo livre de doença maior após suspensão da droga e o tempo médio para o primeiro sinal de melhora foi de 11,3 semanas, variando de 3 a 24 semanas14. Em nossos pacientes a mediana de tempo para melhora clínica foi em torno de nove meses, e todos iniciaram com doses mínimas da medicação, com ajuste gradual.
Um ponto notável no acompanhamento dos pacientes portadores de dermatite atópica são as infecções cutâneas, mais frequentes do que na população em geral. As infecções podem levar a exacerbações, falhas terapêuticas e dificuldade de controle de doença, sobretudo no contexto do desenvolvimento de superantígenos2. Os agentes mais comumente discutidos são o S. aureus, presente em mais de 90% dos pacientes com dermatite atópica, e os fungos, sobretudo do gênero malassezia2,5. Em estudo de Anderson e cols., foi observado que 47% dos pacientes adquiriram pelo menos uma infecção cutânea enquanto tomavam metotrexato, sendo o agente mais encontrado o S. aureus6. Nossos pacientes seguiram essa tendência, pois o S. aureus foi o agente mais encontrado, associado ou isoladamente.
CONCLUSÃO
Nesta série de casos com 10 pacientes houve melhora clínica em 6, com poucos efeitos adversos, sendo assim uma alternativa terapêutica a ser considerada nesta faixa etária. As limitações deste estudo estão relacionadas à pequena amostragem e à obtenção de dados a partir de prontuários. Entretanto, corrobora para a necessidade de ensaios clínicos que envolvam metotrexato no tratamento sistêmico da dermatite atópica em crianças e adolescentes, o que vai possibilitar melhor compreensão dos seus efeitos e aplicabilidade, tendo em vista o impacto social, financeiro e psíquico desta doença.
REFERÊNCIAS
1. Hanifin JM, Reed ML, Drake LA, Koo J, Lebwohl MG, Leung DYM, et al. A population-based survey of eczema prevalence in the United States. Dermatitis. 2007;18(2):82-91.
2. Antunes AA, Solé D, Carvalho VO, Bau AEK, Kuschnir FC, Mallozi MC, et al. Guia prático de atualização em dermatite atópica - Parte I: etiopatogenia, clínica e diagnóstico. Posicionamento conjunto da Associação Brasileira de Alergia e Imunologia e da Sociedade Brasileira de Pediatria. Arq Asma, Alerg e Imunol. 2017;1(2):131-56.
3. Brar KK, Nicol NH, Boguniewicz M. Strategies for Successful Management of Severe Atopic Dermatitis. J Allergy Clin Immunol Pract [Internet]. 2019;7(1):1-16. Disponível em: https://doi.org/10.1016/j.jaip.2018.10.021.
4. Silverberg JI. Comorbidities and the impact of atopic dermatitis. Ann Allergy, Asthma Immunol [Internet]. 2019;123(2):144-51. Disponível em: https://doi.org/10.1016/j.anai.2019.04.020
5. Weidinger S, Novak N. Atopic dermatitis. Lancet [Internet]. 2016;387(10023):1109-22. Disponível em: http://dx.doi.org/10.1016/S0140-6736(15)00149-X.
6. Anderson K, Putterman E, Rogers RS, Patel D, Treat JR, Castelo-Soccio L. Treatment of severe pediatric atopic dermatitis with methotrexate: A retrospective review. Pediatr Dermatol. 2019;36(3):298-302.
7. Purvis D, Lee M, Agnew K, Birchall N, Dalziel SR. Long-term effect of methotrexate for childhood atopic dermatitis. J Paediatr Child Health. 2019;55(12):1487-91.
8. Boguniewicz M, Fonacier L, Guttman-Yassky E, Ong PY, Silverberg J, Farrar JR. Atopic dermatitis yardstick: Practical recommendations for an evolving therapeutic landscape. Ann Allergy, Asthma Immunol [Internet]. 2018;120(1):10-22.e2. Disponível em: https://doi.org/10.1016/j.anai.2017.10.039.
9. Taieb Y, Baum S, Ben Amitai D, Barzilai A, Greenberger S. The use of methotrexate for treating childhood atopic dermatitis: a multicenter retrospective study. J Dermatolog Treat [Internet]. 2019;30(3):240-4. Disponível em: http://dx.doi.org/10.1080/09546634.2018.150886.
10. Awasthi S, Rothe MJ, Eichenfield LF. Atopic dermatitis: Kids are not just little people. Clin Dermatol [Internet]. 2015;33(6):594-604. Disponível em: http://dx.doi.org/10.1016/j.clindermatol.2015.09.002.
11. Carvalho VO, Solé D, Antunes AA, Bau AEK, Kuschnir FC, Mallozi MC, et al. Guia prático de atualização em dermatite atópica - Parte II: abordagem terapêutica. Posicionamento conjunto da Associação Brasileira de Alergia e Imunologia e da Sociedade Brasileira de Pediatria. Arq Asma, Alerg e Imunol. 2017;1(2):131-56.
12. Puig L. Methotrexate: New therapeutic approaches. Actas Dermosifiliogr. 2014;105(6):583-9.
13. El-Khalawany MA, Hassan H, Shaaban D, Ghonaim N, Eassa B. Methotrexate versus cyclosporine in the treatment of severe atopic dermatitis in children: A multicenter experience from Egypt. Eur J Pediatr. 2013;172(3):351-6.
14. Dvorakova V, O'Regan GM, Irvine AD. Methotrexate for Severe Childhood Atopic Dermatitis: Clinical Experience in a Tertiary Center. Pediatr Dermatol. 2017;34(5):528-34.
15. Deo M, Yung A, Hill S, Rademaker M. Methotrexate for treatment of atopic dermatitis in children and adolescents. Int J Dermatol. 2014;53(8):1037-41.