Número Atual: Outubro-Dezembro 2020 - Volume 4 - Número 4
Editorial
Biomarcadores podem orientar a escolha de imunobiológicos no tratamento da asma
Biomarkers may guide the choice of biologics in asthma treatment
Rosana Câmara Agondi
DOI: 10.5935/2526-5393.20200060
Disciplina de Imunologia Clínica e Alergia da FMUSP, São Paulo, SP, Brasil
Nos últimos anos, agentes imunobiológicos foram aprovados para o tratamento da asma com o objetivo de se obter maior eficácia e menor frequência de efeitos colaterais dos medicamentos convencionais, principalmente os corticoides (sistêmicos ou inalados). O uso frequente de corticoides sistêmicos (exacerbações de asma ≥ 2 por ano) e/ou o uso de corticoide inalado em doses elevadas por períodos prolongados, como ocorre na asma grave, estão associados a diversos efeitos colaterais, que incluem osteoporose, obesidade, diabetes, catarata, hipertensão e distúrbios psicológicos/psiquiátricos.
Os imunobiológicos são agentes terapêuticos, de alto peso molecular, sintetizados por organismos vivos. Eles atuam sobre moléculas específicas (terapia-alvo) e, portanto, os efeitos colaterais tendem a ser menos frequentes. Os anticorpos monoclonais são um exemplo de terapia imunobiológica, e vários deles são recomendados no step 5 do tratamento da asma pela GINA (Global Initiative for Asthma). O omalizumabe (anti-IgE) foi adicionado às recomendações da GINA em 2002, o mepolizumabe (anti-IL-5) em 2016, o reslizumabe (anti-IL-5) e benralizumabe (anti-IL-5R) em 2017 e, a partir de 2019, também foi incluído o dupilumabe (anti-IL-4R). Como identificar o anticorpo monoclonal ideal para cada paciente não é uma tarefa fácil. Muitos biomarcadores são sugeridos na literatura para auxiliar na escolha deste monoclonal ideal. Um biomarcador é um indicador mensurável que desempenhe um papel importante nos diagnóstico, prognóstico e tratamento das doenças. Sessenta a 70% dos pacientes apresentam asma de perfil T2, cuja fisiopatologia envolve uma resposta via células T helper 2 (Th2) ou células linfoides inatas-2 (ILC2). O perfil Th2 envolve uma fase de sensibilização a um aeroalérgeno, com ativação de linfócitos B que passam a secretar IgE específica para este alérgeno. Estas IgEs, posteriormente, se ligam aos seus receptores de alta afinidade nos basófilos e mastócitos e estas células liberam diversas citocinas que, dentre as muitas funções, atraem eosinófilos para o trato respiratório.
Quando as células envolvidas são as ILC2s, vários estímulos, como vírus, bactérias, poluentes e alérgenos, atuam no epitélio respiratório que passa a secretar citocinas denominadas alarminas (IL-25, IL-33 e TSLP) que, por sua vez, ativam as células ILC2. Em ambas as vias (Th2 e ILC2), as principais citocinas envolvidas são as IL-4, IL-5 e IL-13. As citocinas IL-4 e IL-13 direcionam a produção de IgE e a quimiotaxia de eosinófilos para a mucosa respiratória, e a IL-5 participa da maturação, ativação e sobrevida dos eosinófilos. Portanto, todas estas citocinas e células envolvidas na resposta T2 se tornaram alvos importantes para o tratamento da asma. O desafio é encontrar quais biomarcadores poderiam demonstrar, com exatidão, a participação destas células e moléculas na fisiopatologia da asma do indivíduo.
Com razão, a eosinofilia é considerada um biomarcador muito importante para comprovar uma inflamação T2, mas, rotineiramente, não se consegue quantificar estes eosinófilos na mucosa respiratória. Porém, outros exames podem substituir esta investigação, e um exemplo seria a pesquisa através do escarro induzido. Altos níveis de eosinófilos no escarro estão associados à asma não controlada, à asma mais grave e a exacerbações mais frequentes da asma. A eosinofilia pulmonar depende principalmente da IL-5, mas também da IL-4. As quimiocinas eotaxinas 1, 2 e 3 regulam seletivamente a migração de eosinófilos. As IL-4 e IL-13 induzem a expressão de eotaxinas pelo epitélio brônquico, fibroblastos e musculatura lisa brônquica e, juntamente com a IL-5, participam do recrutamento seletivo de eosinófilos para as vias aéreas.
Price DB e cols., em 2015, mostraram que o nível sérico de eosinófilos estaria associado a exacerbações de asma e/ou ao controle da asma, ou seja, os eosinófilos periféricos aumentados, a partir de 300 células/μL, estariam associados a maior chance de exacerbar e, consequentemente, menor controle da asma.
A pesquisa desta eosinofilia, portanto, poderia ser realizada através de biopsia de mucosa respiratória, escarro induzido, eosinofilia periférica e, também, através da pesquisa da fração exalada de óxido nítrico (FeNO). Tradicionalmente, o FeNO é considerado um marcador substituto para a inflamação eosinofílica. Os níveis de FeNO sinalizam a atividade local da IL-4 e IL-13 na mucosa brônquica, porque essas citocinas aumentam a regulação do óxido nítrico sintase induzida (iNOS) no epitélio respiratório. Os níveis aumentados de FeNO e o aumento da contagem de eosinófilos no sangue estão associados à diminuição da função pulmonar e à asma não controlada quando comparados aos pacientes com níveis normais. A eosinofilia depende principalmente da IL-5, enquanto a via da IL-4/IL-13 parece não afetar a contagem de eosinófilos no sangue. Por outro lado, o bloqueio da IL-5 com um anticorpo monoclonal reduz significativamente a eosinofilia sistêmica, porém, não afeta os níveis de óxido nítrico exalado.
O FeNO tem várias utilidades clínicas, e seus níveis elevados predizem resposta ao corticoide inalado; quando o FeNO encontra-se elevado no paciente em tratamento com corticoide inalado, deve-se considerar a má aderência ao tratamento.
A IgE total elevada e a IgE específica positiva para aeroalérgenos direcionam para uma asma de perfil inflamatório T2, sendo que a IgE específica positiva confirma a asma alérgica. Entretanto, os níveis de IgE total se correlacionam fracamente com a gravidade da doença.
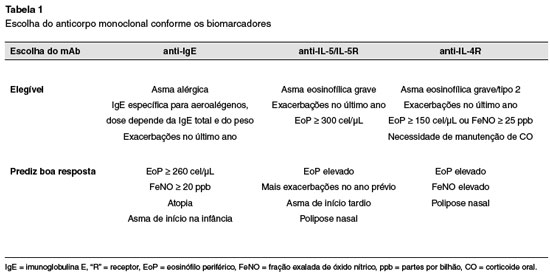
A orientação da GINA para a escolha do anticorpo monoclonal conforme os biomarcadores estão na Tabela 1.
Em suma, os biomarcadores disponíveis até o momento poderiam, de certa forma, orientar a escolha dos imunobiológicos no tratamento da asma. Porém, futuramente, com o maior entendimento da fisiopatologia da asma, novos e mais precisos biomarcadores poderão ser utilizados para que, cada vez mais, se faça a medicina personalizada.
REFERÊNCIAS
1. www.ginasthma.org [Internet]. Acessado em junho de 2020.
2. Hossain SF, Huang M, Ono N, Morita A, Kanaya S, Amin AU. Development of a biomarker database toward performing disease classification and finding disease interrelations. Database (Oxford) 2021;2021:baab011. https://doi.org/10.1093/database/baab011
2. Price DB, Rigazio A, Campbell JD, Bleecker ER, Corrigan CJ, Thomas M, et al. Blood eosinophil count and prospective annual asthma disease burden: a UK cohort study. Lancet Respir Med. 2015;3:849-58.
3. Malinovschi A, Janson C, Borres M, Alving K. Simultaneously increased fraction of exhaled nitric oxide levels and blood eosinophil counts relate to increased asthma morbidity. J Allergy Clin Immunol. 2016;138:1301-8.
4. Yang M, Hogan SP, Mahalingam S, Pope SM, Zimmermann N, Fulkerson P, et al. Eotaxin-2 and IL-5 cooperate in the lung to regulate IL-13 production and airway eosinophilia and hyperreactivity. J Allergy Clin Immunol. 2003;112:935-43.