Número Atual: Abril-Junho 2020 - Volume 4 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Terapia nutricional de paciente com ataxia-telangiectasia: relato de caso
Nutrition therapy of a patient with ataxia-telangiectasia: case report
Talita Lemos Neves Barreto; Juliana Fernandez Santana Meneses; Roseli Oselka Saccardo Sarni
DOI: 10.5935/2526-5393.20200033
Universidade Federal de São Paulo, Departamento de Pediatria - São Paulo, SP, Brasil
Endereço para correspondência:
Talita Lemos Neves Barreto
E-mail: talita.lemos@unifesp.br
Submetido em: 23/04/2020
Aceito em: 04/05/2020
RESUMO
Neste artigo relatamos a terapia nutricional de um paciente com ataxia-telangiectasia (A-T) utilizando a gastrostomia (GTM) como via alternativa para alimentação. Paciente do sexo masculino, 13 anos de idade, com diagnóstico clínico de A-T aos 6 anos. Aos 8 anos e 7 meses o paciente foi identificado com risco nutricional (ZIMC/I: -1,67). Após 1 ano, evoluiu de forma desfavorável (ZIMC/I: -2,51) apesar da intervenção nutricional, sendo indicada a GTM aos 9 anos e 11 meses. No entanto, em decorrência da dificuldade de aceitação dos pais, o procedimento foi realizado somente quando o adolescente completou 11 anos e 7 meses. Inicialmente foi prescrita para oferta pela GTM dieta enteral normocalórica e normoproteica, correspondendo a 45,8% da necessidade energética diária. Após um mês, com estabilidade metabólica, houve a transição para uma dieta enteral hipercalórica e hiperproteica, fornecendo 91,6% da necessidade energética diária. Após 6 meses com a GTM, verificou-se ganho de peso total de 3,3 Kg (ZIMC/I -2,97), após 1 ano de 4,7 Kg (ZIMC/I -2,59), e após 1 ano e 9 meses de 6,7 Kg (ZIMC/I -2,63). Apesar da desnutrição nos pacientes com A-T ter origem multifatorial, o uso da GTM como via alternativa para alimentação por esse paciente resultou em uma evolução favorável dos seus indicadores antropométricos, sendo relatadas poucas intercorrências com a sua utilização. Portanto, sugere-se que pacientes com A-T devam ser monitorados periodicamente por equipe multiprofissional visando à identificação precoce de potenciais agravos.
Descritores: Ataxia telangiectasia, terapia nutricional, gastrostomia.
INTRODUÇÃO
A ataxia-telangiectasia (A-T) é uma doença neurodegenerativa rara de herança autossômica recessiva1. Tem início geralmente na primeira infância e possui uma incidência de 1:40.000 nascidos vivos nos Estados Unidos2. A A-T é causada por variantes no gene ATM (ataxia telangiectasia mutated ) codificado no cromossomo 11q22-23, cujo produto, a proteína ATM, uma serina/treonina quinase, possui como função principal manter a estabilidade genômica responsável por reconhecer e corrigir erros na duplicação do DNA e controlar o ciclo celular3.
O fenótipo da A-T envolve degeneração neuronal progressiva, telangiectasias oculares e cutâneas, graus variáveis de imunodeficiência, suscetibilidade ao câncer, radiossensibilidade, desnutrição, retardo do crescimento, envelhecimento precoce, resistência insulínica, diabetes, alterações hepáticas, manifestações de disfunção mitocondrial, respostas inadequadas ao estresse oxidativo e risco para o desenvolvimento de doenças cardiovasculares4-10.
Diante desse fenótipo, a A-T é considerada uma doença multissistêmica, e por ainda não existir cura para a neurodegeneração progressiva, o tratamento é realizado através de atendimento especializado multidisciplinar individualizado para as necessidades de cada paciente. As terapias de suporte utilizadas são baseadas no tratamento dos sintomas com o intuito de restaurar a qualidade de vida dos pacientes, por meio principalmente da preservação da independência e capacidade de realização das atividades diárias11.
A maioria dos pacientes com A-T, principalmente os com a forma clássica da doença, apresentam desnutrição mesmo com consumo adequado de energia. A etiologia do comprometimento nutricional é multifatorial, com ênfase na participação do estresse oxidativo. Dentre os fatores envolvidos, também se destacam a gravidade do comprometimento neurológico, a inatividade física, as infecções recorrentes, a piora progressiva da deglutição, o consumo alimentar inadequado quanti e qualitativamente, e as alterações hormonais12. Em relação à composição corporal, ocorre preservação da massa gorda e redução expressiva da massa magra, com piora progressiva com a evolução da doença7,9.
Os pacientes com A-T desde as fases iniciais da doença devem ser monitorados do ponto de vista nutricional, e as intervenções, inicialmente por via oral, precocemente implantadas. Em situações de disfagia e/ou quando não há boa resposta às intervenções por via oral, deve-se prescrever uma via alternativa para alimentação13. Por se tratar de uma via mais fisiológica, a gastrostomia (GTM) seria a mais indicada, permitindo a oferta adequada da nutrição enteral a longo prazo, contrariamente ao uso de sondas enterais, resultando em melhorias significativas clínicas, no estado nutricional e composição corporal e na qualidade de vida de crianças com déficits neurológicos14, incluindo pacientes com A-T.
O objetivo desse trabalho foi relatar a terapia nutricional de um paciente com A-T utilizando a GTM como via alternativa para alimentação.
RELATO DO CASO
Paciente do sexo masculino, com 13 anos, apresentou alteração da marcha aos 2 anos e as telangiectasias oculares e cutâneas aos 4 anos, sendo realizado o diagnóstico clínico de A-T aos 6 anos. Além da A-T, possui asma, rinite alérgica intermitente, intolerância à lactose, disfagia leve e, na evolução da doença, apresentou linfoma de grandes células B (diagnosticado em maio de 2018). Faz uso de imunoglobulina humana intravenosa desde 2011. Iniciou acompanhamento no ambulatório de Imunologia Clínica do Departamento de Pediatria da Universidade Federal de São Paulo (UNIFESP/EPM) em 2012, quando tinha 7 anos.
O paciente possuía aos 7 anos e 9 meses peso de 21,8 Kg (IMC: 14,5 Kg/m2, ZIMC/I: -0,86, ZP/I: -0,98). Aos 8 anos e 7 meses, o peso era de 21,5 Kg (IMC: 13,8 Kg/m2, ZIMC/I: -1,67, e ZP/I: -1,68) apresentando risco nutricional, sendo prescrita suplementação lipídica (2 colheres de sobremesa por dia de azeite de oliva extravirgem equivalente a 180 Kcal) e com suplemento nutricional adequado para a idade hipercalórico e normoproteico duas vezes ao dia (equivalente a 422,7 Kcal) por via oral, totalizando 602,7 Kcal, fornecendo 45,8% da necessidade energética estimada (EER=1316,1 Kcal/dia), proposta pela Dietary Reference Intake - DRI15.
Após 1 ano, apesar das intervenções nutricionais realizadas por via oral, aos 9 anos e 11 meses o seu peso era de 21,8 Kg (IMC 13,2 Kg/m2, ZIMC/I: -2,51 e ZP/I: -2,43), sendo indicada a GTM pela equipe médica e de nutricionistas do ambulatório de Imunologia Clínica do Departamento de Pediatria da UNIFESP/EPM. Aos 10 anos e 9 meses seu peso era de 22,2 Kg (IMC: 12,9 Kg/m2 e ZIMC/I -3,06), apresentando um comprometimento importante do indicador antropométrico IMC para idade, compatível com desnutrição grave.
No entanto, somente com 11 anos e 7 meses foi realizada a GTM, após 2 anos da sua indicação, por resistência dos pais em aceitar o procedimento. Para sensibilizá-los e auxiliar na aceitação do procedimento, foram feitas diferentes abordagens com utilização de vídeos e contato da família com outras famílias de pacientes que já utilizavam a via alternativa de alimentação com sucesso.
Quinze dias após o procedimento da GTM, o paciente apresentou ganho de peso de 1,6 Kg, com peso de 23,8 Kg (IMC: 12,6 Kg/m2 e ZIMC/I -3,65). Inicialmente foi prescrita dieta normocalórica (1kcal/ mL) e normoproteica no volume de 150 mL, 4 vezes ao dia, totalizando 600 kcal/dia, atingindo 45,8% da necessidade energética (EER = 1.309,6 Kcal/dia). O restante da energia foi obtida por via oral, que sempre foi incentivada em conjunto com a GTM, pois o paciente apresentava apenas disfagia leve.
Após um mês, com a estabilização metabólica e hidroeletrolítica, foi prescrita dieta hipercalórica (1,5 kcal/mL) e hiperproteica no volume de 200 mL, 4 vezes ao dia, totalizando 1.200 kcal/dia, fornecendo 91,6% da necessidade energética. No entanto, após aumento do volume e da oferta energética, o paciente apresentou dor abdominal, distensão, vômitos e diarreia, sendo recomendado que a infusão da dieta fosse realizada por gotejamento, e não mais em bolus, com melhora significativa dos sintomas. Após estabilização, houve troca da dieta por outra com oferta de fibras.
Após 6 meses da implantação da GTM, verificouse ganho de peso total de 3,3 Kg, com peso de 25,5 Kg (IMC: 13,5 Kg/m2 e ZIMC/I -2,97). Após 1 ano, houve ganho ponderal total de 4,7 Kg, com peso de 26,9 Kg (IMC: 14,1 Kg/m2 e ZIMC/I -2,59), sendo a dieta ofertada hipercalórica (1,5 kcal/mL) e normoproteica no volume de 200 mL, 2 vezes ao dia, totalizando 600 kcal/dia e fornecendo 45% da necessidade energética (EER = 1.330,5 Kcal/dia).
Após 1 ano e 9 meses, apresentou ganho de peso total de 6,7 Kg, com peso de 28,9 Kg (IMC: 14,4 Kg/ m2 e ZIMC/I -2,63), com infusão de dieta hipercalórica (1,5 kcal/mL) e normoproteica no volume de 200 mL, 3 vezes ao dia, totalizando 900 kcal/dia e fornecendo 66% da necessidade energética (EER = 1.358 Kcal/ dia). A evolução do ZIMC/I do paciente dos 7 aos 13 anos é apresentada na Figura 1.
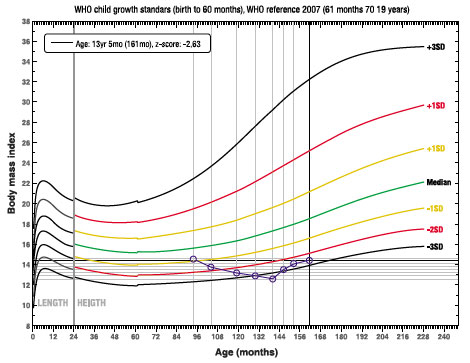
Figura 1. Curva do índice de massa corporal para idade.
DISCUSSÃO
Diante desse relato de caso fica evidente que apesar da desnutrição nos pacientes A-T ter origem multifatorial, a terapia nutricional apropriada, por vezes com a utilização de vias alternativas para a alimentação como a GTM, resulta em evolução favorável dos indicadores antropométricos, sendo relatadas poucas intercorrências com a sua utilização. Dessa forma, foi possível ajustar a oferta energética de macro e micronutrientes via GTM com preservação do consumo oral, aspecto importante a se considerar do ponto de vista da saúde emocional do paciente e sua família.
No serviço de Imunologia Clínica do Departamento de Pediatria da UNIFESP/EPM a implantação da GTM em pacientes com A-T é indicada nas seguintes situações: quando ocorre piora da condição nutricional evoluindo para desnutrição, apesar da orientação e intervenção nutricional, incluindo a utilização de suplementos nutricionais por via oral (consumo energético < 70% da EER de acordo com a DRI) pelo período mínimo de 6 meses; na presença de disfagia moderada ou grave com risco de aspiração pulmonar e/ou grave comprometimento nutricional; e para pacientes desnutridos com rápida deterioração neurológica. A Figura 2 apresenta um fluxograma de terapia nutricional para pacientes com A-T elaborado pela equipe multiprofissional do serviço de Imunologia Clínica da UNIFESP/EPM.
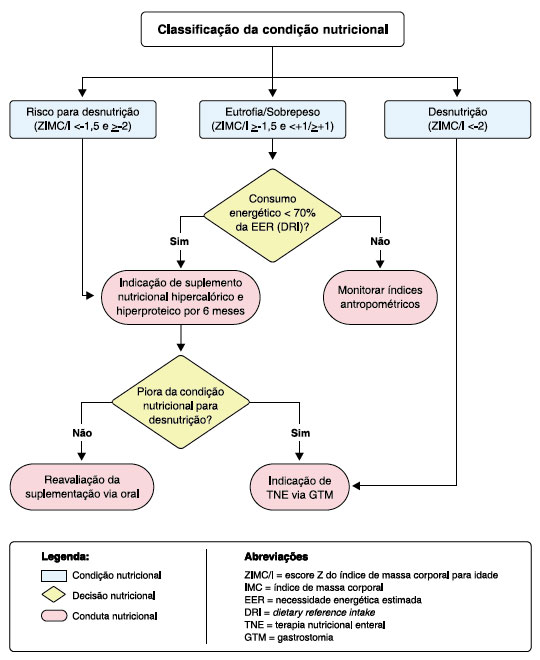
Figura 2. Fluxograma de terapia nutricional para pacientes com ataxia-telangiectasia.
Estudos realizados que avaliaram a condição nutricional de pacientes A-T, observaram uma redução importante nos percentis do índice de massa corporal (IMC) após os 4 anos de idade nos meninos, e aos 7 anos nas meninas, e do peso, estatura e escore Z do IMC por idade (ZIMC/I) após os 8 anos de idade16,17. Portanto, para ambos os sexos a idade ideal para implantação da GTM, se indicada, seria antes do estirão puberal entre 8 e 10 anos, pois nessa idade os pacientes com A-T já tendem a apresentar algum comprometimento nutricional, mas em geral ainda não apresentam complicações importantes, além de possuírem uma maior probabilidade de recuperação do estado nutricional como constatado por alguns estudos de seguimento16,17.
Outro estudo, que avaliou a composição corporal por meio da impedância bioelétrica e a força muscular de 25 pacientes A-T, com mediana de idade de 13 anos, comparados a 26 controles saudáveis, identificou menor IMC, força muscular e um maior comprometimento da massa magra a partir dos 12 anos nos pacientes A-T. Estes fatores foram considerados importantes para o aumento da fadiga nesses casos18. No caso desse paciente, não foi avaliada a composição corporal, no entanto, foi observado ganho de peso e melhora do indicador antropométrico ZIMC/I (de -3,06 para -2,63) desde o início da utilização da GTM, e após quase dois anos houve ganho de peso total de 6,7 Kg.
Os benefícios da utilização da GTM foram descritos em estudo de coorte que avaliou a condição nutricional (ZIMC/I) e a ingestão energética em 53 pacientes com A-T, com média de idade de 14,6 anos, sendo que, destes, 12 foram submetidos à GTM, e para os 9 que tinham dados de seguimento do ZIMC/I pelo período médio de 15,3±14 meses foi observada evolução favorável do índice em 7/9 (77,7%)16. Em outro estudo com dados de seguimento para 25 crianças A-T que já apresentavam comprometimento do peso, nas 10 que tinham GTM foi constatada melhora do escore Z do peso para idade (ZP/I) em 7/10 (70%)17.
Estudo retrospectivo com 28 pacientes A-T que tinham GTM constatou que 25/28 (89%) sobreviveram por mais de 30 dias, e 3/28 (11%) morreram dentro de um mês após a realização do procedimento, no entanto esses três pacientes eram mais velhos (mediana 24,9 versus 12,3 anos, p = 0,006) e desenvolveram disfagia, problemas nutricionais e respiratórios. A idade da realização da GTM foi associada à sua tolerância (OR = 0,62; IC95% 0,41-0,94), portanto para o aumento de um ano na idade ocorreu uma redução de 38% nas chances de tolerar a GTM. Além disso, os cuidadores relataram que os pacientes tiveram melhoras significativas na participação das atividades diárias, mostrando que esse procedimento, quando feito em tempo oportuno, pode ser considerado seguro e benéfico19.
No caso deste paciente, apesar da GTM ter sido indicada aos 9 anos, o procedimento foi realizado apenas aos 11 anos de idade. Houve dificuldade de aceitação do procedimento pelo paciente e pelos pais, sendo necessária a utilização de estratégias de sensibilização, como o contato da família com outros pacientes submetidos ao procedimento que foi considerado um recurso importante, pois permitiu que a família compartilhasse medos e expectativas em uma linguagem de mais fácil compreensão. Com a evolução favorável do paciente, os pais relataram grande satisfação e mesmo arrependimento por não ter autorizado o procedimento mais precocemente. Informaram, inclusive, melhora significativa na disposição geral e no rendimento escolar.
A habitual resistência na aceitação desse procedimento apresentada pelos pais costuma estar relacionada ao sentimento de falha, perda de esperança e à anormalidade do processo de alimentar seu filho pela GTM20. Além disso, a alimentação por via oral é responsável pela formação de um forte vínculo emocional entre pais e filhos, portanto essa decisão envolve muitos sentimentos. Por isso, é fundamental envolver os pais e os pacientes desde o início do processo de tomada de decisão, sendo necessária uma abordagem multidisciplinar para garantir que recebam informações suficientes e adequadas21. A designação de um profissional de referência para a família também é essencial, no sentido de possibilitar o desenvolvimento de um elo de confiança que permita que a família discuta sobre todas as suas preocupações22.
Com a utilização da GTM, foi possível fornecer uma oferta energética de acordo com as necessidades do paciente de forma mais rápida, quando comparado com a alimentação realizada somente por via oral, mesmo com a utilização de suplementos nutricionais. No entanto, é importante ressaltar que o paciente, com disfagia leve, teve preservação da oferta por via oral, aspecto importante do ponto de vista psicológico para ele e sua família.
Além disso, a alimentação via GTM foi iniciada de forma lenta, com aumento progressivo da oferta energética, a fim de evitar a ocorrência de alterações metabólicas, culminando com overfeeding. O mais indicado é a utilização de dietas enterais poliméricas industrializadas adequadas para cada faixa etária. Dietas com fibras podem ser utilizadas na presença de alterações na glicemia, diabetes e constipação. Na impossibilidade da utilização de dietas enterais industrializadas de forma parcial ou absoluta, podese optar por dietas artesanais. No entanto, o risco de contaminação e de deficiências nutricionais com o uso de dietas artesanais é maior23.
CONCLUSÃO
A utilização da GTM como via alternativa de alimentação neste paciente mostrou-se favorável, pois possibilitou aumento da oferta energética, de macro e micronutrientes independentemente da aceitação de alimentos pela via oral, com melhora significativa dos indicadores antropométricos e do estado geral, além de proporcionar maior qualidade nutricional da dieta. Portanto, sugere-se que os pacientes com A-T devam ser avaliados e monitorados com frequência para que seja possível identificar de forma precoce comprometimentos nutricionais e realizar intervenções que sejam efetivas frente às alterações metabólicas apresentadas por esses pacientes, a fim de proporcionar um melhor prognóstico com a evolução da doença.
REFERÊNCIAS
1. Milne RL.Variants in the ATM gene and breast cancer susceptibility. Genome Med. 2009;1(1):12.
2. Swift M. Genetics and epidemiology of ataxia telangiectasia. Kroc Found Ser. 1985;19:133-46.
3. Lavin MF, Lederman HM. Chromosomal breakage syndromes associated with immunodeficiency. In: Stiehm ER, Ochs HD, Winkelstein JA. Immunologic disorders in infants & children. 5ª ed. Philadelphia: Elsevier/Saunders; 2004. p. 580-7.
4. Stray-Pedersen A, Jónsson T, Heiberg A, Lindman CR, Widing E, Aberge IS, et al. The impact of an early truncating founder ATM mutation on immunoglobulins, specific antibodies and lymphocyte populations in ataxia-telangiectasia patients and their parents.Clin Exp Immunol. 2004 Jul;137(1):179-86.
5. Lavin MF, Lederman HM. Chromosomal breakage syndromes associated with immunodeficiency. In: Stiehm ER, Ochs HD, Winkelstein JA, eds. Immunologic disorders in infants & children. 5ª ed. Philadelphia: Elsevier/Saunders; 2004. p. 580 7.
6. Gatti RA, Becker-Catania S, Chun HH, Sun X, Mitui M, Lai CH, et al. The pathogenesis of ataxia-telangectasia. Learning from a Rosetta Stone. Clin Rev Allergy Immunol. 2001;20(1):87-108.
7. da Silva R, dos Santos-Valente EC, Burim Scomparini F, Saccardo Sarni RO, Costa-Carvalho BT.The relationship between nutritional status, vitamin A and zinc levels and oxidative stress in patients with ataxia telangiectasia. Allergol Immunopathol (Madr). 2014;42(4):329-35.
8. Weiss B, Krauthammer A, Soudack M, Lahad A, Sarouk I, Somech R, et al.Liver Disease in pediatric patients with Ataxia Telangiectasia: A Novel Report. J Pediatr Gastroenterol Nutr. 2016;62:550-5.
9. Paulino TL, Rafael MN, Hix S, Shigueoka DC, Ajzen SA, Kochi C, et al. Is age a risk factor for liver disease and metabolic alterations in ataxia Telangiectasia patients? Orphanet J Rare Dis. 2017;12(1):136.
10. Ambrose M, Gatti RA.Pathogenesis of ataxia-telangiectasia:the next generation of ATM functions. Blood. 2013 May;121(20):4036-45.
11. Verhagen MM, Abdo WF, Willemsen MA, Hogervorst FB, Smeets DF, Hiel JA, et al. Clinical spectrum of ataxia-telangiectasia in adulthood. Neurology. 2009;73:430-7.
12. Lederman HM, Crawford TO. Visão geral da ataxia telangiectasia. In: St. Jude Children's Research Hospital - Memphis, Universidade Federal de São Paulo - UNIFESP, Brazilian Group for Immunodeficiencies - BRAGID, eds.Ataxia Telangiectasia:livro para famílias e portadores. São Paulo: Editora Brasileira; 2006. p. 9-10.
13. Ross LJ, Capra S, Baguley B, Sinclair K, Munro K, Lewindon P, et al. Nutritional status of patients with ataxia-telangiectasia: A case for early and ongoing nutrition support and intervention. J Paediatr Child Health. 2015 Aug;51(8):802-7.
14. Ramelli GP, Aloysius A, King C, Davis T, Muntoni F. Gastrostomy placement in paediatric patients with neuromuscular disorders: indications and outcome. Dev Med Child Neurol. 2007;49:367-71.
15. Institute of Medicine. Dietary Reference Intakes for energy, carbohydrate, fiber, fat, protein, and amino acids (macronutrients). Washington: National Academy Press; 2002.
16. Krauthammer A, Lahad A, Sarouk Y, Somech R, Nissenkorn A, Modan-Moses D, et al. Long-term nutritional and gastrointestinal aspects in patients with ataxia telangiectasia. Nutrition. 2018;46:48-52.
17. Stewart E, Prayle AP, Tooke A, Pasalodos S, Suri M, Bush A, et al. Growth and nutrition in children with ataxia telangiectasia.Archives of Disease in Childhood. 2016;101:1137-41.
18. Pommerening H, van Dullemen S, Kieslich M, Schubert R, Zielen S, Voss S.Body composition, muscle strength and hormonal status in patients with ataxia telangiectasia: a cohort study. Orphanet J Rare Dis. 2015;10:155.
19. Lefton-Greif MA, Crawford TO, McGrath-Morrow S, Carson KA, Lederman HM. Safety and caregiver satisfaction with gastrostomy in patients with Ataxia Telangiectasia. Orphanet J Rare Dis. 2011;6:23.
20. Sullivan PB, Juszczak E, Bachlet AM, Thomas AG, Lambert B, Vernon-Roberts A, et al. Impact of gastrostomy tube feeding on the quality of life of carers of children with cerebral palsy. Dev Med Child Neurol. 2004;46(12):796-800.
21. Rouse L, Herrington P, Assey J, Baker R, Golden S. Feeding problems, gastrostomy and families: a qualitative pilot study. Br J Learn Disabil. 2002;30(3),122-28.
22. Smith L, Daughtrey H. Weaving the seamless web of care: an analysis of parents' perceptions of their needs following discharge of their child from hospital. J Adv Nurs. 2000;31(4):812-20.
23. Romano C, van Wynckel M, Hulst J, Broekaert I, Bronsky J, Dall'Oglio L, et al.European Society for Paediatric Gastroenterology, Hepatology and Nutrition Guidelines for the evaluation and treatment of gastrointestinal and nutritional complications in children with neurological impairment.J Pediatr Gastroenterol Nutr. 2017;65(2):242-64.



