Número Atual: Abril-Junho 2020 - Volume 4 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
- Outros do Autor
Artigo de Revisão
Imunopatologia da COVID-19 e suas implicações clínicas
COVID-19 immunopathology and its clinical implications
Fernando M. Aarestrup
DOI: 10.5935/2526-5393.20200024
Chefe do Serviço de Alergia e Imunologia Clínica do Hospital Maternidade Therezinha de Jesus - Hospital de Ensino - HMTJ, Juiz de Fora, MG, Brasil. Professor Titular, Universidade Federal de Juiz de Fora - Laboratório de Imunopatologia e Imunologia Clínica CBR - UFJF, Juiz de Fora, MG, Brasil
Endereço para correspondência:
Fernando M. Aarestrup
E-mail: fmaarestrup@hotmail.com
Submetido em: 25/05/2020
Aceito em: 29/05/2020
RESUMO
Compreender os mecanismos imunopatológicos envolvidos na evolução da COVID-19 é um desafio para a ciência mundial. A observação da existência de formas clínicas diferentes da doença, podendo ocorrer desde manifestações leves até formas graves, demonstra a complexidade da resposta imune desenvolvida frente à infecção pelo SARS-CoV-2. Nesta revisão da literatura, utilizamos as bases de dados PubMed, MEDLINE, LILACS, SciELO a partir de dezembro de 2019, quando surgiram os primeiros casos da doença. A relação entre as diferentes formas clínicas da COVID-19 com o desenvolvimento da resposta imune foi amplamente discutida. As diferenças da evolução da COVID-19 em crianças e idosos foram avaliadas focalizando aspectos da resposta imune que podem conferir prognóstico favorável ou risco de desenvolvimento de formas clínicas graves.Particularidades da infecção pelo SARS-CoV-2 em pacientes com imunossupressão e em portadores de asma foram analisadas. Os mecanismos imunopatológicos envolvidos no desenvolvimento das formas graves da COVID-19 foram abordados com ênfase no fenômeno "tempestade de citocinas".
Descritores: COVID-19, imunologia, SARS-CoV-2, coronavírus.
INTRODUÇÃO
Em dezembro de 2019, autoridades de saúde chinesas descreveram casos de pneumonia grave causada por um novo tipo de coronavírus. A fonte de contaminação, inicialmente, foi considerada um mercado de animais na cidade de Wuhan, província de Hubey, China. Classicamente, morcegos, aves e outros animais, principalmente aqueles de vida selvagem, podem ser hospedeiros destes vírus RNA. Surtos anteriores de coronaviroses que causam as doenças respiratórias SARS (síndrome respiratória aguda grave) e MERS (síndrome respiratória do oriente médio), tiveram o contágio entre animais e humanos e entre humanos, comprovado. Em 12 de janeiro de 2020, a Organização Mundial de Saúde (OMS) denominou o vírus em questão, temporariamente, como "novo coronavírus de 2019" (2019-nCoV). Posteriormente, a análise de seu genoma revelou homologia de 80 a 90% com o SARS-CoV, agente etiológico da SARS, ficando estabelecido o termo SARS-CoV-2 como sua denominação definitiva1-3.
O SARS-CoV-2 é o sétimo vírus da família de coronavírus a infectar seres humanos. Os coronavírus HCoV-229E, HCoV-OC43, HCoV-NL63 e HCoV-HKU1 causam sintomas comuns de resfriado em indivíduos imunocompetentes. O SARS-CoV, por sua vez, foi o agente causal dos surtos de SARS em 2002 e 2003, na província de Guangdong, China. Em 2012, o MERS-CoV foi reconhecido como agente etiológico da MERS, no Oriente Médio2-4. Em 11 de março de 2020, a doença causada pelo SARS-CoV-2 foi denominada COVID-19 pela OMS, que reconheceu sua disseminação em todos os continentes. Ao contrário da SARS e da MERS que tiveram seus surtos controlados, a COVID-19, infelizmente, adquiriu status de pandemia3-5. Estratégias de isolamento e distanciamento social têm sido adotadas em todo o mundo com intuito de controlar a disseminação da infecção por este novo coronavírus.
Clinicamente, a infecção por SARS-CoV-2 provoca desde o resfriado comum até quadros sistêmicos caracterizados por síndrome respiratória aguda grave, podendo ocorrer, concomitantemente, coagulopatias, distúrbios neurológicos, além de estado sistêmico inflamatório grave caracterizado, imunopatologicamente, por ocorrer uma "tempestade de citocinas". A gravidade das manifestações clínicas está relacionada às condições sistêmicas dos indivíduos infectados. Portadores de doenças cardiovasculares, diabetes, obesidade, insuficiência renal e hipertensão arterial sistêmica (HAS) possuem alto risco de desenvolvimento de doença grave e, consequentemente, maior possibilidade de óbito. Idosos, caracteristicamente, também apresentam maiores incidências de síndrome respiratória aguda grave e de mortalidade. De modo interessante, ao contrário de outras viroses respiratórias como a infecção pelos vírus influenza H1N1, crianças possuem menor risco de infecção e, quando esta ocorre, tendem ao desenvolvimento de quadros clínicos leves4-6.
O acometimento pela COVID-19 de pacientes imunossuprimidos, seja por tratamento de neoplasias malignas ou por controle da rejeição de transplantes de órgãos, parece ser proporcionalmente pequeno diante do número total de casos e, peculiarmente, estes pacientes apresentam evolução clínica favorável em comparação a outras comorbidades. Até o momento, embora existam poucos relatos publicados, portadores de imunodeficiências primárias não apresentaram pior evolução clínica com desenvolvimento de doença grave. Outra constatação interessante é a de que pacientes com alergias respiratórias, como asma, provavelmente não apresentam maior susceptibilidade a infecção pelo SARS-CoV-2 e não pertencem ao grupo de risco para o desenvolvimento de formas clínicas graves da COVID-197-9.
Uma corrida global pela busca de conhecimento sobre a COVID-19 está em curso. Cientistas de laboratórios de pesquisa em todo o mundo trabalham incansavelmente para obtenção, o quanto antes, de estratégias de imunoprofilaxia e de terapêutica para a infecção pelo SARS-CoV-2. Nesta revisão da literatura focalizamos os estudos que abordaram os mecanismos imunológicos associados ao desenvolvimento da infecção pelo SARS-CoV-2. As prováveis implicações clínicas provenientes do conhecimento da imunopatologia da COVID-19 foram discutidas.
COMO O SARS-COV-2 INFECTA AS CÉLULAS HUMANAS?
Os HCoVs são vírus RNA que possuem como característica morfológica marcante a presença, em sua superfície, da proteína S formando projeções chamadas spike. São reconhecidas quatro moléculas estruturais no vírus: proteína S, proteínas de membrana, proteína do nucleocapsídeo e proteína do envelope viral. A Figura 1 representa esquematicamente a estrutura molecular do SARS-CoV2. A patogenicidade do SARS-CoV-2 correlaciona-se com a alta afinidade da proteína S por receptores das células alvo. O SARS-CoV e o SARS-CoV2 utilizam a enzima conversora da angiotensina-2 (ACE2), como receptor, para estabelecer a infecção nas células hospedeiras. A proteína S do SARS-CoV 2 possui tropismo pela molécula ACE2. Adicionalmente, a enzima hemaglutinina esterase, presente na superfície viral, interage com resíduos de ácido siálico que fazem parte da membrana celular humana, promovendo outro tipo de mecanismo de penetração e de inserção do SARS-CoV 2 nas células9-12.
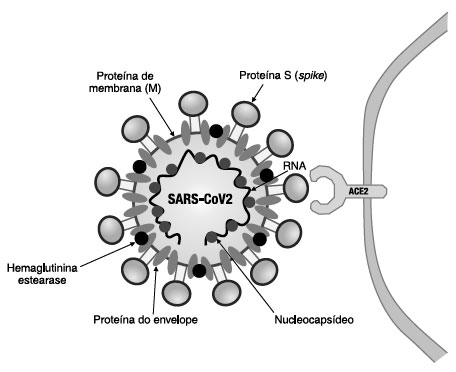
Figura 1. Estrutura molecular do SARS-CoV2 e interação com o receptor celular ACE2.
Inicialmente, quadros de infecção respiratória aguda com pneumonia grave foram reconhecidos como a mais importante causa de óbito em pacientes com COVID-19. Com a evolução da pandemia e realização de estudos em todo o mundo, as complicações cardiovasculares e distúrbios de coagulação associados a um estado inflamatório sistêmico grave passaram a chamar atenção como fatores agravantes do quadro clínico de pessoas infectadas com SARS-CoV2. A molécula ACE2 é expressa em várias células, tais como células epiteliais dos alvéolos pulmonares (pneumócito II), células endoteliais, enterócitos do intestino delgado, células musculares lisas, células miocárdicas e células epiteliais dos túbulos renais proximais. Portanto, o receptor para o SARS-CoV2 está presente em vários sistemas, como respiratório, gastrointestinal, renal e cardiovascular. Provavelmente, tal fato está associado com o comprometimento sistêmico observado em casos graves da COVID-199,10,12. Por fim, uma importante constatação é a de que tabagismo, diabetes e hipertensão arterial sistêmica promovem um aumento da expressão de ACE29,10. Tal fato explica, em parte, a associação destas comorbidades com o aumento do risco de desenvolvimento de formas clínicas graves de COVID-19.
POR QUE CRIANÇAS, GERALMENTE, DESENVOLVEM COVID-19 LEVE À MODERADA?
A COVID-19 tem sido documentada em bebês prematuros, lactentes, crianças e adolescentes. Estudos epidemiológicos revelam que a incidência de quadros graves de infecção pelo SARS-CoV2 em crianças e adolescentes é inferior à observada em adultos e idosos. Casos fatais em crianças são relativamente raros. A maioria das crianças tem um curso clínico mais leve caracterizado por febre, tosse, fadiga, mialgia, vômitos e diarreia. Estes sintomas geralmente apresentam resolução entre 7 a 10 dias13-15. Uma hipótese para este curso clínico é a de que crianças e adolescentes apresentam menor expressão celular da molécula ACE2. Adicionalmente, estudos demonstraram que a resposta intracelular induzida pela ACE2 em células epiteliais alveolares de crianças é menor do que a observada em adultos. O fato de comorbidades, como diabetes e doenças cardiovasculares, serem menos comuns em crianças também contribui para que ocorra uma melhor evolução clínica14-16.
Outra possibilidade que pode explicar a menor susceptibilidade da infecção pelo SARS-CoV2 e o desenvolvimento de formas clínicas de COVID-19 leve à moderada nas crianças em idade escolar são as características peculiares da resposta imune nas diferentes faixas etárias. A resposta imune inata efetiva em crianças provavelmente é um fator que diminui a susceptibilidade à infecção pelo SARSCov2 e o risco de evolução para formas graves da COVID-19. Nos idosos, a imunossenescência é uma característica peculiar que modifica o desenvolvimento da resposta imune, particularmente a resposta inata, predispondo ao desenvolvimento de doenças infecciosas e neoplasias malignas17-20.
As infecções por HCoVs são largamente distribuídas em todo mundo, geralmente causando doença leve, do tipo resfriado comum. Os coronavírus HCoV-229E, HCoV-OC43, HCoV-NL63, e HCoV- HKU causam sintomas de resfriado com manifestações clínicas de excelente prognóstico, sendo autolimitadas e involuindo em 7 a 10 dias. Tanto a imunidade inata quanto a adquirida possuem papel importante no controle da infecção por hCoVs. Devido à eficácia da resposta inata em crianças, muitas apresentam quadro de doença subclínica. A exposição frequente de crianças a estes HCoVs pouco patogênicos pode induzir o desenvolvimento de resposta imune adquirida mediada por linfócitos T e linfócitos B, permitindo o controle das manifestações clínicas sem necessidade de terapêutica específica. Entretanto, ainda não foi totalmente esclarecido se esta imunidade desenvolvida contra estes tipos de coronavírus pouco patogênicos pode influenciar a eficácia da resposta imune em crianças expostas ao SARS-CoV214,15,21. Dados de estudos preliminares sugerem que existe pouca ou nenhuma proteção cruzada mediada por anticorpos específicos para HCoV-229E, HCoV-OC43, HCoVNL63, e HCoV- HKU1 contra o SARS-CoV-215,21,22.
A imunossenescência contribui para diminuição da capacidade do sistema imunológico em responder eficazmente às infecções em idosos. As alterações biológicas que levam à imunossenescência são pouco conhecidas. Atualmente, inúmeros tipos de células envolvidas nas imunidades inata e adquirida exibem alterações funcionais como resultado do envelhecimento. Estas manifestações em nível celular são provocadas por desregulação do sistema imunológico promovendo, com o envelhecimento, um novo estado de interações celulares mediadas por citocinas. Tal desregulação do sistema imune, provavelmente devido ao menor número e menor atividade de linfócitos Treg, leva à diminuição da capacidade quimiotática de neutrófilos e à diminuição da quantidade de células natural killers (NK), além da deficiência no controle da produção de citocinas imunomoduladoras. O chamado "fenótipo secretor associado à senescência" (SASP-Senescence-associated secretory phenotype)é responsável pelo aumento da produção de citocinas específicas, quimiocinas e outros mediadores próinflamatórios18-20. O SASP promove estado inflamatório crônico de baixo grau, o que contribui ainda mais para alterar a regulação da resposta imunológica, dificultando a resposta a vacinas e, provavelmente, a novos patógenos como o SARS-CoV-2.
APRENDENDO COM AS PANDEMIAS DE INFLUENZA DESDE 1918 E COM OS SURTOS DE SARS E MERS
A pandemia de gripe de 1918 levou a óbito aproximadamente 50 milhões de pessoas em todo o mundo. Atualmente, sabemos que o patógeno responsável por esta tragédia na história mundial foi o vírus H1N1, que infectou na época cerca de 500 milhões de pessoas. Desde 1918, o mundo já experimentou quatro pandemias de vírus Influenza: a pandemia asiática de Influenza em 1957, a pandemia de Influenza de Hong Kong em 1968, e a pandemia de "gripe suína" em 2009. Durante esta pandemia de 1918, várias formas clínicas com espectro de doença de leve à grave foram observadas, similarmente ao que ocorre na COVID-1923-26.
Na pandemia de H1N1 de 1918, em contraste ao observado na pandemia de SARS-CoV2, a me-nor taxa de mortalidade na população acima de 30 anos sugere provável imunidade reativa cruzada pré-existente com outros vírus que infectaram a população na época. A ausência de anticorpos específicos pré-existentes e/ou de reatividade cruzada, assim como imunidade celular capaz de impedir a multiplicação viral, são fatores que provavelmente contribuem para a elevada taxa de morbidade e mortalidade em adultos jovens25,26.
A associação do perfil etário epidemiológico com as formas graves da COVID-19 e da gripe Influenza de 1918 sugerem algumas hipóteses que, se confirmadas, podem ajudar no entendimento da imunopatologia da infecção pelo SARS-CoV2. Casos graves de COVID-19 são significativamente mais observadas em idosos, sugerido que até o momento não existe memória imunológica nem resposta imune cruzada efetiva entre o SARS-CoV2 e outros coronavírus. Semelhante ao que ocorre na patogênese da SARS e da MERS, pacientes graves com COVID- 19 apresentam estado hiperinflamatório generalizado, caracterizado pela chamada "tempestade de citocinas"30-35. Estudos recentes sugerem que os pacientes com formas graves de COVID-19 têm níveis séricos elevados de IL-6 (interleucina 6) e TNF-α (fator de necrose tumoral alfa) associados ao aumento da proteína C-reativa, caracterizando, assim, um clássico estado hiperinflamatório6,36. O quadro inflamatório crônico basal em idosos associado à imunossenescência pode contribuir para a gravidade da COVID-19 neste grupo populacional. Idosos parecem ser mais propensos a desenvolver inflamação sistêmica generalizada devido à desregulação da resposta imune, facilitando assim o surgimento da tempestade de citocinas. De modo interessante, crianças e adolescentes geralmente não apresentam a produção desregulada e exacerbada de mediadores inflamatórios que leva à tempestade de citocinas, como consequência da infecção pelo SARS-CoV, MERS-CoV e SARS-CoV213,21.
Estudos experimentais realizados para tentar reproduzir e estudar os mecanismos imunopatológicos envolvidos na infecção pelo H1N1 também destacam a importância da tempestade de citocinas na imunopatologia destas viroses com capacidade de provocarem síndrome respiratória aguda grave27-29. Os resultados destes estudos revelaram que, de modo semelhante ao observado nos pacientes com COVID- 19 em suas formas graves, a desregulação da resposta imune, acarretando uma "tempestade de citocinas", foi o principal evento responsável pelo desenvolvimento do estado hiperinflamatório sistêmico, levando a lesões em vários órgãos.
Crianças em idade escolar estão em um "período de lua-de-mel" com o sistema imune. Estímulos antigênicos frequentes associados à regulação das respostas celular e humoral fazem parte do desenvolvimento e do amadurecimento imunológico, proporcionando maior resistência a uma variedade de bactérias e vírus. Esta plasticidade do sistema imune em crianças permite o desenvolvimento rápido de mecanismos capazes de responder a novos patógenos. Este fenômeno corresponde a uma das hipóteses para explicar o fato histórico da recuperação da maior parte das crianças infectadas nas pandemias de gripe Influenza de 1918 e de 200921,25,26. Extrapolando os conhecimentos sobre a plasticidade e a rapidez da resposta imune, várias hipóteses sobre a imunopatologia da COVID-19 em crianças podem ser elaboradas. Durante a infância, mecanismos de regulação efetivos estimulados pela constante apresentação de novos antígenos e consequente diferenciação de linfócitos Treg específicos capazes de regular a atividade de vários tipos celulares como linfócitos Th1, Th2 e Th17 podem permitir o desenvolvimento de resposta imune contra o SARSCoV2, sem provocar a tempestade de citocinas que caracteriza as formas clínicas graves. Portanto, as crianças são infectadas, mas devido a mecanismos de controle da resposta, apresentam quadros clínicos leves à moderados, além de conseguirem conter a proliferação viral por meio de reação inflamatória coordenada e autolimitada, sem danos teciduais ou alterações sistêmicas importantes.
CARACTERÍSTICAS DA RESPOSTA IMUNE NOS PACIENTES COM FORMAS GRAVES DE COVID-19
Lin Ling e cols. hipotetizaram que a história natural da COVID-19 possui três fases descritas a seguir: a fase de viremia que ocorre até o 7º dia, a fase aguda entre 7º e 10º dia caracterizada pela presença de pneumonia, e uma terceira fase que pode variar dependendo da capacidade do sistema imune de controlar a infecção viral adequadamente35. A maioria dos pacientes, principalmente crianças e adultos saudáveis, evoluem satisfatoriamente, e entre 14 a 21 dias apresentam uma fase de recuperação. Entretanto, portadores de comorbidades e idosos podem nesta terceira fase apresentar formas graves evoluindo para o óbito. Os autores ressaltam dados da literatura que demonstraram que os pacientes que evoluem para formas clínicas graves apresentam vários achados laboratoriais, tais como: linfopenia, aumento de expressão D-dímero, aumento da carga viral e o aumento dos níveis séricos de citocinas inflamatórias. Neste mesmo artigo eles discutiram a indicação de utilizar terapêutica anticoagulante, tendo como parâmetro para sua utilização o aumento dos níveis séricos de D-dímero.
Giamarellos-Bourboulis e cols., avaliando o perfil de produção de mediadores inflamatórios de 54 pacientes com COVID-19, postularam que existem dois mecanismos imunológicos que causam lesões teciduais em pacientes que desenvolvem lesão respiratória grave6. O primeiro mecanismo corresponde à síndrome de ativação de macrófagos (MAS -macrophage activation syndrome), e o segundo é representado por uma alteração da apresentação antigênica direcionando a uma produção elevada de IL-6 com desregulação da resposta imune. Adicionalmente, níveis séricos elevados de TNF-α também foram detectados amplificando o estado de desregulação da resposta imune que, além de não ser capaz de conter o processo infeccioso, acaba por promover o desenvolvimento de uma resposta hiperinflamatória sistêmica e lesões teciduais. Este estudo também constatou uma linfopenia com redução de linfócitos T CD4+ e células NK, portanto pacientes que apresentam evolução clínica não satisfatória possuem alterações tanto na resposta imune inata, quanto na resposta imune adquirida.
A presença de linfopenia e a tempestade de citocinas como expressão máxima da desregulação da resposta imune foi observada em vários outros estudos realizados em pacientes com forma clínica grave de COVID-19. Em estudo com 1.099 pacientes, a linfopenia foi presente em 914 (83,2%) dos pacientes na admissão hospitalar. Níveis séricos elevados de vários mediadores pró-inflamatórios, tais como interleucina-1beta (IL-1β), IL-1RA, IL-7, IL-8, IL-9, IL-10, fator estimulador de colônias de granulócitosmacrófagos-(GM-CSF), IFN-γ, IP10 (interferon γ-inducible protein), TNF-α, e fator de crescimento endotelial vascular (VEGF) foram encontrados em pacientes com COVID-195,6,36,37.
Como descrito anteriormente na SARS, MERS e COVID-19, a MAS corresponde a um importante mecanismo imunopatológicos que leva ao desenvolvimento da angústia respiratória grave, linfopenia, coagulopatia, elevação de transaminases, hiperferritinemia e disfunção de múltiplos órgãos. A síndrome MAS é um fenômeno também observado em doenças autoimunes, como por exemplo, artrite idiopática juvenil. O emprego de corticoides por via sistêmica, ciclosporina e imunoglobulina intravenosa são tratamentos preconizados nestas situações. Em virtude da elevada produção de citocinas próinflamatórias induzidas pelo SARS-CoV, MERS-CoV e SARS-CoV-2, os corticosteroides sistêmicos chegaram a ser inicialmente utilizados no tratamento de pacientes com doença grave, com o intuito de reduzir o processo inflamatório nos pulmões. Entretanto, existem evidências em pacientes com SARS e MERS que demostraram que o uso de corticoides pode diminuir o clearance viral. Tal fato levou a OMS a não recomendar o emprego rotineiro de corticoides sistêmicos38,39.
Controlar a replicação viral concomitantemente com a modulação da resposta inflamatória é o principal desafio no tratamento da COVID-19. O emprego de corticoides por via sistêmica e/ou fármacos imunossupressores em doenças autoimunes apresentam bons resultados, mas no caso uma doença viral caracterizada por elevada velocidade de replicação do agente etiológico, a inibição da resposta imune pode favorecer a evolução do processo infeccioso. Por outro lado, estratégias de Medicina de Precisão que inibem de modo seletivo citocinas chaves neste fenômeno de tempestade de citocinas parecem ser promissoras no tratamento de pacientes com COVID-19. O emprego do biológico Tocilizumab, que inibe seletivamente a IL-6, resgatou parcialmente a desregulação da resposta imune causada pela infecção pelo SARS-CoV26. Outra possibilidade terapêutica promissora é a combinação de fármacos antivirais com anti-inflamatórios. Ensaios clínicos de qualidade poderão elucidar futuramente a eficácia destas modalidades de tratamento que, embora promissoras, ainda não possuem evidências científicas robustas para serem utilizadas como rotina terapêutica.
A busca por biomarcadores capazes de orientar o prognóstico também vem sendo pesquisada. Estudos realizados em pacientes com COVID-19 internados em unidade de terapia intensiva (UTI) que evoluíram para desfechos fatais sugerem que níveis séricos elevados de duas quimiocinas, MCP-3 (monocyte chemotactic protein-3) e a IP-10 (interferon gamma induced protein 10), podem ser marcadores que indicam gravidade e consequente maior probabilidade de óbito40,41. A avaliação do perfil de células envolvidas na resposta imune na infecção pelo SARS-CoV-2 pode nos ajudar a compreender a imunopatologia e inferirmos achados clínicos e laboratoriais, auxiliando na avaliação dos pacientes.
Um interessante estudo laboratorial realizado com pacientes com COVID-19 revelou dados importantes sobre a regulação da resposta imune36. Foram avaliados 65 pacientes com COVID-19, classificados como formas leves (n = 30), graves (n = 20) e extremamente graves (n = 15) da doença. Níveis séricos elevados de ferritina, desidrogenase láctica e D-dímero, foram detectados em pacientes graves e extremamente graves. O número absoluto de linfócitos T CD4+, linfócitos T CD8+ e linfócitos B foram todos gradualmente diminuindo com o aumento da gravidade da doença. Uma redução da percentagem de células T reguladoras naturais (nTreg) foi constatada em pacientes extremamente graves. Estes achados fortalecem a hipótese de que a desregulação da resposta imune é um fenômeno crucial na determinação de evolução clínica desfavorável.
Os dados em conjunto dos diversos estudos clínicos e laboratoriais realizados nos pacientes infectados com SARS-CoV-2 e que evoluíram para síndrome respiratória aguda grave fortalecem a teoria de que existem dois mecanismos imunopatológicos que explicam os casos que não evoluíram satisfatoriamente5,6,36,37. A MAS, caracterizada pela intensa ativação de macrófagos e produção elevada de IL-1 nas fases iniciais da doença, apresenta uma série de eventos que são constatados laboratorialmente nas análises do soro dos pacientes graves. Pacientes que apresentam uma moderada apresentação de antígenos evoluem com linfopenia associada a diminuição de linfócitos B e linfócitos T CD4+, redução dos níveis séricos de IgA e IgM, aumento da produção das citocinas IL-1, IL-6, TNF-α, aumento das enzimas hepáticas ALT/AST, níveis séricos de D-dímero, proteína C-reativa e ferritina elevados. Pessoas que na fase inicial da doença apresentam uma fraca apresentação do antígeno com linfopenia (diminuição no sangue periférico de células NK, linfócitos B e linfócitos T CD4+, e linfócitos T CD8+) caminham para a desregulação da resposta imune, com aumento acentuado da produção de IL-6, elevando a taxa de vários outros parâmetros laboratoriais, tais como PCR, D-dímero e ALT/AST.
A Figura 2 representa esquematicamente a interação entre células e citocinas que participam do processo imunopatológico da COVID-19.
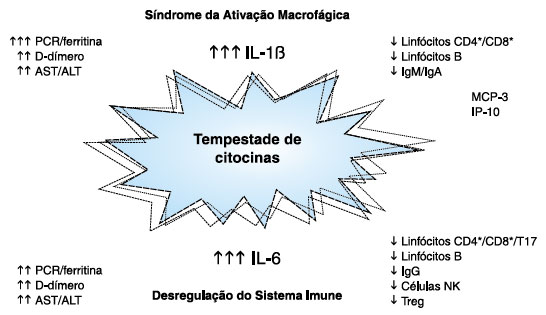
Figura 2. Mecanismos imunológicos que levam à tempestade de citocinas associada às formas graves da COVID-19.
DOENÇAS ALÉRGICAS PODEM MODIFICAR A PATOGÊNESE DA COVID-19?
A relação entre infecções virais respiratórias e exacerbação de asma é bem descrita na literatura. Pacientes com asma podem apresentar uma alteração na resposta imune inata, diminuindo a produção de IFN-γ e IFN-β e levando a uma maior susceptibilidade ao desenvolvimento de infecções virais respiratórias43. Além disso, as viroses respiratórias induzem o descontrole da asma. Portanto, estamos diante de uma relação bidirecional onde viroses e asma são fatores agravantes na evolução clínica, seja da infecção, ou do processo alérgico.
Doenças cardiovasculares, diabetes e doenças pulmonares crônicas foram reconhecidas como importantes fatores de risco para o desenvolvimento de formas graves de COVID-19. Entretanto, Zhang e cols. publicaram um estudo sobre as características clínicas de 140 casos (58 graves e 82 leves) de COVID-19, e nenhuma doença alérgica, incluindo asma e rinite alérgica, foi relatada pelos pacientes44. Estudos epidemiológicos também não identificaram a asma como um fator de risco para COVID-19 grave45.
Recentemente, foi demonstrada uma diminuição da expressão da molécula ACE2 no epitélio da mucosa nasal de crianças com sensibilização alérgica comprovada e asma alérgica9. Resultado semelhante também foi observado em adultos portadores de asma. A expressão da ACE2 no epitélio da mucosa nasal e brônquico em adultos com rinite e/ou asma diminuiu significativamente após a realização de teste de provocação nasal com alérgeno. Neste mesmo estudo, os autores sugerem que pode existir uma relação inversamente proporcional entre a expressão de ACE2 no epitélio respiratório de vias aéreas superiores e inferiores com o desenvolvimento de inflamação Tipo 2 em indivíduos atópicos. Esta hipótese elegantemente levantada possui fundamentos sólidos do ponto de vista imunopatológico e de observação clínica quanto à gravidade da COVID-19 em atópicos, entretanto, precisa ser melhor investigada.
Os dados em conjunto dos estudos realizados até o momento, demonstram que as formas graves de COVID-19 possuem um perfil de citocinas característico com aumento dos níveis séricos de IL-6, TNF e IL-1, configurando um padrão de resposta não tipo 25,6,9,31,35. A denominada "tempestade de citocinas" provavelmente é o evento principal com relação ao desenvolvimento das formas graves da COVID-19, e o aumento de possibilidade de desfechos fatais. Portanto, pessoas que geneticamente apresentam uma predisposição para desenvolverem uma inflamação do tipo 2 como ocorre em atópicos, teoricamente podem apresentar peculiaridades na resposta imune frente à infecção pelo SARS-CoV-2.
O QUE SABEMOS SOBRE IMUNOSSUPRESSÃO E INFECÇÃO PELO SARS-COV-2?
Recente revisão sistemática da literatura identificou artigos relevantes sobre a relação entre COVID19 e imunodeficiências8. Foram incluídos estudos que relataram dados sobre pacientes imunossuprimidos adultos e crianças infectados com SARS-CoV-2. Foram incluídos no estudo, informações sobre a evolução clínica de 110 pacientes submetidos à imunossupressão devido a tratamento oncológico ou por receberem transplante de órgãos. Pacientes com câncer que apresentavam uma condição clínica geral mais comprometida, geralmente apresentaram evolução mais grave da COVID-19, mas, não necessariamente, foi constatado um mau prognóstico. Os autores concluíram que pacientes imunossuprimidos com COVID-19 parecem ser poucos em relação aos números gerais, e apresentam um resultado favorável em comparação com outras comorbidades. Tal fato pode ser explicado por um hipotético papel protetor de uma resposta imunológica celular menos desenvolvida, determinando uma apresentação menos agressiva da doença.
O relato recente de dois casos clínicos de pacientes com agamaglobulinemia ligada ao X (XLA) que foram infectados com o SARS-CoV-2 e se recuperaram demonstra a complexidade da resposta imune na COVID-1946. Ambos os pacientes desenvolveram pneumonia intersticial caracterizada por febre, tosse e anorexia e associada à elevação da PCR e da ferritina, mas não necessitaram de ventilação mecânica e cuidados intensivos. A descrição destes dois casos permite concluir que a resposta imune mediada pelos linfócitos T pode ser suficiente para combater este vírus em indivíduos que não conseguem sintetizar imunoglobulinas. Esta intrigante e inesperada evolução destes pacientes sugere que o sistema imune pode utilizar múltiplas vias para controlar a infecção pelo SARS-CoV-2.
CONSIDERAÇÕES FINAIS
Estamos diante de um momento histórico. Os médicos Alergistas e Imunologistas necessitam de conhecimento profundo sobre a imunopatologia da COVID-19 para atuarem nas seguintes situações específicas:
- orientação e educação de pacientes sobre cuidados individuais durante a pandemia;
-indicação de imunoprofilaxia vacinal para doenças que podem contribuir para o agravamento da COVID-19;
-manejo do tratamento das doenças alérgicas em tempos de COVID-19;
-assumir o papel de multiplicadores do conhecimento sobre a resposta imune na infecção pelo SARS-CoV-2.
REFERÊNCIAS
1. Cui J, Li F, Shi ZL.Origin and evolution of pathogenic coronaviruses. Nat Ver Microbiol. 2019;17:181-92.
2. Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020;579:270-3.
3. Wu Z, McGoogan JM. Characteristics of and Important Lessons From the coronavirus disease 2019 (COVID-19).Outbreak in China: Summary of a Report of 72314 Cases From the Chinese Center for Disease Control and Prevention. JAMA. 2020;323:1239-42.
4. Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020;382:727-33.
5. Zhou G, Chen S, Chen Z. Advances in COVID-19: the virus, the pathogenesis and evidence-based control and therapeutic strategies. Front Med. 2020;21:1-9.
6. Giamarellos-Bourboulis EJ, Netea MG, Rovina N, Koulouris N, Gogos C, Koutsoukou A.Complex immune dysregulation in COVID19 patients with severe respiratory failure. Cell Host & Microbe. 2020;27:1-9.
7. Soresina A, Moratto D, Chiarini M, Paolillo C, Baresi G, Focà E, et al.Two X linked agammaglobulinemia patients develop pneumonia as COVID-19 manifestation but recover. Pediatr Allergy Immunol. 2020. doi: 10.1111/pai.13263.
8. Minotti C, Tirelli F, Barbieri E, Giaquinto C, Donà D. How is immunosuppressive status affecting children and adults in SARSCoV-2 infection? A systematic review.J Infect.2020;81(1):e61-e66. doi:10.1016/j.jinf.2020.04.026
9. Jackson DJ, Busse WW, Bacharier LB, Kattan M, O'Connor GT, Wood RA, et al. Association of respiratory allergy, asthma and expression of the SARS-CoV-2 receptor ACE2 [letter to the editor].J Allergy Clin Immunol.2020;20:30551-0.doi: https://doi.org/10.1016/j.jaci.2020.04.009
10. Li G, Hea X, Zhanga L, Rana Q, Wanga J, Xionga A, et al.Assessing ACE2 expression patterns in lung tissues in the pathogenesis of COVID-19. J Autoimmun. 2020;13:102463.
11. Brough HA, Kalayci O, Sediva A, Untersmayr E, Munblit D, del Rio PR, et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics -the 2020 COVID-19 pandemic: a statement from the EAACI. Pediatric Allergy and Immunology. 2020. doi:10.1111/pai.13262.
12. Felsenstein S, Herbert JA, McNamara S, Hedrich CM. COVID-19: Immunology and treatment options. Clinical Immunology. 2020;215:108448.
13. Lee P-I, Hu Y-L, Chen P-Y, Huang Y-C, Hsueh P-R. Are children less susceptible to COVID-19? J Microbiol Immunol Infect. 2020 Jun;53(3):371-2. doi: 10.1016/j.jmii.2020.02.011.
14. Cristiani L, Mancino E, Matera L, Nenna R, Pierangeli A, Scagnolari C, et al. Will children reveal their secret? The coronavirus dilema. Eur Respir J. 2020. doi: 10.1183/13993003.00749-2020.
15. Lu X, Zhang L, Du H, Zhang J, Li YY, Qu J, et al.SARS-CoV-2 infection in children. N Engl J Med. 2020. doi:10.1056/NEJMc2005073.
16. Long X, Zhu J, Zhao R. Epidemiology and clinical features of highly pathogenic human coronavirus infection in children.Chin J Pediatr. 2020;58:E01.
17. Crooke SN, Ovsyannikova IG, Poland GA, Kennedy RB. Immunosenescence: A systems-level overview of immune cell biology and strategies for improving vaccine responses.Experimental Gerontology. 2019;124:110632.
18. Cancro MP, Hao Y, Scholz JL, Riley RL, Frasca D, Dunn-Walters DK, et al. B cells and aging: molecules and mechanisms. Trends Immunol. 2009;30:313-8.
19. Franceschi C, Bonafe M, Valensin S, Olivieri F, De LM, Ottaviani E, et al. Inflamm-aging. An evolutionary perspective on immunosenescence. Ann NY Acad Sci. 2000;908:244-54.
20. Agarwal S, Busse PJ. Innate and adaptive immunosenescence. Ann Allerg Asthma Immunol. 2010;104:183-90.
21. X Lu, Xiang Y, Du H, Wong GW.SARS- CoV-2 infection in children - Understanding the immune responses and controlling the pandemic. Pediatr Allergy Immunol. 2020;00:1-5.
22. Guo L, Ren L, Yang S, Xiao M, Chang D, YangF, et al. Profiling early humoral response to diagnose novel coronavirus disease (COVID-19). Clin Infect Dis. 2020. doi:10.1093/cid/ciaa310.
23. Brundage JF.Interactions between influenza and bacterial respiratory pathogens: implications for pandemic preparedness. Lancet Infect Dis. 2006;6:303-12.
24. Brundage JF, Shanks GD. Deaths from bacterial pneumoniaduring 1918-19 influenza pandemic. Emerg Infect Dis. 2008;14:1193-9.
25. Short KR, Kedzierska K, van de Sandt CE. Back to the future: lessons learned from the 1918 Influenza pandemic.Front Cell Infect Microbiol. 2018;8:343.
26. Ahmed R, Oldstone MB, Palese P. Protective immunity and susceptibility to infectious diseases:lessons from the 1918 influenza pandemic. Nat Immunol. 2007;8:1188-93.
27. de Wit E, Siegers JY, Cronin JM, Weatherman S, van den Brand JM, Leijten LM et al. 1918 H1N1 influenza virus replicates and induces pro inflammatory cytokine responses in extrarespiratory tissues of ferrets. J Infect Dis. 2018;217:1237-46.
28. Kobasa D, Jones SM, Shinya K, Kash JC, Copps J, Ebihara H, et al. Aberrant innate immune response in lethal infection of macaques with the 1918 influenza virus. Nature. 2007;445:319-23.
29. Memoli MJ, Tumpey TM, Jagger BW, Dugan VG, Sheng ZM, Qi L, et al. An early 'classical' swine H1N1 influenza virus shows similar pathogenicity to the 1918 pandemic virus in ferrets and mice. Virology. 2009;393:338-45.
30. Taisheng L, Zhifeng Q, Linqi Z, Han Y, He W, Liu Z, et al.Significant changes of peripheral T lymphocyte subsets in patients with severe acute respiratory syndrome. J Infect Dis. 2004;189:648-51.
31. Henderson LA, Canna SW, Schulert GS, Volpi S, Lee PY, Kernan KF, et al. On the alert for cytokine storm: Immunopathology in COVID-19. Arthritis & Rheumatology. 2020. doi 10.1002/art.41285.
32. Channappanavar R, Perlman S. Pathogenic human coronavirus infections: cause and consequences of cytokine storm and immunopathology. Semin Immunopathol. 2017;39:529-39.
33. Ng PC, Lam CWK, Li AM, Wong CK.Inflammatory Cytokine Profile in Children With Severe Acute Respiratory Syndrome. Pediatrics. 2004;13:e7-e14.
34. Cao Z, Liu L, Du L, Zhang C, Jiang S, Li T, et al.Potent and persistent antibody responses against the receptor-binding domain of SARS-CoV spike protein in recovered patients. Virol J. 2010;7:299.
35. Ling Lin, Lianfeng Lu, Wei Cao, Taisheng Li.Hypothesis for potential pathogenesis of SARS-CoV-2 infection-a review of immune changes in patients with viral pneumonia. Emerging Microbes & Infections. 2020;9:728-32.
36. Wang F, Hou H, Luo Y, Tang G, Wu S, Huang M, et al.The laboratory tests and host immunity of COVID-19 patients with different severity of illness. JCI Insight. 2020. doi: 10.1172/jci.insight.137799.
37. Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al.Clinical treatment expert group for Covid-19. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382:1708-20.
38. Arabi YM, Mandourah Y, Al-Hameed F, Sindi AA, Almekhlafi GA, Hussein MA, et al. Corticosteroid therapy for critically ill patients with Middle East respiratory syndrome.Am J Respir Crit Care Med. 2018;197:757-67.
39. WHO. Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected. [Internet]. Disponível em: https://apps.who.int/iris/handle/10665/330893. Acessado em: 19/01/2020.
40. Yang Y, Shen C, Li J, Yuan J, Wei J, Huang F, et al. Plasma IP-10 and MCP-3 levels are highly associated with disease severity and predict the progression of COVID-19. Allergy Clin Immunol. 2020;20:30576-5.
41. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497-506.
42. Johnston SL. Asthma and COVID-19: is asthma a risk factor for severe outcomes? Allergy. 2020. doi: 10.1111/all.14348.
43. Sykes A, Edwards MR, Macintyre J, del Rosario A, Bakhsoliani E, Trujillo-Torralbo MB, et al. Rhinovirus 16-induced IFN-alpha and IFN-beta are deficient in bronchoalveolar lavage cells in asthmatic patients. J Allergy Clin Immunol. 2012;129:1506-14.
44. Zhang JJ, Cao YY, Dong X, Wang BC, Liao MY, Lin J, et al.Distinct characteristics of COVID-19 patients with initial rRT-PCR positive and negative results for SARS-CoV-2. Allergy. 2020. doi: 10.1111/ all.14316.
45. Wu Z, Mc Googan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: Summary of a report of 72314 cases from the chinese center for disease control and prevention. JAMA. 2020;13:1239-42.
46. Soresina A, Moratto D, Chiarini M, Paolillo C, Baresi G, Focà E, et al.Two X-linked agammaglobulinemia patients develop pneumonia as COVID-19 manifestation but recover. Pediatr Allergy Immunol. 2020. doi: 10.1111/pai.13263.



