Número Atual: Abril-Junho 2020 - Volume 4 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Uso do omalizumabe na urticária crônica espontânea: o que fazer após 6 meses?
Use of omalizumab in chronic spontaneous urticaria: what to do after 6 months?
Paula Natassya Argolo; Bruna Gehlen; Mariana Mousinho-Fernandes; Jorge Kalil; Antônio Abilio Motta; Rosana Câmara Agondi
DOI: 10.5935/2526-5393.20200022
Faculdade de Medicina da USP, Serviço de Imunologia Clínica e Alergia do Hospital das Clínicas - São Paulo, SP, Brasil
Endereço para correspondência:
Paula Natassya Argolo
E-mail: paula_argolo@yahoo.com.br
Submetido em: 15/05/2020
Aceito em: 23/06/2020
RESUMO
A urticária crônica espontânea (UCE) é uma condição rara, benigna e com sintomas que afetam adversamente a qualidade de vida, tanto dos pacientes quanto de seus familiares, visto que ainda não existe tratamento resolutivo. O manejo farmacológico de primeira linha consiste no uso de anti-histamínicos em doses licenciadas ou até quadruplicadas, e na ausência de resposta ao anti-histamínico, os consensos mundiais recomendam, na sequência, a adição de omalizumabe. Ambos são amplamente utilizados e considerados seguros e eficazes.No entanto, ainda há alguns questionamentos acerca da anti-IgE: quando e como suspender a medicação, por quanto tempo usar ou quando retornar o uso da mesma, caso haja recidiva. Logo, alguns artigos foram revisados visando melhor elucidação dessas dúvidas.
Descritores: Urticária crônica, omalizumabe, ciclosporina.
INTRODUÇÃO
Urticária crônica espontânea (UCE), é caracterizada pelo desenvolvimento de urticária, angioedema ou ambos, com duração de pelo menos seis semanas. A urticária é definida por três características principais: (a) edema central de tamanho variável, quase sempre rodeado por eritema reflexo; (b) presença de prurido ou, às vezes, sensação de queimação; (c) caráter fugaz, com retorno à normalidade da pele comumente dentro do período de 1 a 24 horas após o seu aparecimento. Já o angioedema é representado pelo edema súbito e acentuado da derme inferior e subcutâneo ou membranas mucosas, pode cursar com dor mais frequente que o prurido e evolui de forma lenta e gradual, com desaparecimento em até 72 horas1.
A UCE não tem fatores causais específicos, sendo necessário excluir outras causas. Os pacientes podem apresentar sintomas contínuos ou intermitentes, embora a causa da remissão entre os surtos da doença também seja desconhecida. Pode haver, ainda, uma combinação de urticária crônica induzida (UCInd) e UCE1-3.
Em um estudo de Maurer e cols.4 foi demonstrado o impacto significativo da UCE na qualidade de vida dos pacientes, sendo que o impacto nas mulheres foi maior do que nos homens. Muitos pacientes têm comorbidades psiquiátricas associadas, como ansiedade e depressão, e além disso, apenas dois terços dos pacientes utilizava alguma medicação prescrita para o tratamento da sua doença.
Existem questionários para a avaliação inicial da doença e também para fins de acompanhamento após o início do tratamento. São eles: escore de atividade da urticária (UAS), o escore de atividade do angioedema (AAS), o questionário de qualidade de vida da urticária crônica (CU-Q2oL), o questionário de qualidade de vida do angioedema (AE-QoL) e o teste de controle da urticária (UCT). Esses questionários são particularmente úteis em pacientes que apresentam pouco controle da doença, apesar da boa adesão ao tratamento. Logo, as pontuações nesses questionários podem ser usadas para orientar a seleção do tratamento de acordo com o status da doença do paciente1,5.Kaplan e cols.definiram que a resposta ao tratamento seria dada com base no UAS7 (UAS usado pelo período de 7 dias, com escore variando de 0 a 42), sendo a resposta completa quando UAS7 = 0, e urticária bem controlada quando UAS7 ≤ 66.
PILARES DO TRATAMENTO DA UCE E BIOMARCADORES
De acordo com a diretriz mundial de urticária, o objetivo seria tratar a doença até que ela desapareça (the goal of treatment is to treat the disease until it is gone), tratando o quanto for necessário e o mínimo possível, devendo ser considerado a segurança e a qualidade de vida de cada paciente1.
A desgranulação de mastócitos com a liberação de histamina e de outras moléculas/mediadores inflamatórios são considerados centrais aos sintomas da urticária. Logo, o tratamento inicial recomendado é o uso de anti-histamínicos de segunda geração. Caso não haja melhora após 2 a 4 semanas, estes podem ser aumentados até quatro vezes a dose licenciada. O tratamento de terceira linha consiste na adição do omalizumabe e, se não houver resposta após 6 meses, deve-se trocar o mesmo por ciclosporina, adicionado aos anti-histamínicos. O algoritmo de tratamento da UCE conforme consenso mundial está demonstrado na Figura 1. Vários estudos mostraram que 10-30% dos pacientes com UCE não atingiram o controle adequado da doença apesar do uso das medicações recomendadas pela diretriz mundial1,3,7.
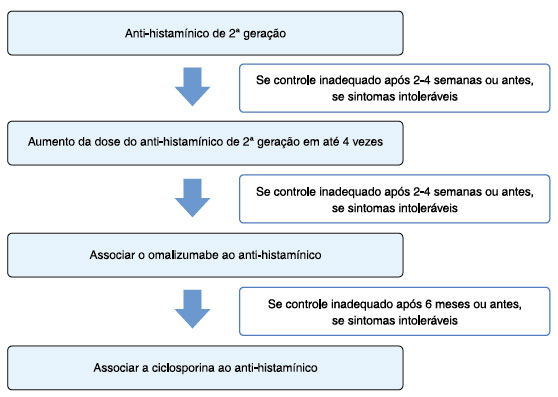
Figura 1. Algoritmo de tratamento da urticária crônica espontânea recomendado por consenso mundial. Modificado de Zuberbier et al.1
O estabelecimento de planos de tratamento personalizados permanece um dos maiores desafios da UCE. Há um interesse crescente em procurar marcadores objetivos que prevejam com segurança o prognóstico da doença e eficácia do tratamento terapêutico específico. Alguns fatores estão associados à maior gravidade da UCE como, por exemplo, início tardio da UCE, presença de angioedema, associação com UCInd, teste do autossoro positivo, D-dímero elevado, proteína C-reativa elevada e autoimunidade2,8-11. Além dos marcadores descritos acima, níveis de vitamina D e IgE total também têm sido associados à duração da doença8.
O teste de liberação de histamina de basófilos (BHRA) é utilizado para se detectar autoanticorpos no soro dos pacientes com UCE que são direcionados para FcεRI ou para IgE. Neste teste adiciona-se basófilos de indivíduos sem urticária ao soro do paciente com UCE e quantifica-se a histamina liberada pelos basófilos ativados12. Outro teste, o teste de ativação de basófilos (BAT), é um ensaio funcional que mede a função de IgE, isto é, sua habilidade para induzir a ativação de basófilos na presença do alérgeno. O BAT utiliza a citometria de fluxo para medir a expressão de marcadores de ativação na superfície de basófilos que aparecem após o estímulo do alérgeno através de sua ligação com a IgE específica13. Quando positivo, é preditivo de uma resposta tardia ao tratamento com omalizumabe, o que indicaria que a medicação atua na diminuição da expressão de FcεRI14.
O nível total de IgE é outro parâmetro a ser considerado, pois foi preditivo de resposta ao tratamento com omalizumabe. Pacientes que não responderam apresentaram níveis de IgE mais baixos. O nível de IgE pré-tratamento menor do que 40 UI/mL ou uma razão menor do que 2 na quarta semana podem estar associados a maior risco de não haver resposta ao tratamento2,15.
Observa-se também basopenia e elevação de D-dímero durante a UCE ativa, e há aumento dos basófilos e diminuição do D-dímero com a remissão da doença durante o tratamento anti-IgE.Todos esses biomarcadores necessitam de mais pesquisas para recomendações precisas, e no momento não se recomenda dosar o D-dímero ou realizar diagnóstico com base no número de basófilos1.
OMALIZUMABE
O omalizumabe é um anticorpo monoclonal humanizado anti-IgE recombinante que tem sua molécula composta por 95% de um anticorpo IgG1 humano e < 5% corresponde ao sítio de ligação ao anticorpo de origem murina. Ele inibe a ligação da IgE ao seu receptor de alta afinidade (FcεRI) na superfície dos mastócitos e basófilos, dessa forma, reduzindo a liberação de mediadores inflamatórios8,15-18.
O anti-IgE também leva a um down-regulation dos receptores FcεRI nos basófilos e mastócitos que são internalizados quando eles não são estabilizados pela ligação com a IgE. Isto leva à redução da resposta alérgeno específica dos mastócitos e basófilos, levando a um aumento do limiar para desgranulação dos mastócitos e diminuição da liberação de mediadores e citocinas por estas células19.
O omalizumabe está aprovado para o tratamento da UCE refratária aos anti-histamínicos H1 (AH1) não sedantes, e já foi demonstrado ser efetivo e seguro nas doses de 150 e 300 mg ao mês. O omalizumabe deve ser adicionado aos AH1, e a dose recomendada para tratamento da UCE é de 300 mg a cada 4semanas1,2,8,15,20.
Ainda existem muitos questionamentos sobre o uso desta medicação na UCE. Há dúvidas a respeito de quando suspendê-la em pacientes que respondem completamente, não há consenso sobre a definição do não respondedor e quando suspender a medicação para considerar outros tratamentos, ou ainda como manejar pacientes com retorno dos sintomas após descontinuação da medicação2,16,21.
A resposta ao omalizumabe ocorre a partir da primeira semana da sua aplicação para a maioria dos pacientes, porém, alguns pacientes podem apresentar uma resposta mais tardia, podendo ocorrer após a 5ª aplicação do omalizumabe. A constatação de que alguns pacientes com UCE têm resposta rápida ao tratamento, enquanto outros demoram mais tempo para obter uma resposta completa ao omalizumabe, sugere que interromper o tratamento antes de três meses pode ser muito cedo, e potencialmente perdese uma oportunidade de controlar os sintomas da UCE nos pacientes que apresentem uma resposta mais tardia ao medicamento6,21,22.
O consenso mundial, portanto, recomenda que se mantenha o omalizumabe por pelo menos 6 meses antes de se considerar outros tratamentos. Se não houver resposta após seis meses do início do tratamento, o consenso mundial aconselha considerar o paciente como um não respondedor, descontinuar o omalizumabe e ponderar uma opção de tratamento alternativa1,21.
Türk e cols. revisaram recentemente as principais questões mais frequentes e importantes sobre o uso do omalizumabe. Os autores proporcionaram respostas baseadas na experiência e abordagem prática do grupo2.
Para os pacientes que não respondam totalmente, pode-se aumentar a dose da medicação, podendose chegar a 450 ou 600 mg a cada 4 semanas, ou diminuir o intervalo de tempo da aplicação para a cada 3 ou 2 semanas. A escolha em aumentar a dose do omalizumabe nos pacientes com UCE com resposta parcial pode ser avaliada após a aplicação da terceira dose, levando-se em conta o controle adequado nos respondedores lentos1,2,8,14,21,23.
Conforme os autores, se ocorrer remissão completa da doença, a medicação deveria ser utilizada por um ano após a remissão dos sintomas, antes de se considerar a suspensão. Entretanto, nos relatos da literatura observa-se duas abordagens para a descontinuação da medicação. Na primeira, pode-se suspender assim que houver controle completo dos sintomas e manter o paciente sob vigilância. Na segunda, pode-se aumentar o tempo de administração em uma semana e, se não houver reaparecimento dos sintomas, ao alcançar oito semanas de intervalo entre cada aplicação, pode-se tentar a suspensão do omalizumabe. A descontinuação da medicação, aumentando-se o intervalo de tempo, pode diminuir uma eventual recaída e limitar a duração desta antes de um reinício de tratamento2,24.
Se houver recaída, o paciente deve ser retratado com omalizumabe, pois provavelmente não responderá aos anti-histamínicos2. Metz e cols. demonstraram que pacientes com UCE com resposta completa ao tratamento podem sofrer uma recorrência dos sintomas dentro de 2-8 semanas após a última aplicação (recaída precoce) ou ainda em 4 a 7 meses (recaída tardia)25. Em um estudo de Marcelino e cols. todos os pacientes que tiveram que reiniciar omalizumabe após sua suspensão, ou voltar a encurtar o intervalo entre as administrações, não tiveram nenhuma diminuição da resposta ao mesmo, o que mostra que o retratamento é efetivo e seguro nos pacientes que responderam anteriormente ao omalizumabe e pode-se retornar à mesma dose utilizada antes da suspensão26.
Em um estudo retrospectivo multicêntrico, os fatores idade (> 57 anos), obesidade (IMC ≥ 30 Kg/m²) e tratamento prévio com ciclosporina foram preditores de resposta incompleta à dose de 300 mg a cada 4 semanas. O uso anterior de ciclosporina na terapêutica da UCE pode dificultar a resposta por alterar o status imunológico do paciente ou por representar a gravidade da UCE23 (Tabela 1).

A ciclosporina é o medicamento de quarta linha para tratamento da UCE, porém, a associação de dose baixa de ciclosporina para os pacientes que respondem parcialmente ao omalizumabe pode ser uma alternativa terapêutica para a remissão dos sintomas. No entanto, vale ressaltar que o uso de altas doses de ciclosporina está associado a nefrotoxicidade e a hipertensão2,7.
A presença concomitante de UCInd confere à UCE maior gravidade e curso mais prolongado da doença. Vários estudos, ensaios clínicos e série de casos, mostraram que o omalizumabe era eficaz na UCE associada à UCInd, porém, seu uso na UCInd isolada ainda não está licenciado2,8,15.
A Figura 2 resume as principais sugestões quanto ao seguimento do paciente com UCE após 6 meses de tratamento com omalizumabe.
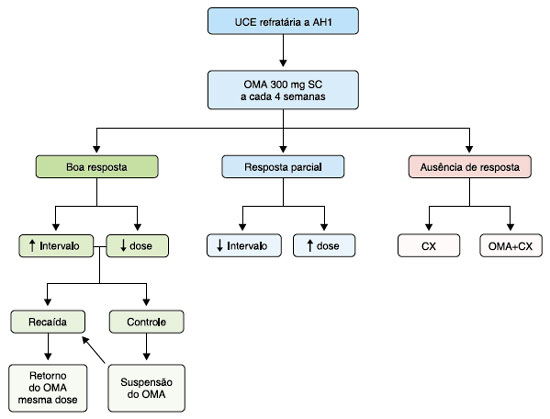
Figura 2 Resumo das principais sugestões quanto ao seguimento do paciente com urticária crônica espontânea após 6 meses de tratamento com omalizumabe
UCE = urticária crônica espontânea, AH1 = anti-histamínico H1, OMA = omalizumabe, SC = subcutâneo, CX = ciclosporina.
EFEITOS COLATERAIS/SEGURANÇA
O omalizumabe parece seguro e bem tolerado, tem poucos efeitos colaterais e, geralmente, estes são leves e autolimitados, como reação no sítio de aplicação do omalizumabe, dor, astenia, prurido, urticária, angioedema, cefaleia, febre e faringite. A incidência de anafilaxia descrita para pacientes com asma em uso de omalizumabe foi de 0,2%, entretanto, para pacientes com urticária crônica ainda há poucos relatos. Recomenda-se que durante as primeiras 3 administrações do medicamento, os pacientes fiquem em observação por um período de 2 horas, podendo-se reduzir esse intervalo para 30 minutos nas aplicações subsequentes. Por outro lado, é importante que os pacientes sejam capazes de reconhecer sinais e sintomas de anafilaxia e saibam utilizar a epinefrina autoinjetável em caso de necessidade. Recomenda-se parar a administração apenas se ocorrerem efeitos graves, como trombocitopenia, hipertensão, infecção retroperitoneal, abscesso pélvico e anafilaxia2,17,18,27,28.
CONSIDERAÇÕES FINAIS
Diante do exposto, uma alternativa seria manter os pacientes em tratamento com o omalizumabe por pelo menos 3 meses antes de aplicar alguma mudança no tratamento em relação ao AH1, e usar o mesmo por pelo menos 6 meses antes de considerar o paciente como não respondedor. Caso haja resposta após os 6 meses de uso, pode-se tentar a suspensão da medicação para avaliar se houve remissão espontânea, de 3 meses a um ano. A suspensão pode ser realizada com aumento do intervalo de tempo de administração até 8 semanas ou manter o intervalo de 4 semanas e reduzir a dose do omalizumabe. Caso haja recorrência, há evidência de que se pode retornar o anti-IgE com boa eficácia. Contudo, como visto anteriormente, é necessário que sejam realizados novos estudos e que haja padronização no tratamento acerca do tempo de uso, de como utilizar a medicação após a introdução e como realizar a suspensão da mesma. Além disso, como é um tratamento dispendioso, é importante que haja biomarcadores que possam prever o prognóstico e resposta ao tratamento, evitando gastos desnecessários e buscando maior conforto e qualidade de vida dos pacientes.
REFERÊNCIAS
1. Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, et al. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018;73:1393-414.
2. Türk M, Carneiro-Leão L, Kolkhir P, Bonnekoh H, Buttgereit T, Maurer M. How to treat patients with chronic spontaneous urticaria with omalizumab: questions and answers. J Allergy Clin Immunol Pract. 2020;8:113-24.
3. Maurer M, Church MK, Marsland AM, Sussman G, Siebenhaar F, Vestergaard FC, et al. Questions and answers in chronic urticaria: where do we stand and where do we go? European Academy of Dermatology and Venereology. 2016;30(Suppl. 5):7-15.
4. Maurer M, Ortonne JP, Zuberbier T. Chronic urticaria: a patient survey on quality-of-life, treatment usage and doctor-patient relation. Allergy. 2009;64:581-8.
5. Giménez Arnau AM, Valero Santiago A, Bartra Tomás J, Jáuregui Presa I, Labrador-Horrillo M, Miquel FJ, et al.Therapeutic strategy according to differences in response to omalizumab in patients with chronic spontaneous urticaria. J Investig Allergol Clin Immunol. 2019;29(5):338-48.
6. Kaplan A, Ferrer M, Bernstein JA, Antonova E, Trzaskoma B, Raimundo K, et al. Timing and duration of omalizumab response in patients with chronic idiopathic/spontaneous urticaria. J Allergy Clin Immunol. 2016;137:474-81.
7. Sánchez J, Alvarez L, Cardona R. Cyclosporine and omalizumab together: a new option for chronic refractory urticaria. J Allergy Clin Immunol Pract. 2020; Epub ahead of print.
8. Deza G, Ricketti PA, Giménez-Arnau AM, Casale TB. Emerging biomarkers and therapeutic pipelines for chronic spontaneous urticaria. J Allergy Clin Immunol Pract. 2018;6:1108-17.
9. Rabelo-Filardi R, Daltro-Oliveira R, Campo RA. Parameters associated with chronic spontaneous urticaria duration and severity:a systematic review. Int Arch Allergy Immunol. 2013;161:197-204.
10. Sanchez-Borges M, Caballero-Fonseca F, Capriles-Hulett A, Gozález-Aveledo L, Maurer M. Factors linked to disease severity and time to remission in patients with chronic spontaneous urticaria. J Eur Acad Dermatol Venereol. 2017;31:964-71.
11. Kolkhir P,AltrichterS,HawroT,Maurer M.C-reactiveproteinislinked to disease activity, impact, and response to treatment in patients with chronic spontaneous urticaria. Allergy. 2018;73:940-8.
12. SchoepkeN,AseroR,EllrichA, FerrerM,Giménez-ArnauA,Grattan CEH, et al. Biomarkers and clinical characteristics of autoimune chronic spontaneous urticaria:results of the PURIST study.Allergy. 2019;74:2427-36.
13. Hemmings O, Kwok M, McKendry R, Santos AF.Basophil activation test: old and new applications in allergy. Curr Allergy Asthma Rep. 2018;18:77.
14. Gericke J, Metz M, Ohanyan T, Weller K, Altrichter S, Skov PS, et al. Serum autoreactivity predicts time to response to omalizumab therapy in chronic spontaneous urticaria. J Allergy Clin Immunol. 2017;139:1059-61.
15. Incorvaia C, Mauro M, Makri E, Leo G, Ridolo E.Two decades with omalizumabe: what we still have to learn. Biologics: Targets and Therapy. 2018;12:135-42.
16. Türk M, Yilmaz I, Bahçecioglu SN. Treatment and retreatment with omalizumab in chronic spontaneous urticaria: Real life experience with twenty-five patients. Allergology International. 2018;67:85-9.
17. Silva PM, Costa AC, Mendes A, Barbosa MP. Long-term efficacy of omalizumab in seven patientswith treatment-resistant chronic spontaneous urticaria. Allergol Immunopathol (Madr). 2015;43(2):168-73.
18. Francés L, Leiva-Salinas M, Silvestre JF. Omalizumabe in the treatment of chronic urticaria. Actas Dermosifiliogr. 2014;105:45-52.
19. Kaplan AP. Mechanisms of action that contribute to efficacy of omalizumab in chronic spontaneous urticaria. Allergy. 2017;72:519-33.
20. Saini S, Rosen KE, Hsieh HJ, Wong DA, Conner E, Kaplan A, et al. A randomized, placebo-controlled, dose ranging study of single-dose omalizumab in patients with H1-antihistamine-refractory chronic idiopathic urticaria. J Allergy Clin Immunol. 2011;128:567-73.
21. Ferrer M, Boccon-Gibod I, Gonçalo M, Ínalöz HS, Knulst A, Lapeere H, et al. Expert opinion: defining response to omalizumab in patients with chronic spontaneous urticaria. Eur J Dermatol. 2017;27:455-63.
22. Metz M, Ohanyan T, Church MK, Maurer M. Omalizumab is an offective and rapidly acting therapy in difficult-to-treat chronic urticaria: a retrospective clinical analysis. J Dermatol Sci. 2014;73:57-62.
23. Curto-Barredo L, Spertino J, Figueras-Nart I, Exposito-Serrano V, Guilabert A, Mele-Ninot G, et al. Omalizumab updosing allows disease activity control in patients with refractory chronic spontaneous urticaria. Br J Dermatol. 2018;179:210-2.
24. Türk M, Maurer M, Yilmaz I. How to discontinue omalizumab in chronic spontaneous urticaria? Allergy. 2019;74:821-4.
25. Metz M, Ohanyan T, Church MK, Maurer M. Reatreatment with omalizumab results in rapid remission in chronic spontaneous and inducible urticaria. JAMA Dermatoly. 2014;150:288-90.
26. Marcelino J, Costa C, Aguiar P, Pereira-Barbosa M. Identificação de diferentes padrões de resposta ao omalizumab em doentes com urticária crônica espontânea. Rev Port Imunoalergologia. 2018;26:109-19.
27. Galvão VR, Castells MC. Hypersensitivity to biological agents-updated diagnosis, management and treatment. J Allergy Clin Immunol Pract. 2015;3:175-85.
28. Ertas R, Özyurt K, Yildiz S, Ulas Y, Turasan A, Avci A. Adverse reaction to omalizumab in patients with chronic urticaria:flare up or ineffectiveness? Iran J Allergy Asthma Immunol. 2016;15:82-6.



