Número Atual: Julho-Setembro 2019 - Volume 3 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Teste de provocação oral descarta alergia aos fármacos
Oral challenge test rules out drug allergy
Cíntia de Matos Rodrigues da Silva; Débora Carla Chong-Silva; Carlos Antônio Riedi; Herberto Jose Chong-Neto; Nelson Augusto Rosario-Filho
DOI: 10.5935/2526-5393.20190043
Universidade Federal do Paraná, Serviço de Alergia e Imunologia - Departamento de Pediatria - Hospital de Clínicas da UFPR - Curitiba, PR, Brasil
Endereço para correspondência:
Cíntia de Matos Rodrigues da Silva
E-mail: cintia.mrs@hotmail.com
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Submetido em: 28/08/2019
Aceito em: 05/09/2019
RESUMO
O objetivo deste estudo foi avaliar a utilidade do teste de provocação oral (TPO) em pacientes encaminhados para investigação de reações alérgicas a medicamentos. Foi realizado um estudo analítico, transversal, com coleta de dados de pacientes de 0 a 14 anos, com história de reação adversa a medicamentos no período entre junho de 2017 a junho de 2019. Os pacientes foram submetidos aos testes cutâneos alérgicos por puntura (TCA), e na sequência, TPO com os medicamentos suspeitos. Os TPO foram abertos, e se o paciente apresentasse manifestação clínica compatível, o teste era interrompido e considerado positivo. Foram avaliadas 38 reações com fármacos orais. Dentre os 36 pacientes submetidos aos TPO, 23 (63,8%) eram do sexo masculino, média de idade de 5,7 anos; 32 (88,8%) tinham história de atopia, e 13 (36,1%) apresentaram teste cutâneo positivo para aeroalérgenos. Todos (n = 38) relataram sinais e sintomas cutâneos, 9 (25%) com sintomas respiratórios, 2 (5,5%) com sintomas gastrointestinais e 1 (2,7%) com outros sintomas. Todos os TCA para os fármacos avaliados foram negativos. Os TPO foram realizados com: antibióticos em 21 (55,2%), 16 (42,1%) com analgésicos e anti-inflamatórios, e 1 com prednisona (2,6%). Dentre os TPO, somente 1 (2,6%) foi positivo ao ibuprofeno. Concluiu-se que o teste de provocação oral a fármacos teve a finalidade de excluir, mais do que confirmar alergia, o que reforça a importância da confirmação, uma vez que a prevalência de alergia medicamentosa confirmada é baixa, sobretudo em crianças.
Descritores: Antibacterianos, hipersensibilidade a drogas, pediatria.
Introdução
A Organização Mundial da Saúde definiu reação adversa a medicamentos (RAM) como qualquer efeito nocivo, não intencional e indesejado de um medicamento que ocorre em doses usadas para prevenção, diagnóstico ou tratamento de doenças. Reações tipo A (80% dos casos) são previsíveis, comuns e relacionadas às ações farmacológicas do medicamento, como por exemplo, toxicidade induzida pelo fármaco, efeitos colaterais, efeitos secundários e interações medicamentosas. Reações tipo B (10% dos casos) são imprevisíveis, incomuns e geralmente não relacionadas às ações farmacológicas do medicamento, como por exemplo, intolerância, idiossincrasia e hipersensibilidade1-2.
As reações de hipersensibilidade a fármacos (RHF) são definidas como qualquer reação iniciada por estímulo definido e que pode ser reproduzida, podendo ser alérgicas ou não alérgicas, conforme apresentem ou não mecanismo imunológico como desencadeante, e correspondem a 15% das reações adversas a medicamentos2,3.
As RHF são classificadas em quatro categorias, denominadas reações de tipo I-IV. As reações tipo I são mediadas por anticorpos IgE, ocorrem minutos a horas após a exposição à droga e envolvem sintomas como urticária, angioedema, anafilaxia, broncoespasmo, prurido e diarreia. As reações do tipo II são citotóxicas, ocorrem em tempo variável e podem apresentar sintomas como anemia, neutropenia e trombocitopenia imune. As reações do tipo III são de complexo imunológico, ocorrem de uma a três semanas após a exposição e podem apresentar sintomas como doença do soro, febre, erupção cutânea, artralgias, linfadenopatia, glomerulonefrite, urticária, vasculite. As reações do tipo IV são reações tardias ou mediadas por células, ocorrem de dois a sete dias após a exposição ao fármaco e podem apresentar sintomas como dermatite alérgica de contato e erupção cutânea maculopapular4.
A prevalência de alergia a fármacos na população geral não é conhecida, no entanto estima-se que afete 7% da população geral, 20% dos doentes hospitalizados, e que represente 8% das admissões hospitalares. Podem ser potencialmente fatais em aproximadamente 0,15% dos casos5. Na faixa etária pediátrica, estima-se uma incidência global de reações adversas a medicamentos em 10,9% das crianças hospitalizadas, 1% dos atendimentos ambulatoriais, assim como de 1,8% a frequência de crianças internadas por reações alérgicas aos fármacos6. Os medicamentos mais comuns nas reações alérgicas aos fármacos são os antibióticos e anti-inflamatórios não esteroidais, provavelmente devido a sua alta utilização7.
As ferramentas que permitem o diagnóstico definitivo de RHF incluem: história clínica, testes in vivo, como teste cutâneo alérgico, teste intradérmico, teste de contato, testes de provocação oral ou intravenoso, e testes in vitro8.
Os testes cutâneos alérgicos (TCA) são particularmente importantes para demonstrar reações mediadas por IgE. Os TCA por puntura são mais específicos e seguros, porém menos sensíveis que o teste intradérmico (TI). No entanto, os TI são mais propensos a desencadear reações alérgicas sistêmicas e, portanto, só devem ser realizados após o TCA e por profissional experiente, em ambiente hospitalar com equipamento disponível para ressuscitação9.
O teste de provocação (TP) com fármacos é considerado o padrão-ouro para estabelecer ou excluir o diagnóstico de RHF, porém não consegue diferenciar reações alérgicas de não alérgicas10. Deve ser realizado no mínimo 4 semanas após a RAM, com o paciente estável, sempre que possível com o fármaco implicado e utilizando a mesma via de administração. A maioria dos testes é realizada por via oral pela segurança. Alguns grupos de fármacos são mais investigados através do TP quando os testes cutâneos são negativos, como anti-inflamatórios, anestésicos locais e antibióticos. Na vigência de uma história clínica com elevado valor preditivo positivo, é mais sensata a realização direta de TP com fármaco alternativo11.
O objetivo deste estudo foi avaliar a utilidade do TP oral em pacientes encaminhados para investigação de reação alérgica a medicamentos.
Métodos
Foi realizado um estudo analítico, transversal, com coleta de dados de pacientes pediátricos, atendidos no serviço de Alergia e Imunologia Pediátrica do Hospital de Clínicas da Universidade Federal do Paraná, com história de RAM no período entre junho de 2017 a junho de 2019.
Foram incluídos no estudo pacientes de 0 a 14 anos com história de alergia a fármacos administrados por via oral, submetidos a TCA e TPO com os medicamentos suspeitos.
Os testes de puntura foram realizados nas seguintes concentrações: paracetamol 200 mg/mL, ibuprofeno 50 mg/mL, dipirona 500 mg/mL, amoxicilina 50 mg/mL e cefalexina 50 mg/mL. Foram considerados positivos quando apresentaram pápula com diâmetro igual ou maior a 3 mm em leitura após 15 minutos, com realização de controle positivo com histamina 10 mg/mL e controle negativo com solução fisiológica.
Os testes de provocação oral foram abertos e realizados em ambiente hospitalar conforme o protocolo seguinte: a cada 15 minutos era administrada uma dose do fármaco nas concentrações progressivas de 10%, 20%, 30% e 40% da dose total, somando-se uma dose cumulativa de 100% da dose terapêutica do respectivo fármaco. Se o paciente apresentasse qualquer alteração clínica compatível com reação alérgica, o teste era interrompido e considerado positivo. Os pacientes permaneceram em observação clínica por no mínimo 2 horas após término da última etapa (período de maior ocorrência de reações graves).
O trabalho foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos do Complexo Hospital de Clínicas da Universidade Federal do Paraná, e todos os pais e/ou responsáveis assinaram o Termo de Consentimento Livre e Esclarecido.
Resultados
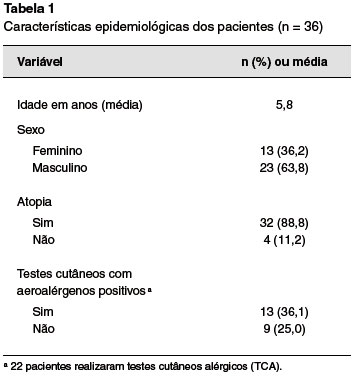
Foram avaliados 36 pacientes, sendo 23 (63,8%) do sexo masculino, com média de idade de 5,7 anos, 32 (88,8%) com história de atopia e 13 (36,1%) apresentando teste cutâneo positivo para pelo menos um aeroalérgeno (Tabela 1).
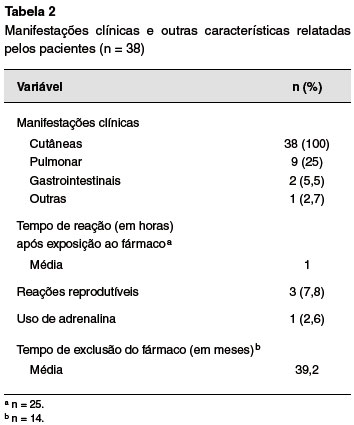
Foram avaliadas 38 reações adversas a medicamentos. Dentre as reações descritas, todas (n = 38) tinham sinais e sintomas cutâneos, com relato de urticária em 28 (73,6%), angioedema em 13 (34,2%), pápulas em 3 (7,8%) e vesículas em 1 (2,6%) dos casos.
Havia relato de sinais e sintomas respiratórios em 9 (25%) das reações, sendo 7 (18,4%) dispneia, 1 (2,6%) tosse, e 1 (2,6%) queda de saturação. Houve sinais e sintomas gastrointestinais em 2 (5,5%) das reações, sendo 1 (2,6%) vômito, e 1 (2,6%) dor abdominal. Hipotensão arterial ocorreu em 1 (2,6%) reação, e 1 (2,6%) com irritabilidade.
O tempo médio da reação após a exposição ao fármaco foi de 1 hora. Três pacientes relatavam que as reações eram reprodutíveis (7,6%). Uma relatou o uso de adrenalina (2,6%). O tempo de exclusão médio do fármaco foi de 39,2 meses (Tabela 2).
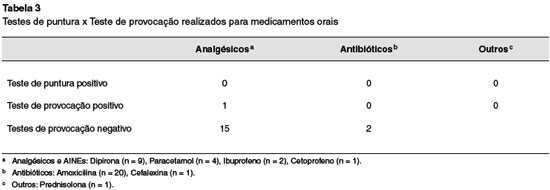
Foram avaliadas 38 reações medicamentosas, havendo relato de 21 (55,2%) reações com antibióticos, sendo 20 com amoxicilina, e 1 com cefalexina; 16 (42,1%) reações com analgésicos e anti-inflamatórios, sendo 9 com dipirona, 4 com paracetamol, 2 com ibuprofeno e um com cetoprofeno; e uma reação com prednisolona (2,6%).
Todos os TCA foram negativos. Dentre os testes de provocação, somente um foi positivo ao ibuprofeno. O paciente do sexo masculino, com 1 ano e 6 meses, tinha relato de urticária logo após o uso da medicação.
Quando submetido ao teste de provocação, o paciente apresentou erupção pruriginosa e rouquidão logo após administração da primeira dose (10% da dose total administrada), sendo administrada medicação para os sintomas e finalizado o teste. O paciente foi orientado a excluir a medicação (Tabela 3).
Discussão
Este estudo reforça a importância da confirmação diagnóstica das reações de hipersensibilidade por meio dos testes cutâneos, testes intradérmicos e testes de provocação, uma vez que a não confirmação leva à exclusão desnecessária de fármacos importantes. Como consequências, há o aumento do custo do tratamento, o aumento da resistência antimicrobiana e uma variedade de eventos adversos, incluindo a infecção por Clostridium difficile 12.
A população pediátrica tem menor prevalência de alergia do que a população adulta na maioria dos estudos (7,1 contra 16,8%), o que pode justificar a baixa confirmação de alergia a fármacos neste estudo pediátrico. Tivemos uma reação confirmada por teste de provocação oral dentre as 38 reações relatadas (2,6%).
Neste estudo, 88,8% dos pacientes eram atópicos, com diagnóstico de asma, rinite ou dermatite atópica, pois se tratava de uma população que fazia acompanhamento em ambulatório especializado. Há controvérsia se a atopia pode aumentar o risco de alergia medicamentosa13.
Em nosso estudo, tivemos um único TPO positivo para ibuprofeno, com TCA negativo. Esse achado pode estar relacionado ao fato de que as reações aos anti-inflamatórios podem ser imunológicas: mediadas por IgE ou células T ou não imunológicas: relacionadas à inibição de cicloxigenase-1 (COX-1)13, como por exemplo: doença respiratória, doença cutânea ou urticária/angioedema/anafilaxia induzidas por anti-inflamatórios não esteroidais (AINEs). Portanto, quando a reação é mediada por COX-1, os TCA que são utilizados para diagnóstico de reações IgE mediadas podem apresentar resultado negativo, sendo necessário TPO para confirmação diagnóstica14.
Nosso estudo está em concordância com outros que mostram que na faixa etária pediátrica a causa mais comum de hipersensibilidade a fármacos são os AINEs, sendo o ibuprofeno a causa mais comum15.
A amoxicilina é um medicamento de uso frequente em pediatria, e é comum o relato de alergia a este fármaco. Em nosso estudo, nenhum dos 20 relatos resultaram em TCA ou TPO positivos. De forma divergente, na literatura, há relato de confirmação em 8-16% dos casos, sendo menor nos casos em que a manifestação clínica inicial é de anafilaxia, chegando a 3,5-4,7% dos casos16.
A baixa positividade de confirmação de reações de hipersensibilidade à amoxicilina pode estar relacionada aos seguintes fatores: ocorrência de erupções benignas tardias envolvendo reações tipo IV que podem ou não ocorrer quando os pacientes são novamente expostos ao fármaco; diminuição da alergia mediada por IgE ao longo do tempo, e 80% dos pacientes tornando-se tolerantes após uma década e porque muitos pacientes nunca foram alérgicos, mas podem ter tido outra causa para os sintomas, como uma infecção viral concomitante12.
A prevalência de reações de hipersensibilidade tipo imediatas para corticosteroides tem sido estimada em 0,1% a 0,3%, o que é raro em relação ao uso frequente em todo o mundo. Em contraste, reações do tipo tardio, principalmente dermatite de contato alérgica a corticosteroides tópicos, tem uma estimativa de prevalência de até 5%. Em muitos casos, o paciente não é alérgico propriamente à medicação, mas sim às substâncias presentes em composições tópicas, orais ou parenterais como carboximetilcelulose, ésteres (por exemplo: succinato, fosfato, butirato) ou lactose, presentes em composições tópicas, orais ou parenterais17.
Um estudo de base de dados PubMed entre 2004 e 2014 encontrou 112 reações aos corticosteroides. O TCA foi positivo em 39,3%. Haviam 14 reações relatadas a prednisolona oral, sendo 4 confirmadas em pacientes de 10, 23, 65 e 78 anos de idade, sendo 2 confirmadas por TCA e 2 com confirmadas com TID (após TCA negativo), sendo que 3 tinham relato de anafilaxia prévia, enquanto a outro relatada urticária18. Em nosso estudo, o paciente com relato de reação à prednisolona apresentou TCA e TPO negativos, demonstrando que na população pediátrica, as reações alérgicas aos corticosteroides podem não ser uma realidade.
Conclusão
O teste de provocação oral a fármacos teve a finalidade de excluir, mais do que confirmar alergia, o que reforça a importância da confirmação, uma vez que a prevalência de alergia medicamentosa confirmada é baixa, sobretudo em crianças.
Referências
1. Gruchalla R. Drug allergy. J Allergy Clin Immunol. 2003;111;548-59.
2. Bernd LAG. Alergia a medicamentos. Rev Bras Alerg Imunopatol. 2005;28:125-32.
3. Ensina LF, Fernandes FR, Di Gesu G, Malaman MF, Chavarria ML, Bernd LAG, et al. Reações de hipersensibilidade a medicamentos. Rev Bras Alerg Imunopatol. 2009;32:42-7.
4. Riedl M, Casillas AR. Adverse drug reactions: types and treatment options. Am Fam Physician. 2003;68(9):1781-90.
5. Gomes ER, Demoly P. Epidemiology of hypersensitivity drug reactions. Curr Opin Allergy Clin Immunol. 2005;5:309-16.
6. Lazarou J, Pomeranz BH, Corey PN. Incidence of adverse drug reactions in hospitalized patients: a meta-analysis of prospective studies. JAMA. 1998;279:1200-5.
7. Sousa-Pinto B, Fonseca JA, Gomes ER. Frequency of self-reported drug allergy. Ann Allergy Asthma Immunol. 2019;119:362-73.
8. Aun MV, Malaman MF, Felix MMR, Menezes UP, Queiroz G, Rodrigues AT, et al. Testes in vivo nas reações de hipersensibilidade a medicamentos - Parte II: testes de provocação. Arq Asma Alerg Imunol. 2018;2(4):390-8.
9. Mirakian R, Ewan PW, Durham SR, Youlten LJ, Dugué P, Friedmann PS et al. BSACI guidelines for the management of drug allergy. Clin Exp Allergy. 2009;39:43-61.
10. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, et al. International Consensus on drug allergy. Allergy. 2014;69(4):420-37.
11. Menezes UP, Cordeiro DL, Melo JML. Aspectos práticos no diagnóstico e manejo das reações de hipersensibilidade a fármacos. Braz J Allergy Immunol. 2014;2(3):91-106.
12. Shenoy ES, Macy E, Rowe T, Blumenthal KG. Evaluation and management of penicillin allergy: a review. JAMA. 2019;321:188-99.
13. Sousa-Pinto B, Fonseca JA, Gomes ER Frequency of self-reported drug allergy. Ann Allergy Asthma Immunol. 2017;119,362-73.
14. Kidon M, Blanca-Lopez N, Gomes E, Terreehorst I, Tanno L, Ponvert C, et al. EAACI/ ENDA Position paper: Diagnosis and management of hypersensitivity reactions to Non-Steroidal Anti-inflammatory drugs in children and adolescentes. Pediatr Allergy Immunol. 2018;29:469-80.
15. Zambonino MA, Torres MJ, Muñoz C, Requena G, Mayorga C, Posadas T, et al. Drug provocation tests in the diagnosis of hypersensitivity reactions to non-steroidal anti-inflammatory drugs in children. Pediatr Allergy Immunol. 2013:24(2):151-9.
16. Azevedo J. Anaphylaxis to beta-lactam antibiotics at pediatric age: Six-year survey. Allergol Immunopathol. 2019;47:128-32.
17. Baker A, Empson M, The R, Fitzharris P. Skin testing for immediate hypersensitivity to corticosteroids:a case series and literature review. Clin Exp Allergy. 2015;45:669-76.
18. Patel A, Bahna SL. Immediate hypersensitivity reactions to corticosteroids. Ann Allergy Asthma Immunol.2015;115(3):178-82. e3.