Número Atual: Julho-Setembro 2019 - Volume 3 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Síndrome de Enterocolite Induzida por Proteína Alimentar (FPIES): um novo diagnóstico diferencial para alergia alimentar
Food Protein-Induced Enterocolitis Syndrome (FPIES): a new differential diagnosis for food allergy
Yara Henrique Martins Costa1; Lúcia Gutheil-Gonçalves2; Denise Tiemi-Miyakawa2; Cristine Secco Rosário3; Débora Carla Chong-Silva3; Carlos Antônio Riedi3; Nelson Augusto Rosario-Filho3; Herberto Jose Chong-Neto3
DOI: 10.5935/2526-5393.20190036
1. Universidade Federal do Paraná, Departamento de Pediatria - Curitiba, PR, Brasil
2. Universidade Federal do Paraná, Gastroenterologia Pediátrica, Complexo Hospital de Clínicas - Curitiba, PR, Brasil
3. Universidade Federal do Paraná, Serviço de Alergia e Imunologia, Complexo Hospital de Clínicas - Curitiba, PR, Brasil
Endereço para correspondência:
Herberto Jose Chong-Neto
E-mail: h.chong@uol.com.br
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Submetido em: 23/09/2019
Aceito em: 30/09/2019
RESUMO
A síndrome de enterocolite induzida por proteína alimentar, conhecida como "FPIES" (do inglês: Food Protein-Induced Enterocolitis Syndrome) é uma das apresentações da alergia alimentar não IgE mediada. Tema antes considerado raro, torna-se cada vez mais frequente nos pronto-atendimentos pediátricos. Através dos dados disponíveis na literatura, buscou-se relatar apresentação, diagnóstico e manejo da FPIES. Foi realizada busca ativa na base de dados PubMed do termo "food protein-induced enterocolitis" entre 2014 e 2019. Foram selecionados os artigos cuja população em estudo compunha a faixa etária pediátrica, e artigos completos que estavam disponíveis. Os pacientes usualmente descritos são lactentes com vômitos incoercíveis, diarreia, palidez, letargia e desidratação. Destes, alguns casos evoluem para choque hipovolêmico e acidose metabólica, podendo levar a diagnósticos equivocados. A proteína do leite de vaca, soja e arroz compõem os principais desencadeantes da doença. Entretanto, há diversos alimentos descritos neste processo. O diagnóstico dá-se através de história clínica compatível associada à reprodutibilidade dos sintomas quando ocorre reexposição ao alimento suspeito. O manejo agudo fundamenta-se na expansão volêmica, ondansetrona e corticoide, nos casos graves. Devido aos múltiplos fenótipos existentes, curto período de estudo, prevalência e patogenia incerta, a FPIES apresenta muitas lacunas a serem preenchidas. Assim, o presente estudo apresenta os consensos disponíveis e divergências atuais.
Descritores: Hipersensibilidade alimentar, hipersensibilidade, enterocolite.
Introdução
A Síndrome de Enterocolite Induzida por Proteína Alimentar, reconhecida em inglês como FPIES (Food Protein-Induced Enterocolitis Syndrome), é classificada como alergia alimentar não IgE mediada1. Apesar de ser bem caracterizada clinicamente, sua fisiopatologia é pouco compreendida. Apresenta repercussões no sistema gastrointestinal, principalmente em crianças com idade abaixo de 2 anos. Deve ser tratada como urgência pediátrica devido à heterogeneidade de manifestações clínicas, algumas potencialmente graves. A forma aguda é caracterizada por vômitos profusos após 1-4 horas e/ou diarreia em até 24 horas após consumo de alimento desencadeante. A forma crônica resulta da exposição crônica diária à proteína alimentar patogênica. Diarreia persistente, vômitos intermitentes e déficit pôndero-estatural compõem a FPIES crônica2.
Embora considerada rara, provavelmente não o seja. Apesar dos primeiros relatos serem publicados em 1970, a FPIES passou a integrar a Classificação Estatística Internacional de Doenças e Problemas Relacionados com a Saúde (CID 10), somente em outubro de 2015 (CID 10 K52.2)1,3. Uma coorte prospectiva em Israel revelou incidência de 0,34% de FPIES à proteína do leite de vaca entre lactentes nascidos em um único hospital durante 2 anos1. Sua real prevalência permanece ainda desconhecida devido à combinação de falta de diagnóstico e de relatos3.
Variações regionais sobre os desencadeantes mais frequentes, número de desencadeantes, fenótipos clínicos e padrão de resposta aos tratamentos propostos foram publicados1,2,4. Embora o Consenso Internacional tenha sido publicado em 2017 na tentativa de unificar as condutas diversas, essa alergia alimentar carece de estudos epidemiológicos específicos e em larga escala, para melhor caracterização da doença. O presente estudo buscou identificar e relatar os dados mais frequentes quanto à apresentação, diagnóstico e manejo da FPIES1.
Métodos
Para seleção dos artigos, foi realizada busca ativa na base de dados PubMed, onde 256 citações foram encontradas para "food protein-induced enterocolitis", das quais 154 eram entre 2014 e 2019. Cento e duas citações referentes a estudos em seres humanos e 66 publicações referentes a população entre 0-18 anos estavam disponíveis na íntegra, excluindo-se os relatos e séries de casos, mantendo-se os estudos mais relevantes.
Fisiopatologia
Os mecanismos pelos quais a FPIES se desenvolve permanecem incertos5. Os sintomas parecem resultar de defeito na função imunológica e de barreira do trato gastrointestinal. A ingestão do alérgeno alimentar associada a defeitos locais gera inflamação intestinal não mediada por IgE, com consequente alteração da sua permeabilidade, que propicia o desvio de fluidos para o lúmen do trato digestivo1,2,5,6.
A hipersensibilidade mediada por células pode desempenhar importante papel no desenvolvimento da doença1,7. Enquanto o mecanismo das alergias IgE mediadas é totalmente conhecido, na FPIES existem ainda muitas lacunas a serem preenchidas sobre sua fisiopatologia8.
A exposição aos alérgenos alimentares gera um rápido aumento dos leucócitos circulantes, associado ou não a desvio à esquerda, e configura um dos critérios diagnósticos5,8. A neutrofilia em sangue periférico é característica da FPIES, com pico após 6 horas da ingestão do alimento suspeito6,7. A trombocitose aguda, também descrita, talvez represente resposta à adrenalina liberada pelo stress, deslocando plaquetas do baço para circulação5.
Alguns pacientes apresentam baixos níveis de anticorpos IgE específicos ao alimento causal, chamadas de "FPIES atípicas". A presença de IgE específica parece traduzir quadros persistentes da doença. A real contribuição da imunidade humoral na fisiopatologia da doença permanece incerta2,8.
Alérgenos alimentares
A prevenção adequada baseia-se no conhecimento dos alérgenos alimentares envolvidos em cada caso4. Embora muitos bebês e crianças apresentem FPIES para leite de vaca, soja, peixe, ovos, boa parte também reagirá a alimentos comumente classificados com baixo potencial alergênico4,9,10. O arroz foi considerado o desencadeante sólido mais comum, seguido por vegetais e frutas, na Austrália11. A negligência do potencial alergênico de certos alimentos impede a associação do consumo aos sintomas, dificultando o diagnóstico9. Os frutos do mar estão associados a FPIES em crianças maiores ou ainda na fase adulta2,9,10.
O número de alimentos ao qual cada criança, individualmente, desenvolve FPIES permanece incerto. A maior parte dos pacientes com FPIES reage a apenas um alimento10,11. Crianças que apresentam precocemente reação a frutas, vegetais ou ambos são consideradas com alto risco de FPIES para múltiplos alimentos11. Quanto maior o número de alimentos a serem evitados, maior o impacto na qualidade nutricional da dieta2,4.
Os lactentes com FPIES parecem tolerar os alérgenos através do leite materno sem necessidade de uma dieta de exclusão materna4. O aleitamento materno parece ser um fator protetor na FPIES2,6, pois enquanto vigente, sua ocorrência é rara6,12, devendo ser preservado sempre que possível4,13. Entretanto, esses pacientes não estão isentos da FPIES aos alimentos sólidos9.
Múltiplos fatores podem contribuir para a heterogeneidade de dados. Dentre eles, a coexistência de atopia, tempo de amamentação, microbioma intestinal, hábitos alimentares regionais, taxa de amamentação e frequência do uso de fórmulas infantis1,10.
Apresentação clínica
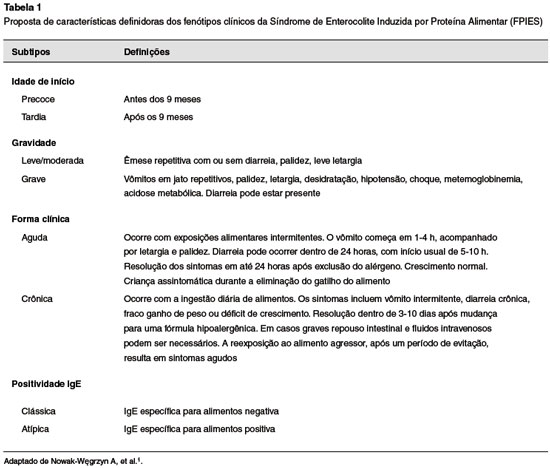
Dependendo da idade, frequência e dose do antígeno alimentar ingerido, as manifestações da FPIES sofrem modificações9,14. A capacidade de provocar reações distintas e muitas vezes graves aos alimentos é característica marcante da doença. Os fenótipos clínicos são caracterizados na Tabela 11,2. A idade de início dos sintomas é variável, podendo manifestar-se desde os primeiros dias de vida até após a introdução alimentar1,15. Nesta faixa etária, o leite e a soja são os desencadeantes mais prevalentes. Após o início da alimentação complementar e sua posterior diversificação, aumenta a incidência de reações causadas por alimentos sólidos6.
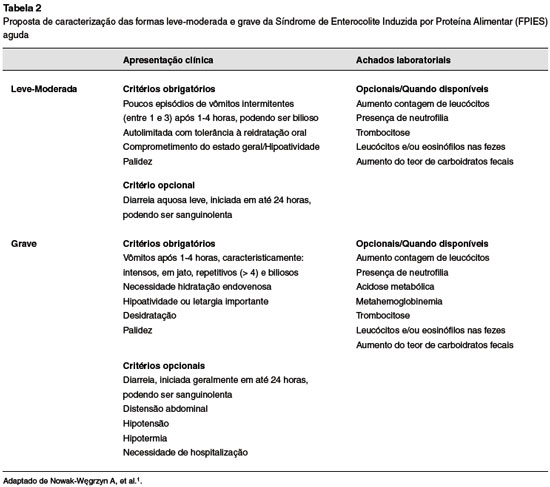
A síndrome é classicamente descrita com duas apresentações: aguda e crônica1,2. A FPIES aguda é marcada por vômitos graves e incoercíveis, após 1-4 horas da exposição, frequentemente resultando em palidez, letargia e desidratação2,16. Diarreia em até 24 horas após a ingestão do alérgeno geralmente está presente, podendo esta ser sanguinolenta2. Dentre os achados laboratoriais, observa-se a ocorrência de trombocitose, neutrofilia, eosinofilia, acidose metabólica e metahemoglobinemia2,16. Após exclusão do desencadeante, a resolução clínica ocorre em até 24 horas da ingestão. Não se observa prejuízo do crescimento e desenvolvimento2,6.
A FPIES crônica, usualmente descrita antes dos 4 meses de idade, decorre da exposição precoce e diária ao alérgeno alimentar, tipicamente à proteína do leite de vaca ou soja2,17. Os sintomas são observados após 1-4 semanas da introdução do alérgeno à dieta. O consumo regular gera sintomas crônicos, que incluem vômitos intermitentes, diarreia, irritabilidade e desidratação, resultando em hipoalbuminemia e baixo ganho de peso9,17,18,19. Há relatos de diarreia aquosa, com muco e/ou sangue6,18,19. A remissão dos sintomas ocorre dentro de 3-10 dias após a exclusão do alimento responsável. A reexposição, acidental ou planejada, gera sintomas agudos e confirma seu diagnóstico2,6.
O diagnóstico precoce pode previnir a depleção progressiva causada pela doença e suas possíveis complicações17. Critérios que auxiliam a categorização da repercussão clínica da doença são apresentados na Tabela 21,2.
Diagnóstico
Identificar os pacientes com FPIES é ainda um desafio9. O diagnóstico é composto de história clínica compatível, sinais e sintomas característicos, associados à melhora após retirada do desencadeante suspeito, exclusão de outras possíveis causas e teste de provocação oral (TPO) para casos selecionados1,2,6. Dados clínicos relevantes foram organizados de forma a compor critérios diagnósticos para a doença.
A ocorrência de vômitos após 1-4 horas do consumo de comida suspeita, na ausência de sintomas respiratórios ou cutâneos mediados por IgE, representa o critério maior da FPIES aguda. Quando associado a três ou mais dos critérios menores, descritos na Tabela 3, estabelece o diagnóstico do quadro agudo1,2.
Além disso, embora não seja um critério diagnóstico, é importante reconhecer que as reações agudas de FPIES têm resolução em poucas horas. De modo oposto, a gastroenterite viral, doença frequente em pediatria, necessita de alguns dias para sua completa recuperação1,2.
A presença de vômitos e diarreia, intermitentes e progressivos, com variados graus de desidratação, sem a realização de TPO, fornece apenas diagnóstico presuntivo da FPIES crônica1,2,6. Por meio dos critérios citados na Tabela 4, o diagnóstico para os pacientes ainda em investigação é padronizado1,2.
Teste de provocação oral (TPO)
Apesar de ser o exame padrão-ouro para diagnóstico, permanece reservado aos pacientes cuja história clínica é inconclusiva, devido aos riscos inerentes ao teste6. Fundamental durante o acompanhamento, o TPO também permite avaliar a aquisição de tolerância ao alimento suspeito3,9.
O TPO deve ser realizado sob supervisão médica, em ambiente hospitalar, com acesso venoso periférico, seguido de observação por um período de duas horas e retorno em 24 horas. Dependendo da gravidade das reações prévias, a reserva de leito de UTI pode ser necessária. Atualmente, recomenda-se administração de 0,06-0,6 g proteína alergênica/kg de peso corporal, em três doses iguais ao longo de 30 minutos. Recomenda-se não exceder um total de 3 g de proteína1,2.
Critérios para interpretação dos resultados foram padronizados. Estes são detalhados na Tabela 5. Na presença de um critério maior e dois critérios menores, o teste de provocação oral é diagnóstico de FPIES1,2.
Exames complementares
Pela ausência de achados característicos, exames de imagem não são indicados na FPIES6,17. Nos exames endoscópicos, quando realizados, pode-se observar mucosa friável, ulceração retal e sangramento da mucosa. O material obtido nas biópsias mostra atrofia das vilosidades, edema tecidual, abscessos nas criptas e aumento de células inflamatórias1,6,17,20.
Diagnósticos diferenciais
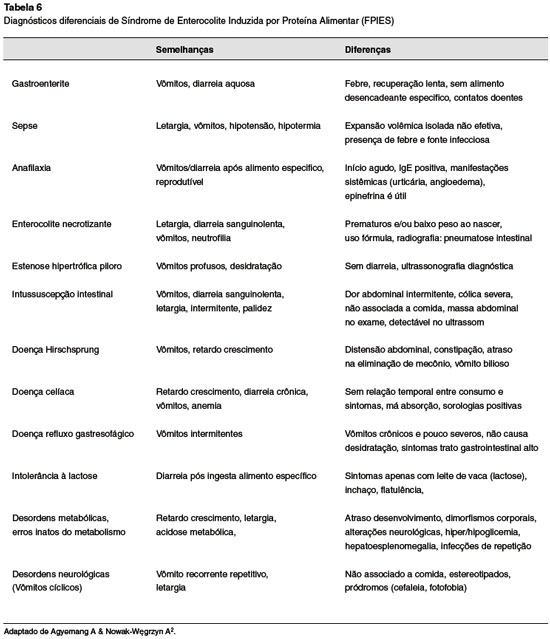
A presença de sintomas comuns a diversas doenças torna o diagnóstico da FPIES um desafio, e o erro diagnóstico e a falta de suspeita, frequentes9,21. Repetidos erros geram pior prognóstico aos pacientes, e estresse, ansiedade e frustração aos familiares22. Diferentes diagnósticos são baseados na idade, forma de apresentação e gravidade dos sintomas (Tabela 6)1,2.
Quadros agudos podem ser atribuídos a sepse e gastroenterite3,6,18. Outros diagnósticos diferenciais são anafilaxia, enterocolite necrotizante, estenose hipertrófica de piloro, intussuscepção intestinal, intolerância à lactose, doença de Hirschsprung e volvo intestinal2,14,18,20.
Quadros crônicos assemelham-se a condições metabólicas ou neurológicas, erros inatos do metabolismo, imunodeficiências primárias, doença celíaca, doença do refluxo gastroesofágico e outros tipos de alergia alimentar não mediadas por IgE6,14,17,18,20.
São sinais de alerta para o diagnóstico de FPIES: rápida recuperação após expansão volêmica, início na transição dietética (por exemplo, introdução alimentar), ausência de febre e provas de atividade inflamatória negativas3,9,15,18.
No entanto, alguns pacientes conhecidos como "FPIES sepse-like" podem ter aumento de proteína C-reativa (PCR > 2-3 mg/dL) e febre associados a sintomas gastrointestinais característicos. Os resultados foram reproduzidos através do teste de provocação oral23-25.
Eventualmente, quando as frutas são os alimentos desencadeantes, o diagnóstico diferencial deve ser feito com a Intolerância Hereditária à Frutose (IHF). Causada pela deficiência de aldolase B, esta condição compartilha muitas características, como sintomas e idade de início. O diagnóstico da IHF é confirmado através de teste de provocação oral com achados pós-teste específicos18,26.
Tratamento
O tratamento da FPIES aguda baseia-se em três pontos principais: expansão volêmica agressiva para restaurar a estabilidade hemodinâmica, redução da inflamação intestinal e controle da êmese1,13,17.
A expansão volêmica agressiva deve ser realizada com soro fisiológico em bolus, na dose de 10-20 mL/kg, via endovenosa (EV). Doses subsequentes de solução salina poderão ser administradas se houver manutenção da instabilidade hemodinâmica. A reidratação oral, em ambiente domiciliar, parece apropriada em reações leves quando a oferta por via oral é bem tolerada27.
Apesar de não haver consenso, o corticosteroide endovenoso em dose única é recomendado em reações graves6,9. A metilprednisolona é o corticosteroide de escolha, devendo ser administrada na dose 1 mg/kg, máximo 60-80 mg, via endovenosa. A conduta sustenta-se na hipótese fisiopatológica atual, em que o processo inflamatório intestinal seria mediado por células inflamatórias2,6.
A ondansetrona, antagonista do receptor de serotonina 5-HT3, é recomendada na dose de 0,15 mg/kg de peso, via intramuscular ou endovenosa5,6,13. Dados atuais demonstram menor duração dos episódios de vômitos nos quadros agudos, quando administrada2,8,29,30. Com base em seu mecanismo de ação, a eficácia da medicação parece traduzir a participação da via neuroendócrina na fisiopatologia da doença5,6,13.
Seguimento
O tratamento de manutenção consiste na exclusão do alérgeno da dieta17. Associada a isto, deve ser realizada orientação nutricional, educação do paciente e familiares, bem como desenvolver um plano de ação em caso de exposição acidental27,31.
O impacto de uma dieta restritiva no estado nutricional depende de múltiplos fatores, a citar, a frequência do consumo, poder aquisitivo, habilidades culinárias, disponibilidade de alternativas nos mercados, questões religiosas, número de alimentos a serem excluídos e os nutrientes que os mesmos contêm4.
Para exemplificar a magnitude de uma correta substituição alimentar, descrevem-se alguns dos nutrientes inerentes aos principais alérgenos associados à FPIES. Leite de vaca: proteína, carboidrato, vitaminas A/D/B12, riboflavina, cálcio e magnésio. Soja: proteína, tiamina, riboflavina, piridoxina, zinco e fósforo. Arroz: carboidrato, potássio, niacina, tiamina, riboflavina e ácido pantotênico4,21.
Crianças com doenças gastrointestinais apresentam, mais frequentemente, seletividade e recusa alimentar, medo da introdução de novos alimentos e ansiedade associada à alimentação, configurando a chamada neofobia alimentar. Este padrão de comportamento pode comprometer o crescimento e reduzir a ingestão diária, os quais permanecem após a resolução da alergia alimentar em alguns casos32.
De igual importância, o prejuízo na qualidade de vida e funcionamento familiar dos pacientes em dieta de eliminação para alergias não mediadas por IgE foi descrito33. A melhora do crescimento, da dinâmica familiar, a prevenção de carências nutricionais e o sucesso da reintrodução alimentar estão relacionados à existência de abordagem multidisciplinar e integrativa1,2,4,13.
Fórmula infantil
Raros casos de FPIES com aleitamento materno foram descritos. Destes, quase a totalidade dos casos apresentavam forma crônica na doença. Não há consenso quanto à realização de dieta materna de exclusão, principalmente nos quadros agudos, visto que somente a implementação de fórmulas não alergênicas foi resolutiva em alguns casos4,35.
As recomendações sobre a fórmula infantil adequada para lactentes com FPIES que não podem ou não toleram ser amamentados são diversas4,31. Dentre as fórmulas hipoalergênicas, a Fórmula Extensamente Hidrolisada (FEH) parece ser bem tolerada por maior parte dos pacientes. As fórmulas de aminoácidos, sabidamente não alergênicas, estão reservadas para pacientes não respondedores à FEH ou com comprometimento importante do desenvolvimento pôndero-estatural1,4,28,31.
Tolerância
A avaliação da tolerância aos alérgenos alimentares é de suma importância, prevenindo restrições alimentares não mais necessárias4,20. Dentre as recomendações atuais, a aquisição de tolerância deve ser avaliada entre 12-24 meses após remoção do desencadeante da dieta1,2,4,20.
Prognóstico
Apesar das reações serem potencialmente graves, a FPIES apresenta bom prognóstico. Nenhum óbito foi relatado na literatura6,17,28,36. Quase a totalidade dos casos de FPIES tem resolução entre 3-5 anos de idade1,2,6,12,28. Contudo, aqueles pacientes intitulados "FPIES atípicos" parecem ter curso mais longo, adquirindo tolerância tardiamente37.
A recuperação desses pacientes, sem quaisquer sequelas, é possível por orientação dietética adequada, incluindo otimização dos nutrientes, uso de fórmulas apropriadas e suplementação vitamínica quando necessária38.
Porém, dados da literatura revelam pouca familiaridade dos médicos com FPIES, haja vista a expressiva variação do conhecimento quanto aos métodos diagnósticos, gerenciamento do quadro agudo e posterior orientação nutricional adequada39. De modo a garantir a manutenção do bom prognóstico dos pacientes, a divulgação da Síndrome de Enterocolite Induzida por Proteína Alimentar é essencial22,39.
Conclusão
A incorporação progressiva de novos conhecimentos na fisiopatologia da FPIES é útil para compreender a grande diversidade de apresentações clínicas e desfechos terapêuticos. A capacidade de qualquer alimento desencadear FPIES, alergia não IgE mediada, está estabelecida. Os desencadeantes mais frequentemente relatados são leite, soja e arroz.
Atualmente a necessidade de uma abordagem personalizada é reconhecida. Essa conduta vai ao encontro dos conhecimentos atuais sobre a existência de diferentes fenótipos. A expansão volêmica precoce para atingir estabilidade hemodinâmica parece conduta consolidada, e observam-se crescentes evidências dos benefícios da ondansetrona para controle dos vômitos. Os primeiros sintomas iniciam ainda no primeiro ano de vida, apresentando-se na forma aguda ou crônica da doença. Porém, o maior desafio é ainda o diagnóstico desses pacientes.
Devido a FPIES ser pouco conhecida, as orientações e condutas atuais parecem empíricas. Tal constatação gera insegurança e ansiedade aos profissionais da saúde, nesse contexto em especial aos pediatras, bem como aos pacientes e familiares.
O presente estudo constituiu uma tentativa de compreendermos os dados disponíveis sobre FPIES. Por compartilhar características com diversas doenças de mecanismos distintos, discute-se a possibilidade da Síndrome de Enterocolite Induzida por Proteína Alimentar ser a "mãe de todas as alergias alimentares". Dessa forma e sob tal complexidade, fica clara a importância do tema ainda pouco discutido.
Referências
1. Nowak-Węgrzyn A, Chehade M, Groetch M, Spergel J, Wood R, Allen K, et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary - Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2017;139(4):1111-26.
2. Agyemang A, Nowak-Węgrzyn A. Food Protein-Induced Enterocolitis Syndrome: a Comprehensive Review. Clin Rev Allergy Immunol. 2019; Feb 8. doi: 10.1007/s12016-018-8722-z. [Epub ahead of print].
3. Mehr S, Campbell D. Food protein-induced enterocolitis syndrome: guidelines summary and practice recommendations. Med J of Aust. 2019;210(2):94-9.
4. Venter C, Groetch M. Nutritional management of food proteininduced enterocolitis syndrome. Curr Opin Allergy Clin Immunol. 2014;14(3):255-62.
5. Feuille E, Nowak-Węgrzyn A. Definition, etiology, and diagnosis of food protein-induced enterocolitis syndrome. Curr Opin Allergy Clin Immunol. 2014;14(3):222-8.
6. Nowak-Węgrzyn A, Jarocka-Cyrta E, Moschione Castro A. Food Protein-Induced Enterocolitis Syndrome. J Invest Allergol Clin Immunol. 2017;27(1):1-18.
7. KimuraM, ShimomuraM, Morishita H, Meguro T, SetoS. Eosinophilia in infants with food protein-induced enterocolitis syndrome in Japan. Allergol Intern. 2017;66(2):310-6.
8. Berin M. Immunopathophysiology of food protein-induced enterocolitis syndrome. J Allergy Clin Immunol. 2015;135(5):1108-13.
9. Guibas G, Tsabouri S, Makris M, Priftis K. Food protein-induced enterocolitis syndrome: Pitfalls in the diagnosis. Pediatr Allergy Immunol. 2014;25(7):622-9.
10. Mehr S, Frith K, Campbell D. Epidemiology of food proteininduced enterocolitis syndrome. Cur Opin Allergy Clin Immunol. 2014;14(3):208-16.
11. Mehr S, Frith K, Barnes E, Campbell D, Allen K, Barnes E, et al. Food protein-induced enterocolitis syndrome in Australia: A population-based study, 2012-2014. J Allergy Clin Immunol. 2017;140(5):1323-30.
12. Katz Y, Goldberg M. Natural history of food protein-induced enterocolitis syndrome. Curr Opin Allergy Clin Immunol. 2014;14(3):229-39.
13. Sarinho E, Lins M. Severe forms of food allergy. J Pediatr (Rio J). 2017;93:53-9.
14. Nowak-Węgrzyn A. Food protein-induced enterocolitis syndrome and allergic proctocolitis. Allergy Asthma Proc. 2015;36(3):172-84.
15. Turnbull J, Adams H, Gorard D. Review article: the diagnosis and management of food allergy and food intolerances. Aliment Pharmacol Ther. 2015;41(1):3-25.
16. Mane S, Bahna S. Clinical manifestations of food proteininduced enterocolitis syndrome. Curr Opin Allergy Clin Immunol. 2014;14(3):217-21.
17. Weinberger T, Feuille E, Thompson C, Nowak-Węgrzyn A. Chronic food protein-induced enterocolitis syndrome. Ann Allergy Asthma Immunol. 2016;117(3):227-33.
18. Fiocchi A, Claps A, Dahdah L, Brindisi G, Dionisi-Vici C, Martelli A. Differential diagnosis of food protein-induced enterocolitis syndrome. Curr Opin Allergy Clin Immunol. 2014;14(3):246-54.
19. Yang M, Geng L, Xu Z, Chen P, Friesen C, Gong S, et al. Severe Food Protein-Induced Enterocolitis Syndrome to Cow's Milk in Infants. Nutrients. 2015;8(1):1.
20. Bingemann T, Sood P, Järvinen K. Food Protein-Induced Enterocolitis Syndrome. Immunol Allergy Clin North America. 2018;38(1):141-52.
21. Cherian S, Varshney P. Food Protein-Induced Enterocolitis Syndrome (FPIES): Review of Recent Guidelines. Curr Allergy Asthma Rep. 2018;18(4):28.
22. Schultz F, Westcott-Chavez A. Food protein-induced enterocolitis syndrome from the parent perspective. Curr Opin Allergy Clin Immunol. 2014;14(3):263-7.
23. Kimura M, Ito Y, Shimomura M, Morishita H, Meguro T, Adachi Y, et al. Cytokine profile after oral food challenge in infants with food protein-induced enterocolitis syndrome. Allergol Intern. 2017;66(3):452-7.
24. Kimura M, Shimomura M, Morishita H, Meguro T, Seto S. Serum C-reactive protein in food protein-induced enterocolitis syndrome versus food protein-induced proctocolitis in Japan. Pediatr Intern. 2016;58(9):836-41.
25. Kimura M, Ito Y, Tokunaga F, Meguro T, Shimomura M, Morishita H, et al. Increased C-reactive protein and fever in Japanese infants with food protein-induced enterocolitis syndrome. Pediatr Intern. 2016;58(9):826-30.
26. Fiocchi A, Dionisi-Vici C, Cotugno G, Koch P, Dahdah L. Fruit-Induced FPIES Masquerading as Hereditary Fructose Intolerance. Pediatrics. 2014;134(2):e602-e605.
27. Feuille E, Nowak-Węgrzyn A. Food Protein-Induced Enterocolitis Syndrome, Allergic Proctocolitis, and Enteropathy. Curr Allergy Asthma Rep. 2015;15(8):50.
28. Connors L, O'Keefe A, Rosenfield L, Kim H. Non-IgE-mediated food hypersensitivity. Allergy Asthma Clin Immunol. 2018;14(S2). doi:10.1186/s13223-018-0285-2.
29. Miceli Sopo S, Battista A, Greco M, Monaco S. Ondansetron for Food Protein-Induced Enterocolitis Syndrome. Int Arch Allergy Immunol. 2014;164(2):137-9.
30. Miceli Sopo S, Bersani G, Monaco S, Cerchiara G, Lee E, Campbell D, et al. Ondansetron in acute food protein-induced enterocolitis syndrome, a retrospective case-control study. Allergy. 2016;72(4):545-51.
31. Michelet M, Schluckebier D, Petit L, Caubet J. Food protein-induced enterocolitis syndrome;a review of the literature with focus on clinical management. J Asthma Allergy. 2017;10:197-207.
32. Sdravou K, Emmanouilidou-Fotoulaki E, Mitakidou M, Printza A, Evangeliou A, Fotoulaki M. Children with diseases of the upper gastrointestinal tract are more likely to develop feeding problems. Ann Gastroenterol. 2019;May-Jun;32(3):217-33. doi: 10.20524/ aog.2019.0348. Epub 2019 Jan 15.
33. Meyer R, Godwin H, Dziubak R, Panepinto J, Foong R, Bryon M, et al. The impact on quality of life on families of children on an elimination diet for Non-immunoglobulin E mediated gastrointestinal food allergies. World Allergy Organ J. 2017;10(1):8.
34. Miceli Sopo S, Monaco S, Greco M, Scala G. Chronic food protein-induced enterocolitis syndrome caused by cow's milk proteins passed through breast milk. Int Arch Allergy Immunol. 2014;164(3):207-9.
35. Ntoumpara M, Sotiriadou F, Fotoulaki M. Acute-on-chronic food protein-induced enterocolitis syndrome in an exclusively breast-fed infant. Clin Case Rep. 2018;7(1):71-3.
36. Kimura M, Shimomura M, Morishita H, Meguro T. Prognosis of infantile food protein-induced enterocolitis syndrome in Japan. Pediatr Intern. 2017;59(8):855-60.
37. Caubet J, Ford L, Sickles L, Järvinen K, Sicherer S, Sampson H, et al. Clinical features and resolution of food protein-induced enterocolitis syndrome:10-year experience. J Allergy Clin Immunol. 2014;134(2):382-9.
38. Meyer R, De Koker C, Dziubak R, Godwin H, Dominguez-Ortega G, Chebar Lozinsky A, et al. The impact of the elimination diet on growth and nutrient intake in children with food protein induced gastrointestinal allergies. Clin Trans Allergy. 2016;6(1):25.
39. Greenhawt M, Bird J, Nowak-Węgrzyn A. Trends in provider management of patients with Food Protein-Induced Enterocolitis Syndrome. J Allergy Clin Immunol In Pract. 2017;5(5):1319-24.