Número Atual: Julho-Setembro 2019 - Volume 3 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Dirceu Solé
- Flávio Sano
- Nelson A. Rosário
- Martti A. Antila
- Carolina S. Aranda
- Herberto J. Chong-Neto
- Renata R. Cocco
- Antonio Condino-Neto
- Regis A. Costa
- Luis F. Ensina
- Pedro Giavina-Bianchi
- Ekaterini S. Goudouris
- Marcia C. Mallozi
- José L. B. Morandi
- Sandro F. Perazzio
- Ana Carolina R. Reali
- José Luis M. Rios
- Cristine S. Rosário
- Gesmar R. S. Segundo
- Faradiba S. Serpa
- Gustavo F. Wandalsen
- Norma P. M. Rubini
- Solange O. R. Valle
ARTIGO ESPECIAL
Guia prático de atualização: medicamentos biológicos no tratamento da asma, doenças alérgicas e imunodeficiências
Practical update guide: biological drugs in the treatment of asthma, allergic diseases and immunodeficiencies
Dirceu Solé1; Flávio Sano2; Nelson A. Rosário3; Martti A. Antila4; Carolina S. Aranda1; Herberto J. Chong-Neto3; Renata R. Cocco5; Antonio Condino-Neto6; Regis A. Costa7; Luis F. Ensina1; Pedro Giavina-Bianchi8; Ekaterini S. Goudouris9; Marcia C. Mallozi1,10; José L. B. Morandi11; Sandro F. Perazzio1; Ana Carolina R. Reali1; José Luis M. Rios12; Cristine S. Rosário3; Gesmar R. S. Segundo13; Faradiba S. Serpa14; Gustavo F. Wandalsen1; Norma P. M. Rubini15; Solange O. R. Valle16
DOI: 10.5935/2526-5393.20190035
1. Universidade Federal de São Paulo, Escola Paulista de Medicina, São Paulo, SP
2. Hospital Nipo-Brasileiro, São Paulo, SP
3. Universidade Federal do Paraná, Curitiba, PR
4. Pós-graduação em Alergia, Universidade de Helsinque, Helsinque, Finlândia
5. Faculdade Israelita Albert Einstein, São Paulo, SP
6. Instituto de Ciências Biomédicas - Universidade de São
Paulo, São Paulo, SP
7. Universidade Federal da Bahia, Salvador, BA
8. Universidade de São Paulo, São Paulo, SP
9. Instituto Martagão Gesteira, Universidade Federal do Rio de Janeiro, Rio de Janeiro, RJ
10. Fundação Faculdade de Medicina do ABC, Santo André, SP
11. Universidade Federal Fluminense, Niterói, RJ
12. Faculdade de Medicina de Petrópolis, Petrópolis, RJ
13. Universidade Federal de Uberlândia, Uberlândia, MG
14. Universidade Federal do Espírito Santo, Vitória, ES
15. Escola de Medicina e Cirurgia da Universidade Federal do Estado do Rio de Janeiro, Rio de Janeiro, RJ
16. Hospital Universitário Clementino Fraga Filho, Universidade Federal do Rio de Janeiro, Rio de Janeiro, RJ
Endereço para correspondência:
Dirceu Solé
E-mail: dirceu.sole@unifesp.br
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
O presente guia apresenta revisão extensa sobre imunobiológicos utilizados, liberados e ainda sob estudo, para o tratamento da asma, doenças alérgicas e imunodeficiências. Além das características físico-químicas de alguns desses fármacos, são revisadas as indicações e os resultados de estudos clínicos realizados para avaliar eficácia e segurança. Separados por doença específica, são apresentados os principais agentes disponíveis e aprovados para utilização segundo as normas regulatórias nacionais.
Descritores: Imunobiológico, terapia imunobiológica, anticitocinas, anticorpo monoclonal, proteínas de fusão.
I - Biotecnologia e medicamentos
Introdução
A terapia biológica consiste no uso de organismos vivos, substâncias derivadas desses organismos ou versões sintéticas de tais substâncias produzidas em laboratório para tratar diferentes doenças. Alguns biofármacos estimulam ou suprimem o sistema imunitário na tentativa de combater neoplasias, doenças autoimunes ou infecções. Por outro lado, outras terapias biológicas atacam células específicas (p. ex.: as neoplásicas), impedindo-as de se proliferarem ou facilitando a sua destruição. A terapia biológica é também denominada de bioterapia ou terapia modificadora da resposta biológica e engloba a imunoterapia (anticorpos monoclonais, proteínas de fusão, citocinas, vacinas, hemoderivados, extratos de antígenos para dessensibilização), terapia gênica e algumas terapias-alvo.
Histórico
A origem histórica da terapia biológica talvez possa ser atribuída à China, África e Turquia durante a Antiguidade, possivelmente por volta de 1000 aC, quando a inoculação de fluidos biológicos de pacientes portadores de varíola foi usada para imunizar indivíduos saudáveis contra tal doença. Esse método rudimentar de prevenção da varíola presumivelmente ocorreu após a observação de que indivíduos que sobreviveram à varíola se tornaram aparentemente resistentes a infecções subsequentes e foi provavelmente introduzido na Europa por viajantes oriundos de Istambul no século XVIII1. Edward Jenner aplicou métodos científicos para a investigação de maneiras de prevenção contra a varíola e é considerado por alguns autores como o "pai da Imunologia"2. O trabalho de Jenner foi refinado posteriormente por outros autores, incluindo o próprio Louis Pasteur, que em 1885 desenvolveu as primeiras vacinas antirrábicas usando vírus atenuados artificialmente3.
Após o domínio da tecnologia de cultura celular e produção de vacinas, as atenções se viraram para a descoberta de medicamentos cada vez mais específicos para o tratamento de doenças. A partir da descrição do funcionamento do ácido desoxirribonucleico (DNA) em 1953, pelos cientistas James Watson e Francis Crick, diferentes vertentes científicas foram consolidadas. Um grande avanço no desenvolvimento da biotecnologia aconteceu a partir de 1972, com a aplicação da revolucionária técnica do DNA recombinante excutada por Paul Berg. A aplicabilidade clínica da transferência de material genético de uma espécie para outra é notável, e a biotecnologia clássica passou a ser chamada de moderna. Em 1975, Milstein e Köhler publicaram um método revolucionário para a produção de anticorpos monoclonais em larga escala usando hibridomas, linhagens de células secretoras de anticorpos formadas pela fusão de linfócitos normais selecionados com células derivadas de mieloma4. A descoberta abriu caminho para a manutenção em laboratório de clones estáveis produtores de anticorpos específicos que podem ser usados para terapias-alvo direcionadas, reduzindo o risco de efeitos colaterais e reações cruzadas.
O uso comercial de anticorpos monoclonais começou no início dos anos 1980, e, em 1986, o primeiro monoclonal terapêutico direcionado contra um alvo do sistema imunitário, o OKT3 (anti-CD3), foi aprovado para a prevenção de rejeição ao transplante renal. As drogas imunobiológicas foram um divisor de águas para o tratamento de doenças autoimunes, como por exemplo, a artrite reumatoide, cuja primeira terapia foi aprovada em 1998, constituída por uma proteína capaz de bloquear o fator de necrose tumoral a (TNF-α) solúvel: o etanercepte. Nesse ínterim, outros métodos foram sendo gradativamente desenvolvidos e aperfeiçoados. Atualmente, cerca de 200 medicamentos biológicos estão sendo comercializados, correspondendo a cerca de 30% do total de novas drogas sob desenvolvimento5.
Anticorpos monoclonais e proteínas de fusão
As imunoglobulinas são moléculas constituídas de quatro cadeias polipeptídicas ligadas por pontes de dissulfeto: duas cadeias pesadas idênticas, que determinam a classe da imunoglobulina, e duas cadeias leves também idênticas. Cada cadeia, por sua vez, é formada por uma região constante e outra variável. Enquanto a região constante da imunoglobulina (Fc) é a mesma em todos os isotipos de anticorpos e, dentre outras funções, aumenta a estabilidade e meia-vida da proteína, a variável (Fab) é exclusivamente produzida pelo clone de célula B que sofreu o rearranjo genético específico e, logo, é responsável pelo reconhecimento do antígeno (Figura 1)6.
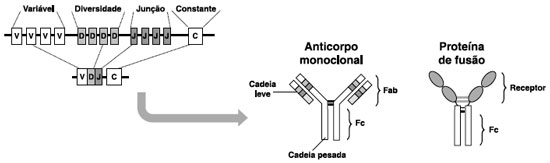
Figura 1 Mecanismo básico do rearranjo gênico presente nas células B para produção de imunoglobulinas. Os genes V ("variável"), D ("diversidade") e J ("junção") estão presentes em grande número no genoma humano e são combinados um a um aleatoriamente, a fim de formar a região variável unida, por sua vez, à região constante das cadeias leve e pesada para formar a molécula de imunoglobulina. A proteína de fusão consiste na ligação da fração Fc, geralmente oriunda de IgG1, e algum receptor solúvel ou proteína recombinante
O rearranjo genético para a construção de imunoglobulinas específicas possui controles rígidos e um padrão similar ao observado para a criação dos receptores de células T, consistindo na combinação aleatória na região variável de genes V ("variável"), D ("diversidade") e J ("junção"), tanto na cadeia pesada quanto na leve (Figura 1). Isso gera um vasto repertório potencial de imunoglobulinas a serem produzidas, calculado na ordem de 1014 a 1018 combinações diferentes7. Cada uma dessas combinações potencialmente reconheceria um antígeno específico.
Durante uma resposta imunológica fisiológica, a maior parte dos anticorpos produzidos é policlonal, o que significa que são secretados por grande número de linfócitos B distintos e, portanto, reconhecem vários epítopos distintos de antígeno-alvo ou o mesmo epítopo com afinidade diferente. Entretanto, é possível produzir grandes quantidades de um dado anticorpo a partir de um clone de células B purificado com técnicas laboratoriais recentes de seleção celular. Esse anticorpo, por conseguinte, é denominado de monoclonal, e, apesar do custo mais elevado, tem a vantagem de ser específico e possuir alta afinidade.
As proteínas de fusão aproveitam algumas propriedades da região Fc das imunoglobulinas, em especial a meia-vida aumentada, acoplada a algum receptor ou depurador do alvo em questão. Por essa razão, as proteínas de fusão não possuem uma região determinante de complementaridade de ligação ao antígeno da mesma maneira que a fração Fab dos anticorpos monoclonais, porém geralmente possuem uma função biológica específica em relação à molécula-alvo que está sendo manipulada (Figura 1).
Nomenclatura para os anticorpos monoclonais
A uniformização dos anticorpos monoclonais e das proteínas de fusão tem sido adotada desde 1995, a fim de facilitar o reconhecimento mundial com um nome único para cada produto. A nomenclatura especifica certas características da proteína, tais como o alvo proposto, o hospedeiro produtor inicial, as modificações e a conjugação com outras moléculas. As regras sugeridas pelo grupo de especialistas em Nomenclatura Internacional Não Proprietária da Organização Mundial de Saúde determinam a presença de um prefixo, um infixo e um sufixo, a saber (Figura 2):
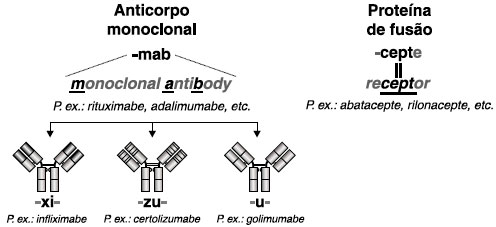
Figura 2 Nomenclatura indicada pela Organização Mundial de Saúde para os imunobiológicos monoclonais ou proteínas de fusão
- o prefixo é aleatório e tem a intenção de prover um nome único à medicação;
- o infixo tem a função de designar o alvo (por exemplo, "ci" para cardiovascular, "so" para osso, "tu" para tumor, "l" para imunomodulador, "k" para citocina, dentre outros), o hospedeiro-fonte no qual o anticorpo foi originalmente produzido ("u" para humano, "o" para camundongo) e modificações ("xi" para quimérico, "zu" para humanizado);
- o sufixo para todos os anticorpos monoclonais é "mabe" e para proteínas de fusão com receptores solúveis é "cepte", com raras exceções em relação aos medicamentos produzidos no início dos anos 1990.
Entretanto, o último infixo referente às modificações foi eliminado em 20178 para as medicações criadas a partir dessa data. O racional para tal mudança se baseia no uso da espécie do hospedeirofonte da proteína como ferramenta de propaganda, apesar da relativa ausência de evidências científicas para tanto.
II - Potenciais alvos de ação dos imunobiológicos
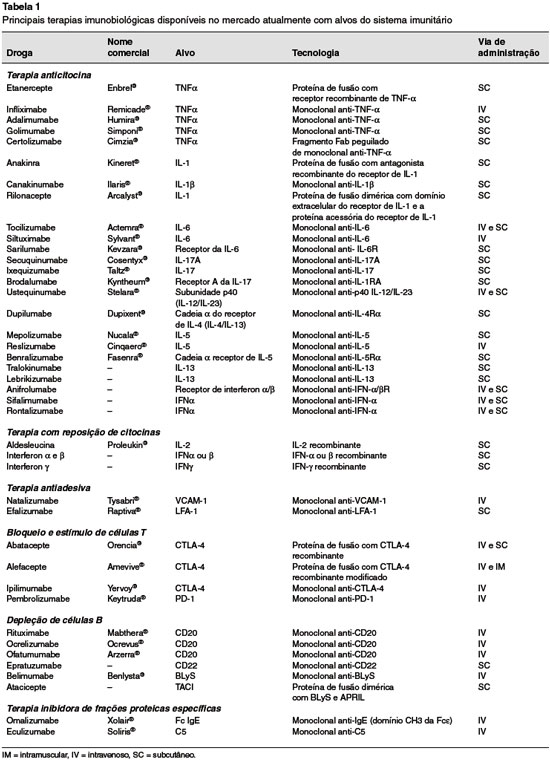
O conceito de alvos do sistema imunitário é relativamente amplo, tendo em vista a enorme capilaridade entre os grupamentos celulares e a heterogeneidade da resposta imunitária humana. Em outras palavras, células que não foram originadas nos órgãos primários ou secundários do sistema imunitário, tais como fibroblastos, osteoblastos e endoteliócitos, por exemplo, também podem exercer papel na resposta inflamatória, expressando receptores de superfície e produzindo citocinas. Por essa razão, não há intenção de se esgotar o tema nesse capítulo, mas sim listar os principais medicamentos disponíveis no mercado atual com alvos diretamente ligados ao sistema imunitário, didaticamente dividindo-os em grupos de acordo com a forma de ação. A Tabela 1 resume as principais informações clínicas desses imunobiológicos.
Terapia anticitocinas
Essa é a terapia imunobiológica que tem recebido maior atenção, devido ao pleiotropismo característico das citocinas e ao grande número de alvos em potencial. Os primeiros a serem desenvolvidos foram os anti-TNF-α na seguinte ordem de lançamento: etanercepte, infliximabe, adalimumabe, certolizumabe e golimumabe. Esses agentes exibem vários estudos publicados e são indicados para o tratamento de artrite reumatoide, espondilite anquilosante, artrite idiopática juvenil, doença inflamatória intestinal, psoríase e artrite psoriática. Alguns dados também sugerem benefícios no tratamento de doenças autoinflamatórias (por exemplo, febre familiar do Mediterrâneo, síndrome periódica associada ao receptor de TNF e criopirinopatias), doença de Behçet, arterite de Takayasu e uveítes autoimunes. Uma vez que o TNF-α é importante na ativação e interação entre macrófagos e linfócitos T adjuvantes 1 (Th1), em especial na resposta contra microrganismos intracelulares, o principal efeito colateral dos seus inibidores é o aumento no risco de tuberculose. Por essa razão, o rastreamento, a profilaxia primária ou secundária e tratamento de virtuais casos de tuberculose são fundamentais antes da infusão dos anti-TNF. Ademais, essa citocina é fundamental na homeostasia cardiovascular e no remodelamento cardíaco em pacientes com comprometimento funcional. O bloqueio do TNF deve ser evitado em indivíduos com fração de ejeção abaixo de 50%, sob risco de piora da função cardíaca. Finalmente, os anti-TNF devem ser também evitados nos casos com doenças desmielinizantes associadas e podem induzir a formação de autoanticorpos específicos (antinucleares e anti-DNA dupla hélice), culminando com o desenvolvimento de um quadro de lúpus eritematoso sistêmico induzido por droga.
Outra citocina importante para a resposta imunitária inata é a IL-1. Existem três bloqueadores dessa citocina: anakinra, canaquinumabe e rilonacepte. Enquanto os dois últimos são respectivamente um anticorpo monoclonal anti-IL-1β e uma proteína de fusão Fc-IgG com dois receptores extracelulares de IL-1, o anakinra é uma proteína de fusão ligada ao antagonista do receptor de IL-1 recombinante. Apesar de terem sido primariamente desenvolvidos para o tratamento de artrite reumatoide, devido à resposta clínica modesta nessa doença foram delegados à segunda opção. Entretanto, após a descoberta do importante papel da IL-1 na fisiopatologia das doenças autoinflamatórias e hiperativação do inflamassomo, tais medicações ganharam destaque no tratamento e prevenção de recaídas dessas síndromes. Atualmente, são aprovadas para o tratamento da forma sistêmica da artrite idiopática juvenil, síndromes autoinflamatórias clássicas (criopirinopatias, deficiência da mevalonato-quinase, síndrome de Majeed, deficiência do antagonista do receptor de IL-1, dentre outras), crises agudas de gota e pseudogota. Os efeitos colaterais incluem citopenias periféricas e reativações de hepatites virais crônicas (vírus B e C).
A IL-6 é uma citocina também derivada da resposta de fase aguda e produzida por células do sistema imunitário inato. É capaz de ativar macrófagos, osteoclastos, células B e T, sendo ainda o principal mediador da resposta de fase aguda hepática, em especial levando à produção de hepcidina e induzindo resistência à ação da eritropoietina. Por essa razão, é fundamental na gênese da anemia de doença crônica. Desempenha seu papel ligando-se tanto aos receptores expressos na membrana dessas células como à forma solúvel, por meio da interação desse complexo com a gp130. Há basicamente três anti-IL-6 disponíveis no momento aprovados para o tratamento da artrite reumatoide, artrite idiopática juvenil e doença de Castleman: tocilizumabe, siltuximabe (anti-IL-6) e sarilumabe (anti-IL-6R). Mais recentemente foram relatados benefícios expressivos no bloqueio dessa via nos pacientes com mutações com ganho de função de STAT3 (ADMIO1, doença autoimune multissistêmica de início na infância)9. Os anti-IL-6 podem ainda servir como segunda opção para o tratamento de algumas doenças do espectro das síndromes autoinflamatórias. Como efeitos colaterais mais complicados citam-se a indução de dislipidemia (por vezes de difícil controle), relatos de casos de perfuração intestinal (diverticulite) e piora de hepatopatia crônica associada.
A IL-17 é a principal citocina produzida pelas células efetoras Th17, e aparentemente desempenha papel importante na erradicação de infecções por bactérias extracelulares, como Klebsiella pneumoniae, ou leveduras, como Candida albicans. Não obstante, variantes genéticas associadas a deficiências na secreção ou funcionamento da IL-17 aumentam a susceptibilidade a essas infecções e quadros clínicos compatíveis com candidíase mucocutânea de repetição. As células Th17 também parecem exercer funções centrais em doenças autoimunes, tais como esclerose múltipla, artrite reumatoide e psoríase. Existem três representantes dessa classe de drogas até o momento indicados para o tratamento de psoríase, artrite psoriática e espondilite anquilosante: secuquinumabe, ixequizumabe e brodalumabe. Enquanto os dois primeiros são direcionados para o bloqueio da citocina em si (IL-17A e IL-17, respectivamente), o último visa bloquear o receptor A expresso na membrana. Paradoxalmente, a administração de secuquinumabe pode induzir à piora clínica de alguns casos de doença inflamatória intestinal.
A IL-23 é um mediador importante também para a diferenciação e maturação das células Th17. Essa citocina é heterodimérica e compartilha a subunidade proteica p40 com a IL-12, que, por sua vez, é uma citocina secretada pelas células B, neutrófilos, células dendríticas e macrófagos. Sua principal função é estimular a diferenciação de linfócitos Th1, bem como aumentar a secreção e atividade do interferon (IFN) γ por estas e pelas células NK (natural killers), desencadeando respostas citotóxicas, um passo crítico na defesa contra vírus e neoplasias. O ustequinumabe é um monoclonal que reconhece e bloqueia a subunidade p40, portanto inibindo a ação de ambas as citocinas simultaneamente. É aprovado para o uso na psoríase e na artrite psoriática e já foi associado ao desenvolvimento de leucoencefalopatia posterior reversível. Há evidências científicas para o uso do ustequinumabe na indução de remissão da colite associada à doença granulomatosa crônica e na deficiência de adesão leucocitária tipo I (LAD I).
As células Th2, por sua vez, são direcionadas principalmente para a resposta efetora humoral, com a produção de anticorpos e reações imunitárias mediadas por eosinófilos e mastócitos contra alérgenos e helmintos. A IL-4 é a principal citocina ligada à diferenciação das células T em Th2. Após esse processo, as células diferenciadas passam a secretar a própria IL-4, além de IL-5 e IL-13. Os imunobiológicos bloqueadores dessa via visam basicamente o tratamento da asma refratária, dermatite atópica grave e síndromes hipereosinofílicas (por exemplo, a poliangeíte granulomatosa eosinofílica). Por outro lado, ao se bloquear as células Th2, aumenta-se o risco de infecções parasitárias associadas. São exemplos dessa subclasse de terapia biológica: dupilumabe (anticadeia α do receptor de IL-4, modulando a via da IL-4 e da IL-13); mepolizumabe e reslizumabe (anti-IL-5) e benralizumabe (antirreceptor α da IL-5); tralokinumabe e lebrikizumabe (anti-IL-13).
O IFN-α é um representante da família do interferon tipo I. Produzido principalmente por células dendríticas plasmocitoides, é prioritariamente envolvido na resposta imunitária inata antiviral. A descoberta de doenças em cuja fisiopatologia há aumento expressivo da expressão de genes ativados e redução significativa dos modulados pela ação do interferon tipo I (a chamada "assinatura do interferon") abriu caminho para o bloqueio da citocina na prática clínica. Essas doenças são denominadas, por esse motivo, de interferonopatias e representadas pela deficiência de DNASE1, deficiência de TREX, ganho de função de IFIH1, ganho de função de STING, dentre outras. As seguintes medicações são exemplos de bloqueadores de IFN-α disponíveis para uso: anifrolumabe (antirreceptor de IFN-α/β), sifalimumabe e rontalizumabe (anti-IFN-α). Posteriormente, a mesma assinatura genética induzida pelo interferon tipo I foi evidenciada em uma parcela considerável de pacientes com lúpus eritematoso sistêmico, levantando-se a hipótese da ação dos anti-IFN-α nessa doença. Apesar de resultados pouco animadores para o sifalimumabe, estudos preliminares com o anifrolumabe indicaram boa resposta clínica em potencial. Outra potencial utilidade dessa subclasse de anticorpos monoclonais seria o tratamento de pacientes portadores de mutações com ganho de função de STAT1, apesar de não haver evidências robustas, devido à raridade do quadro.
Terapia com reposição de citocinas
O IFN-γ é um potente ativador macrofágico e um dos pilares para a erradicação de patógenos intracelulares, como o Mycobacterium tuberculosis. O seu uso clínico é aprovado durante o acompanhamento de pacientes com doença granulomatosa crônica para evitar infecções graves e abscessos viscerais, embora o advento do transplante de células hematopoiéticas pluripotentes precoce para esses casos tenha reduzido drasticamente a sua utilização. Os efeitos colaterais de qualquer uma dessas isoformas de IFN incluem reações gripais influenza-símile, mielossupressão, hepatotoxicidade e necrose no local da aplicação, sendo o uso por vezes impeditivo.
A IL-2 é uma citocina fundamental para a sobrevivência e maturação de linfócitos em geral. É reconhecida por um receptor (CD25) expresso na superfície celular de linfócitos T ativados e em menor proporção nas células T inativas e B ativadas. Surpreendentemente, as células T reguladoras naturais (Treg) FoxP3+ expressam os receptores de alta afinidade para IL-2 em grande quantidade na superfície. Portanto, paradoxalmente, em concentrações mais baixas a IL-2 é capaz de estimular apenas a proliferação das células Treg em detrimento das células T efetoras. Com esse conceito, o uso de baixas doses imunomoduladoras de aldesleucina é promissora para o tratamento de algumas doenças autoimunes, tais como o lúpus eritematoso sistêmico e vasculites primárias. Atualmente, porém, a IL-2 é aprovada para a imunoterapia apenas de carcinoma renal ou melanoma metastáticos. Os efeitos colaterais incluem miocardiopatia, pneumopatia intersticial, citopenias e a indução de fenômenos autoimunes.
Terapia antiadesiva
O processo de diapedese leucocitária é precedido por estágios específicos de adesão celular, visando a sinalização do sítio inflamatório apropriado e redução da velocidade da célula na seguinte ordem: captura, rolamento e apreensão. Na primeira etapa, há o reconhecimento do local que necessita a presença de células do sistema imunitário, mediado por moléculas de selectinas expressas nas superfícies endotelial e leucocitária. A esse estágio segue o processo de rolamento, no qual há redução da velocidade celular também mediada por moléculas de superfície endotelial (integrinas), culminando com a fixação da célula por meio da interação com moléculas VCAM-1, LFA-1 e posterior diapedese. Respectivamente, essas moléculas podem ser bloqueadas por meio dos monoclonais natalizumabe, segunda linha para esclerose múltipla e efalizumabe (retirado do mercado).
Bloqueio e estímulo de células T
A ativação das células T necessita um sinal coestimulador, usualmente mediado pela ligação do CD28 em sua superfície com o CD80 ou CD86 da célula apresentadora. Um mecanismo modulador fundamental, entretanto, consiste na inibição competitiva realizada pela molécula de CTLA-4 também presente na superfície da célula T e capaz de se ligar ao CD80/CD86 sem induzir nenhum sinal ativador. Por essa razão, o CTLA-4 se tornou uma moléculachave e medicações que a usam como alvo podem ser tanto anti como pró-inflamatórias. O abatacepte e o alefacepte são proteínas de fusão que consistem na fração Fc de IgG ligada a uma molécula de CTLA-4, visando o fechamento do sítio de ligação do CD80/CD86 na célula apresentadora de antígenos e, por conseguinte, impedimento da ativação do linfócito T. Atualmente, esses medicamentos são aprovados para o tratamento de artrite reumatoide e artrite idiopática juvenil. Recentemente, o abatacepte tem sido usado como terapia-alvo nos pacientes com haploinsuficência de CTLA-4 e deficiência de LRBA, com resposta razoável, a fim de se tratar e evitar as manifestações autoimunes espectrais induzidas pela imunodesregulação10. O aumento do risco de descompensação de doença pulmonar obstrutiva crônica é o principal efeito colateral.
O ipilimumabe, por outro lado, é um anticorpo monoclonal que reconhece e bloqueia o CTLA-4 presente na superfície do linfócito T, reduzindo significativamente a sua capacidade de inibição por meio da competição com o CD28. O pembrolizumabe é um monoclonal que bloqueia o PD-1, desempenhando papel semelhante ao ipilimumabe e induzindo, portanto, à hiperativação de células T. Ao propiciar a ativação policlonal de células T, tais imunobiológicos induzem a um estado pró-inflamatório sistêmico e facilitam o reconhecimento e combate das células cancerosas. Por outro lado, no entanto, também estão associados ao aparecimento de diversas complicações autoimunes, tais como doença inflamatória intestinal, miastenia gravis, artrite reumatoide, hipotireoidismo, dentre outras11.
Depleção de células B
O principal objetivo da terapia depletora de células B é destruir as linhagens de células B malignas ou autoimunes, enquanto ainda tenta manter a imunidade humoral protetora, uma vez que não tem a capacidade de destruir plasmócitos12. Assim que o anticorpo monoclonal se liga ao alvo na superfície do linfócito B (p. ex.: CD20, CD22, BLyS ou TACI), três processos podem levar à morte celular: citotoxicidade mediada por célula dependente de anticorpo, principalmente mediada pelo sistema retículo-endotelial; citotoxicidade direta dependente do sistema complemento; e apoptose direta induzida pelo anti-CD20. Esses mecanismos levam à redução do desenvolvimento e maturação de células B, o que, consequentemente, reduz a produção final de anticorpos. Adicionalmente ao papel central na produção de imunoglobulinas, as células B também têm a capacidade de apresentar antígenos e ativar células T, bem como promover a produção de citocinas pró-inflamatórias, incluindo TNF-α, IL-1, IL-4, IL-6, IL-8, IL-10 e IL-12, dentre outras. Portanto, ao bloquear o desenvolvimento da resposta humoral, também inibe a resposta T dependente. Existem ao menos seis representantes dessa classe de medicamentos no presente momento: rituximabe, ocrelizumabe e ofatumumabe (anti-CD20); epratuzumabe (anti-CD22); belimumabe (anti-BLyS) e atacicepte (anti-TACI). Formas imaturas de células B ainda presentes na medula óssea e plasmócitos circulantes e teciduais não podem ser atingidos por essa terapia, tendo em vista que esses grupamentos celulares não expressam tais receptores. Portanto, a inibição inerente a essa classe ocorre nas diversas fases intermediárias de maturação. O belimumabe e o atacicepte são os representantes com ação mais direcionada, atuando exclusivamente entre a fase de maturação da célula B imatura em "naïve".
A terapia depletora de células B está indicada para o tratamento de neoplasias hematológicas (linfomas ou leucemias de linfócitos B), artrite reumatoide, lúpus eritematoso sistêmico, vasculites primárias ANCA-associadas e esclerose múltipla. Há evidências também do efeito benéfico do rituximabe em pacientes com micobacteriose recorrente13, pneumopatia intersticial granulomatosa e linfocítica associada à imunodeficiência comum variável14 e nas citopenias autoimunes induzidas por síndrome autoimune linfoproliferativa ou autoanticorpos15.
Embora infrequentes, os principais efeitos colaterais são a indução de hipogamaglobulinemia persistente (mais frequentemente presente em pacientes com lúpus ou vasculites primárias por motivos ainda desconhecidos) e leucoencefalopatia multifocal progressiva. Níveis séricos de imunoglobulinas (IgG, IgA e IgM) e, preferencialmente, contagem de células CD19 periféricas devem ser realizados antes da primeira infusão e acompanhados regularmente, para identificar casos de hipogamaglobulinemia secundária. No entanto, se possíveis anticorpos patogênicos já se encontrarem circulantes, poucas são as opções terapêuticas disponíveis. Apesar de não ser considerada uma imunoterapia, a plasmaférese é uma das principais terapias para esse fim. Outra opção interessante seria o uso de altas doses de imunoglobulina intravenosa (1-2 g/kg/mês). Atualmente, a terapia imunomoduladora com imunoglobulina é indicada para o tratamento de síndrome de Guillain-Barré, plaquetopenia autoimune, doença de Kawasaki e polirradiculopatia idiopática crônica. Outras indicações com pouca evidência na literatura incluem síndrome de Lambert-Eaton, anemia hemolítica autoimune e, em situações especiais, miopatias inflamatórias, lupus eritematoso sistêmico e vasculites sistêmicas. Reações infusionais podem ocorrer, recomendando-se o fracionamento da dose sempre que possível para até 5 dias nos pacientes recebendo dose máxima (2 g/kg).
Terapia inibidora de frações proteicas específicas
O omalizumabe reconhece a cadeia pesada (região constante Fce, domínio CH3) da IgE, mesmo local em que a imunoglobulina se liga ao Fcε RI presente nos mastócitos e basófilos (ver item específico).
O eculizumabe é um anticorpo monoclonal dirigido contra a fração C5 do sistema complemento, e o seu bloqueio impede a ativação final tanto da via clássica quanto da alternativa ou da via das lectinas. É indicado basicamente nas doenças com hiperativação do sistema complemento, principalmente a hemoglobinúria paroxística noturna (deficiência de CD59 ou CD55) e na síndrome hemolítico-urêmica atípica. As principais complicações incluem o aumento do risco de infecção por bactérias encapsuladas, especialmente Neisseria meningitidis, devido à possível indução de consumo e deficiência secundária de C3.
III - Medicamentos biológicos disponíveis
Apesar do grande avanço e aquisição de novos biológicos ocorridos nos últimos anos, no capítulo das doenças alérgicas e imunodeficiências ainda há muitos em estudo (Tabela 1). Apenas parte deles está disponível para uso clínico no Brasil e no mundo. A seguir apresentamos alguns desses agentes imunobiológicos disponíveis e aprovados no Brasil para uso no tratamento das doenças alérgicas, com ênfase na sua caracterização funcional.
Aprovados para uso no Brasil
Omalizumabe
O omalizumabe é um anticorpo monoclonal (IgG1) humanizado recombinante (5% de resíduos de aminoácidos não humanos) e se liga ao terceiro domínio da cadeia pesada (CH3) da IgE livre16-19. Por se ligar ao mesmo sítio que a IgE utiliza para fixar-se ao receptor de alta afinidade (FceRI), na superfície de mastócitos e basófilos, impede a liberação de mediadores inflamatórios dependentes desse mecanismo16. Foi o primeiro imunobiológico aprovado pelo Food and Drug Administration (FDA) para uso na asma alérgica (2003) e na urticária crônica espontânea (UCE, 2015). No Brasil, foi aprovado pela Agência Nacional de Vigilância Sanitária - ANVISA no ano de 2009 para uso na asma alérgica, e, em 2015, para uso na UCE.
Com o uso de omalizumabe, a IgE livre não se liga ao FceRI e ocorre redução dos processos decorrentes dessa ligação. As seguintes alterações são descritas e justificam a eficácia e a efetividade da terapia na asma alérgica e na UCE:
- redução da concentração média de IgE livre20,21;
- redução da síntese e liberação de mediadores da resposta alérgica (leucotrienos, citocinas e quimocinas)20-22;
- redução do número de receptores de alta afinidade para IgE - FcεRI na superfície de mastócitos, basófilos e células dendríticas, como resultado da diminuição da IgE livre circulante23-25;
- redução da síntese de IgE26;
- redução do número de eosinófilos periféricos27,28; e
- redução da resposta inflamatória imediata e tardia e no influxo de eosinófilos para as vias aéreas após provocação com alérgenos18,21,29.
Após a aplicação da primeira dose, o omalizumabe é absorvido lentamente e atinge concentrações séricas máximas em seis a oito dias20. Em uma hora, já é possível observar redução na concentração da IgE livre19. Redução dos níveis iniciais de IgE total livre em 96% foi observado no terceiro dia após a primeira aplicação de omalizumabe em pacientes com asma grave30, ou com UCE20.
Durante o tratamento com omalizumabe são formados complexos solúveis omalizumabe-IgE, que são degradados pelo sistema reticulo endotelial hepático e células endoteliais. A presença desses imunocomplexos circulantes faz com que o nível de IgE total sérica, que representa o nível de IgE livre e o de IgE ligada ao omalizumabe, aumente duas a seis vezes31-33. Por isso, o nível de IgE total sérica não é utilizado para monitorização de resposta clínica.
O omalizumabe tem taxa de clearance de 2,4±1,1 mL/kg/dia e sua meia-vida varia de uma a quatro semanas, com média de 26 dias20. Com a descontinuação do seu uso, os níveis de IgE total sérica caem lentamente, e, apenas um ano após interrupção do tratamento, os níveis de IgE retornam ao basal, prétratamento20.
Para o tratamento da asma, as doses de omalizumabe são estabelecidas com base no nível de IgE total sérica (UI/mL) ao início do tratamento e no peso corpóreo (kg). A dose preconizada é de 0,016 mg/kg por UI/mL de IgE total, e varia de 150 a 600 mg (1 a 4 frasco-ampola) a cada 2 a 4 semanas. Na UCE, a dose não depende do nível de IgE total sérica e do peso, sendo recomendados 300 mg (2 frascos/ampola) a cada 4 semanas20.
A administração é feita por via subcutânea (SC), e doses maiores que 150 mg (1 frasco/ampola) devem ser aplicadas em mais de um local. A solução é um pouco viscosa, e a injeção pode levar 5 a 10 segundos20.
O nível sérico de IgE total eleva-se durante o tratamento e assim se mantém por até um ano após a interrupção da terapia. Em pacientes com asma que interrompem o tratamento por período inferior a um ano e necessitam de reintrodução da terapia, a dose será baseada no nível inicial de IgE total sérica. A dose será recalculada com base em nova dosagem sérica de IgE total caso a terapia seja suspensa por período maior que 12 meses. Outra situação na qual a dose deverá ser recalculada é quando houver aumento ou redução de 10% ou mais do peso corpóreo. Nesses casos, será considerado o nível de IgE total sérica prévia ao início do tratamento20.
Recomenda-se a realização de avaliação da resposta terapêutica ao omalizumabe em três a seis meses após o início do tratamento. Poucos estudos acompanharam pacientes após a descontinuação do tratamento, e mostraram manutenção do controle da asma e ausência de efeito rebote34.
O omalizumabe é bem tolerado, mas deve ser administrado em ambiente adequado e com material para atendimento de reações. Anafilaxia foi relatada por 0,1 a 0,2% dos pacientes, e em geral ocorre nas primeiras três doses do omalizumabe35,36.
Benralizumabe
Benralizumabe é anticorpo monoclonal (IgG1, kappa) humanizado e afucosilado anti-IL-5. A ausência de fucose faz com que o benralizumabe se ligue à subunidade alfa do receptor da IL-5 humana (IL-5Rα) com elevada afinidade e especificidade37,38. O receptor IL-5 é expresso especificamente na superfície dos eosinófilos e basófilos. A ausência da fucose no domínio Fc de benralizumabe resulta em afinidade elevada (45,5 nM) aos receptores Fcγ RIII das células imunológicas efetoras como as células natural killer (NK), levando à apoptose dos eosinófilos e basófilos, pelo aumento da citotoxicidade celular dependente do anticorpo (ADCC). Benralizumabe reduz a inflamação eosinofílica por promover a ADCC37,38.
A resposta farmacodinâmica do benralizumabe (depleção de eosinófilos no sangue) após administração subcutânea repetida foi avaliada em pacientes com asma em um estudo de fase II com 12 semanas de duração. A depleção de eosinófilos foi observada com todas as doses empregadas e ocorreu completamente ou quase completamente 24 horas após a administração do produto. O efeito sobre a depleção de eosinófilos no sangue foi mantido durante todo o período de administração, ou seja, do estudo39.
Benralizumabe foi aprovado pelo FDA como tratamento adjuvante para asma grave eosinofílica não controlada de pacientes maiores de 12 anos, mas no Brasil o foi apenas para adultos. É apresentado em seringa preenchida com 30 mg/mL, e essa dose deve ser administrada por via SC a cada quatro semanas, nas três primeiras doses, e a partir de então a cada oito semanas39. Nenhum ajuste de dose é necessário para pacientes idosos, pacientes com disfunção renal ou hepática39. À semelhança do preconizado para todos os outros biológicos, a aplicação deve sempre ser realizada por profissional de saúde habilitado, e o paciente mantido em observação por algum tempo. O benralizumabe é bem tolerado, mas alguns pacientes podem apresentar reações de hipersensibilidade, tais como anafilaxia, angioedema, rash cutâneo ou urticária.
Mepolizumabe
Mepolizumabe é um anticorpo monoclonal humanizado (IgG1, kappa) que tem como alvo a IL-5, principal citocina responsável pelo crescimento, diferenciação, recrutamento, ativação e sobrevivência dos eosinófilos40. Aprovado, em 2015, pela Agência de Medicamentos Europeia (EMA) e pelo Food and Drug Admnistration (FDA) para pacientes com asma grave eosinofílica, tem no Brasil sua autorização para prescrição em adultos como tratamento complementar de asma grave eosinofílica não controlada41.
O mepolizumabe liga-se diretamente à IL-5 e assim impede a ligação desta à cadeia alfa do receptor de IL-5 presente em eosinófilos e basófilos42. Assim, inibe a sinalização intracelular da IL-5, reduz a produção, crescimento, diferenciação, recrutamento, ativação, maturação e sobrevivência dos eosinófilos42-44, além de diminuir a expressão dos receptores de IL-5 na superfície de eosinófilos e basófilos45. Ao bloqueio da IL-5 pelo mepolizumabe segue-se queda do número de eosinófilos no sangue periférico e no tecido. Efeitos clínicos foram mais significativos para pacientes com contagem sérica de esoinófilos entre 150 e 300 cel/mm3 46. Caso o paciente esteja em uso crônico de corticosteroide sistêmico, o ponto de corte seria igual ou maior que 150 cel/mm3.
O mepolizumabe foi aprovado como terapia adicional para pacientes com asma grave eosinofílica não controlada, pelo FDA (maiores de 12 anos) e pela EMA (a partir dos 6 anos) em 2015. No Brasil, foi liberado para crianças maiores de 6 anos47.
O mepolizumabe é apresentado sob a forma de pó liofilizado para solução injetável (subcutânea), em embalagem com 1 frasco-ampola contendo 100 mg de mepolizumabe (100 mg/mL após a reconstituição)42. A mesma dose de mepolizumabe, administrada por via SC e IV mostrou ter a biodisponibilidade da via SC variável entre 64 e 75% da IV, dependendo do local de aplicação. O tempo para atingir a concentração máxima de mepolizumabe com a formulação IV foi de aproximadamente meia hora e consideravelmente mais longo quando administrado por via SC, que pode variar entre 2 a 14 dias48-50. No entanto, o perfil de eficácia e segurança de ambas as formulações foi comparável, conforme demonstrado no estudo DREAM51, sendo assim recomendada a via SC.
A dose de mepolizumabe (100 mg) deve ser administrada por via SC a cada quatro semanas. A idade e o sexo não parecem afetar a concentração plasmática do mepolizumabe. Em pacientes de 65 anos ou mais e em pacientes com insuficiência renal ou hepática não é provável que haja necessidade de ajustes42. A dose preconizada para crianças é 40 mg.
Estudos não têm demonstrado risco aumentado de reações adversas com mepolizumabe. Entretanto, reações sistêmicas de hipersensibilidade como anafilaxia, urticária, angioedema broncoespasmo, rash cutâneo e hipotensão podem ocorrer51.
Dupilumabe (anti-IL4/IL13)
O dupilumabe é anticorpo monoclonal IgG4 recombinante totalmente humanizado e direcionado contra a subunidade alfa do receptor de IL-4 e que bloqueia a sinalização intracelular da IL-4 via o receptor Tipo I (IL-4Rα/γc), e a da IL-4 e IL-13 pelo receptor de Tipo II (IL-4Rα/IL-13Rα)52. Estas citocinas são chave na ativação de resposta inflamatória tipo 2 e na patogênese das doenças alérgicas. A IL-4 induz a diferenciação de células CD4+ "naïve" em células Th2 efetoras. A IL-13 é importante na metaplasia de células caliciformes, hipersecreção de muco e sobre o músculo liso53,54.
Dupilumabe tem aprovação pelo FDA para pacientes maiores de 12 anos com dermatite atópica moderada/grave não controlada ou asma moderada/grave não controlada e para adultos com rinossussinusite crônica com polipose nasal55, e é o primeiro imunobiológico que pode ser autoadministrado pelo paciente. Os dados sobre segurança do dupilumabe são similares aos dos outros anticorpos monoclonais anti-IL-5, entretanto, o uso de dupilumabe pode resultar em incidência elevada de reações no local da injeção (até 18% de pacientes) e hipereosinofilia (em 4-14% dos pacientes). No Brasil, há aprovação para uso em maiores de 12 anos com dermatite atópica grave.
O dupilumabe é disponível em seringa pré- montada nas doses de 200 mg e 300 mg. Para adultos a dose inicial preconizada é 600 mg, em dose única, seguida por 300 mg administrados em semanas alternadas, por via SC55.
As reações adversas mais frequentemente relatadas ocorrem no local da injeção, conjuntivite, blefarite e herpes oral. Interrupção do tratamento por evento adverso sério oocorreu em cerca de 2%. Doença do soro foi raramente descrita55.
Não aprovados para uso no Brasil
Nesta seção apresentaremos algumas informações sobre alguns biológicos já aprovados para uso clínico fora do país e de alguns ainda em estudo.
Reslizumabe
O reslizumabe é anticorpo monoclonal humanizado subtipo IgG4, contra a IL-5 humana, citocina chave na diferenciação, maturação, recrutamento e ativação de eosinófilos humanos56. Por se ligar diretamente à IL-5, impede a sua fixação ao receptor de IL-5 e bloqueia a sua função biológica com consequente redução da atividade e sobrevida dos eosinófilos52. A sua administração intravenosa é seguida por queda do número de eosinófilos circulantes e, portanto, tem como principal indicação a asma grave eosinofílica não controlada56.
O reslizumabe foi o segundo biológico anti-IL-5 aprovado pelo FDA e EMA para asma grave eosinofílica não controlada em adultos. A sua administração intravenosa é seguida por queda do número de eosinófilos circulantes52.
O reslizumabe é apresentado na concentração de 10 mg/mL em frascos de 2,5 mL e de 10 mL. A dose preconizada de reslizumabe é 3 mg/kg, IV lento (20 a 50 minutos) a cada quatro semanas. As reações adversas encontradas foram elevação dos níveis de creatino-fosfoquinase (2%), e mais raramente, mialgia e eventos de hipersensibilidade (anafilaxia) (< 1%)56.
Tezepelumabe
O tezepelumabe é anticorpo monoclonal humanizado (IgG2) que se liga à linfopoietina do estroma tímico (TSLP), citocina similar à IL-757. Fixando-se à TSLP, o tezepelumabe impede a sua interação com o receptor de TSLP presente na superfície celular (TSLPR) e a formação do complexo TSLP-TSLPR-IL-7Rα, que seria responsável pela sinalização intracelular e pelos efeitos moduladores da IL-7, para a regulação e o desenvolvimento de células T e a homeostasia57. Ao impedir a formação do complexo, o tezepelumabe impossibilita a ativação da sinalização intracelular, reduz o papel inflamatório da mucosa respiratória e de outros tecidos epiteliais, evidenciado pela redução na produção de outras citocinas (como IL-3 e IL-5)57 e biomarcadores de inflamação alérgica (eosinofilia sanguínea, IgE, FeNO)58.
Expressão aumentada de TSLP no epitélio respiratório e em músculo esquelético foi observada em alguns pacientes com asma, e associada à restrição da função pulmonar59. O bloqueio da ligação da TSLP ao seu receptor em estudos experimentais com animais acompanhou-se por redução acentuada da inflamação das vias aéreas60-63.
Estudo de farmacocinética de dose única em indivíduos sadios e com dermatite atópica mostrou ser linear com concentração máxima mantida por até 10 dias. A biodisponibilidade da dose administrada por via SC foi 81% da por via IV, e meia-vida, oscilando entre 19,9 e 25,7 dias64,65.
Em 2018, o FDA aprovou o uso do tezepelumabe para adultos com asma grave sem padrão eosinofílico e não controlada na dose 210 mg cada quatro semanas, por via subcutânea66,67.
Lebrikizumabe (anti-IL13)
A IL-13, citocina associada à resposta inflamatória Th2, exerce papel importante na patofisiologia da asma por atuar no recrutamento de eosinófilos e basófilos, na produção de muco, diferenciação de células globosas e na produção de IgE68. A IL-13 induz a secreção de periostina por células epiteliais brônquicas. A periostina é expressa de modo intenso nos pulmões de pacientes com asma e contribui para a secreção de muco, fibrose e remodelamento das vias aéreas69. A periostina tem sido identificada como biomarcador da inflamação Th2 na asma70. Resultados de estudos clínicos com lebrikizumabe e tralokinumabe na asma levaram à descontinuação de pesquisas com estes medicamentos para asma.
Altrakincepte (anti-IL4)
Altrakincepte é um análogo recombinante humano solúvel do receptor da IL-4 (IL-4R) à porção extracelular da cadeia alfa do receptor de IL4, e bloqueia a ligação da IL-4 aos IL-4R presentes na membrana celular72.
Estudos iniciais mostraram ser os IL-4R solúveis seguros e bem tolerados em asmáticos, o altrakincepte manteve a função pulmonar após a descontinuação de CI73, fato não confirmado por estudos posteriores74.
Fevipiprante
Fevipiprante é uma molécula homóloga à do receptor quimioatraente ligado à proteína G e expresso em células Th2 (CRTH2), e é o receptor DP2 para prostaglandina. Prostaglandina D2 ativa o receptor DP2 e causa contração de musculatura lisa de brônquios. É um inibidor oral, altamente seletivo, potente, e antagonista reversível competitivo deste receptor75.
Estudos iniciais demonstraram segurança e eficácia do fevipiprante em pacientes com asma, por aumento do VEF1 e redução da inflamação eosinofílica da via aérea. Ainda se desconhece qual seria o melhor biomarcador capaz de prever resposta favorável ao fevipiprante, embora a resposta de pacientes com asma moderada a grave e evidência de inflamação Th2 parece reunir os melhores respondedores75,76.
Vários estudos clínicos de fase III (LUSTER 1 e 2) avaliaram a segurança do fevipiprante, assim como seu efeito sobre as exacerbações de asma em pacientes com doença grave não controlada. Os ZEAL 1 e 2 avaliaram a eficácia e a segurança do fevipiprante em pacientes com asma moderada e não controlada apesar de CI, e documentou-se mudança do VEF1 em relação ao basal. Além desses, estudos de longo prazo estão em andamento. Outros antagonistas de receptores de CRTH2 estão sob estudo: AZD1981, OC000459, setipiprante e BI671800 anti-CXCR2/IL-8, anti IL-33, anti IL-25, anti IL-1775,77,78.
IV - Medicamentos biológicos em asma e doenças alérgicas
As doenças alérgicas estão entre as mais comuns do mundo, e a despeito de diferentes terapias, muitos pacientes persistem com sintomas não controlados79. Recentemente, o avanço no conhecimento e o entendimento da fisiopatologia relacionada às doenças alérgicas tornou evidente que apesar de pacientes apresentarem o mesmo quadro clínico, os agentes biológicos responsáveis pela doença podem diferir entre os pacientes, conceito conhecido como endotipos de uma doença. Ao contrário do fenótipo, que se baseia na descrição clínica da doença, o endotipo é definido como a subclassificação de uma determinada doença baseada no mecanismo fisiopatológico e na associação com biomarcadores clínicos. Esse novo conhecimento trouxe à tona potenciais alvos terapêuticos para drogas imunobiológicas para endotipos específicos que em geral têm uma resposta pobre aos tratamentos usuais para a uma doença, como asma e dermatite atópica80.
Da mesma forma, o grande aumento no conhecimento das imunodeficiências primárias (IDP) com o reconhecimento da causa genética de muitos desses quadros por meio das novas técnicas de sequenciamento genético, proporcionou um melhor entendimento de muitas dessas doenças. Isto possibilitou para diversas delas, alvos terapêuticos para drogas imunobiológicas, o melhor controle dessas doenças81. Pela imensa rede de interação dos componentes imunológicos e o progressivo aumento do conhecimento do funcionamento do sistema imunológico, sua interação com os diversos sistemas biológicos, é impossível esgotar toda a rede de possibilidades em relação a alvos terapêuticos em uma publicação.
1. Asma
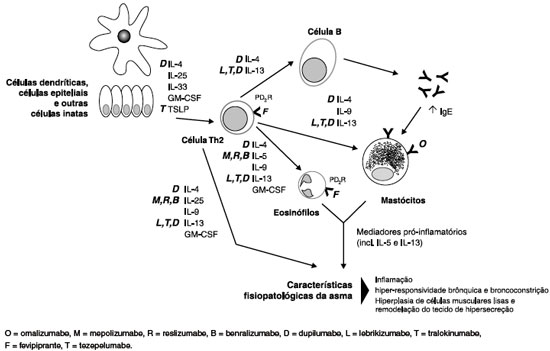
Atualmente são conhecidas duas vias inflamatórias principais na asma, tipo 2 (Th2) dirigida e não tipo 2 dirigida. A via Th2 é caracterizada pela ativação de citocinas derivadas do linfócito T auxiliar (helper) 2 e células linfoides inatas (ILC) tipo 2 que resultam na atopia e eosinofilia características das doenças alérgicas tradicionais82. A cascata inflamatória inicia-se com as células epiteliais, que liberam diversas citocinas como a IL-25, IL-33 e TSLP em resposta a agentes diversos como alérgenos, poluentes e agentes infecciosos (Figura 3). Estas citocinas são responsáveis pelo influxo e ativação de células como eosinófilos, basófilos, mastócitos e linfócitos83. O medicamento biológico utilizado a mais tempo no tratamento da asma grave tem como alvo a própria IgE, enquanto os mais recentes, em sua maioria apresentam como alvos as citocinas e seus receptores em vias finais de inflamação, em especial IL-4, IL-5 e IL-13. Devido à sua localização nessa cascata inflamatória do perfil Th2 a partir das células epiteliais, componentes da imunidade inata, o TSLP tem recentemente sido estudado como um alvo64. Outro potencial alvo biológico potencial que tem sido estudado é o receptor da prostaglandina D2 (receptor D2) para o controle da asma, uma vez que foi associado ao direcionamento ao perfil inflamatório Th2, estimulando a produção de citocinas IL-4, IL-5 e IL-13, além de retardar a apoptose de células Th2 e mediar quimiotaxia e degranulação de eosinófilos84. Outros alvos terapêuticos potenciais na asma de perfil Th2 incluem a via da IL-33 e ainda, IL-6, que devem ser investigados num futuro próximo85.
Atualmente no Brasil estão aprovados omalizumabe, mepolizumabe e benralizumabe.
Omalizumabe
O omalizumabe é um anticorpo recombinante humanizado (IgG1) que tem especificidade para o terceiro domínio da cadeia pesada da IgE circulante (anti-IgE). A ação direta do omalizumabe é bloquear a ligação da IgE aos seus receptores presentes na superfície de mastócitos e basófilos, reduzindo assim a liberação de mediadores como histamina, leucotrienos, prostaglandinas, entre outros86,87. Ações indiretas destes anticorpos foram demonstradas, como a diminuição da expressão de receptores de alta afinidade para IgE (FceRI)24, a inibição da síntese de IgE pelos linfócitos B88 e melhoria da resposta inata antiviral dependente de IFN-α89.
O omalizumabe foi o primeiro medicamento aprovado para o tratamento de asma grave alérgica não responsiva ao tratamento habitual90. Para a sua indicação a maiores de 6 anos, o fenótipo alérgico da asma deve ser comprovado pelos testes cutâneos de leitura imediata, ou pela dosagem de IgE sérica específica para aeroalérgenos86,87.
A eficácia do omalizumabe foi comprovada para os desfechos taxa de exacerbações graves, qualidade de vida e redução do uso de corticosteroides sistêmicos86,87,91,92, além de diminuição de sintomas e melhora nos parâmetros da função pulmonar86,93. Metanálise que compilou dados de sete estudos mostrou redução na taxa de exacerbações e de visitas a serviços de emergência de 38% e 47%, respectivamente94. Outra metanálise que analisou pacientes com pelo menos 52 semanas de tratamento concluiu que os efeitos benéficos da terapêutica são mantidos nos pacientes que utilizam o omalizumabe por longo prazo95. Os benefícios observados com o anticorpo anti-IgE nos pacientes com asma alérgica não controlada, apesar do uso de altas doses de corticosteroides inalados e broncodilatadores de longa duração, foram evidenciados em adultos e crianças96,97.
Embora fosse esperado que o omalizumabe inibisse a fase imediata da reação de hipersensibilidade tipo I, o impacto na fase tardia foi observado na broncoprovocação com ácaros98. Outra pesquisa inovadora mostrou que o uso do omalizumabe antes e durante o outono, período quando há aumento da prevalência das infecções virais e quando as crianças norte-americanas voltam das férias, diminui o risco de exacerbação por asma, inclusive de maneira superior à intervenção de aumentar a dose de corticosteroides inalados. Especula-se que esse risco menor de exacerbações se deva à melhoria da resposta inata, com secreção de IFN-α89.
A maioria dos pacientes respondedores apresenta resposta em até 16 semanas de tratamento, mas outros podem demorar seis meses, ou até um ano99,100. Caso não haja resposta após este período, o omalizumabe deve ser descontinuado.
O omalizumabe tem bom perfil de segurança, mas deve ser administrado sob supervisão médica, pois raros casos de anafilaxia têm sido observados101. Não há evidências de parasitoses graves ou de difícil controle como reação adversa da terapia. Apenas um estudo mostrou tendência de maior chance de reinfestação em quem está utilizando omalizumabe102. Também não há risco aumentado de poliangeíte granulomatosa eosinofílica103.
Administrado por via subcutânea, quinzenalmente ou mensalmente, o omalizumabe tem sua dose ajustada de acordo com os níveis plasmáticos de IgE e o peso do paciente86,87. A dose a ser administrada também pode ser calculada pela fórmula: 0,016 mg de omalizumabe X peso (Kg) X IgE total (UI/mL)104. O paciente deve permanecer sob supervisão médica por duas horas nas três primeiras administrações do anticorpo, e por meia hora nas subsequentes86.
Benralizumabe
O benralizumabe, anticorpo anti-IL-5, fixa-se diretamente à porção alfa do receptor de IL-5 expresso na superfície de eosinófilos e basófilos. Por impedir a ligação da IL-5 ao receptor, atua reduzindo a ativação dos mesmos, e estudos prévios demonstraram também redução das exacerbações de asma, melhora na função pulmonar, redução no uso de corticosteroides, mas também resultados variáveis na melhora dos escores de sintomas e qualidade de vida.
À semelhança de outros tratamentos com agentes anti-IL-5, o FDA não estabeleceu um ponto de corte para o número de eosinófilos para a sua indicação, todavia os primeiros estudos basearam-se em pacientes com número absoluto de eosinófilos igual ou maior que 300 cels/mm3 105,106.
A eficácia do benralizumabe foi documentada pela redução da frequência de exacerbações clinicamente significantes, melhora da função pulmonar e redução/desmame de corticosteroide oral. No estudo CALIMA, o tratamento com benralizumabe determinou redução de 28% no número de exacerbações clinicamente significantes105, e 51% no estudo SIROCCO106. Além disso, houve melhora da função pulmonar entre 116 e 159 mL do VEF1 quando comparado ao placebo105,106. Em pacientes em uso crônico de corticosteroide sistêmico e contagem de eosinófilos séricos maior ou igual a 150 cel/mm3, o tratamento com benralizumabe, a cada 8 semanas, permitiu a redução da dose de corticosteroide oral recebida em 75%, e 52% conseguiram abandoná-lo completamente. Mesmo assim, houve 70% de redução na frequência de exacerbações graves de asma107.
O uso de corticosteroide oral, polipose nasal, função pulmonar reduzida (capacidade pulmonar forçada) e redução do número de eosinófilos no escarro foram identificados como preditores de resposta do benralizumabe108.
O regime de tratamento preconizado para o benralizumabe é 30 mg, SC, a cada 4 semanas nos primeiros três meses, e a seguir 30 mg a cada 8 semanas (único biológico administrado a cada 8 semanas). De modo semelhante a outros anti-IL-5, a resposta terapêutica poderá ser avaliada em três a seis meses. A expectativa de tratamento é por longo prazo, e é normalmente bem tolerado109.
A depleção de eosinófilos no sangue após administração subcutânea (SC) repetida de benralizumabe foi observada com diferentes doses, e foi quase completa 24 horas após a administração, e manteve-se durante todo o período de estudo5. O mesmo ocorreu com o número de eosinófilos no escarro (100 ou 200 mg, SC, a cada quatro semans por 8 semanas)109.
Os eventos adversos mais comuns (entre 1% e 10%) referidos pelos pacientes em tratamento com benralizumabe foram cefaleia, faringite, artralgia, tosse, perturbações gerais e alterações no local de administração (pirexia, dor, eritema, prurido, pápula) similares ao placebo e reações de hipersensibilidade (anafilaxia, angioedema, urticária, urticária papular, erupção cutânea). Na presença de reações de hipersensibilidade, é recomendado que o tratamento seja descontinuado109.
Por reduzir o número de eosinófilos, o benralizumabe poderia prejudicar a resposta imunitária às infecções por helmintos. As infecções pré-existentes devem ser tratadas antes do início da terapia. Se alguém desenvolver uma infecção por helmintos durante a terapia e não responder aos anti-helmínticos, o benralizumabe deve ser interrompido105,110-112.
O benralizumabe é apresentado em seringa prémontada de dose única (30 mg). A dose recomendada (uma seringa) deve ser administrada por via SC (parte superior do braço, coxa ou abdomen) por um profissional de saúde, a cada quatro semanas, durante as primeiras três doses e em seguida, a cada oito semanas111.
A sua meia-vida de eliminação é de cerca de 15,5 dias, e por ser totalmente catabolizado, não se espera que haja interferência da sua metabolização e eliminação em indivíduos com insuficiência renal ou hepática111,112. Embora não tenha sido avaliado em gestantes, os anticorpos IgG podem atravessar a placenta particularmente no terceiro trimestre da gravidez. Isso poderia esgotar os eosinófilos no feto e apresentar riscos ao recém-nascido. Anticorpos também podem ser excretados no leite materno111.
Mepolizumabe
O mepolizumabe, anticorpo anti-IL-5, liga-se diretamente à IL-5, e assim impede a fixação da IL-5 aos receptores de IL-5, expressos na superfície de eosinófilos. Dessa forma, reduz a ativação dessas células e liberação de mediadores inflamatórios, tais como a proteína básica principal, arilsulfatase e leucotrienos113. Estudos com mepolizumabe em pacientes com asma grave eosinofílica mostraram redução nas exacerbações da asma, redução no uso de corticosteroides e melhora na função pulmonar, em especial naqueles com eosinofilia muito elevada; entretanto os resultados nos escores de sintomas e qualidade de vida na asma foram variáveis44,51,114-122. Houve redução em até 50% no consumo de corticosteroide sistêmico em pacientes em uso crônico de corticosteroide oral (SIRIUS)114 ou não122.
Embora alguns estudos tenham mostrado aumento da função pulmonar, o mesmo não foi confirmado por estudos mais abrangentes120-122. Possivelmente tais inconsistências sejam decorrentes das diferentes doses de mepolizumabe utilizadas e sua ação no tecido. Subanálise dos resultados do estudo DREAM120 confirmou que o tratamento com doses elevadas de mepolizumabe (750 mg IV) foi efetivo em reduzir em 88% o número de eosinófilos no escarro, fato que não ocorreu com a dose menor (75 mg IV) similar à preconizada (100 mg SC)110.
A administração IV do mepolizumabe segue-se por queda de 50% no número de eosinófilos sanguíneos, e que pode atingir 85% entre 6 e 43 dias após o início do tratamento40,123. O mesmo foi observado com pacientes que receberam o mepolizumabe por via SC nas doses de 125 mg e 250 mg, quando comparados a 75 mg IV, e que persistiram além de 140 dias após o tratamento49 e com redução média dos eosinófilos presentes nas vias aéreas de 55%124. Embora o mepolizumabe tenha sido avaliado quando administrado pelas vias IV e SC, a sua aprovação foi para a formulação SC, na dose de 100 mg cada quatro semanas para adultos, e 40 mg para crianças.
Apesar de não ter sido definido um ponto de corte para o número de eosinófilos séricos quando do início do tratamento com mepolizumabe, a análise posterior de estudos MENSA e o DREAM confirmou a relação positiva entre maior redução de exacerbações de asma e o maior número de eosinófilos séricos44.
Com relação ao efeito poupador de corticosteroide oral (CO), o tratamento com mepolizumabe foi acompanhado por chance de 2,39 em reduzir a dose de corticosteroide sistêmico em comparação ao placebo51. A resposta clínica com o mepolizumabe foi mantida durante a fase aberta do estudo multicêntrico de 52 semanas (COSMOS), sugerindo eficácia a longo prazo114.
Quanto à segurança, os estudos DREAM, MENSA, SIRIUS e COSMOS indicaram que o mepolizumabe foi bem tolerado em todas as doses. Estes ensaios principais que investigaram a eficácia clínica do mepolizumabe reportaram poucos eventos adversos relacionados com a terapêutica, sugerindo segurança em curto e em longo prazo51,114,118,120. Embora tenham sido relatadas mortes nesses estudos, elas ocorreram de modo aleatório entre os com tratamento ativo e com placebo. De modo similar, ocorreu com o relato de neoplasias. Não houve relato de anafilaxia relacionada ao mepolizumabe. O evento adverso relacionado à droga mais frequentemente apontado foi a reação local relacionada à infusão (não alérgicas), apontada por 6% dos tratados com placebo, e entre 5 e 12% dos com mepolizumabe (variável com a dose).
O mepolizumabe demonstrou eficácia no tratamento da asma grave não controlada, apesar da terapia combinada com CI em altas doses associado a agente beta-2 agonista de longa duração, em pacientes com asma não controlada e com contagem periférica de esosinófilos superior a 150 células/mm3 e que apresentaram pelo menos duas exacerbações que exigiram tratamento com CO no ano anterior.
Para pacientes não responsivos ao omalizumabe, a mudança para mepolizumabe ocorreu de modo efetivo, com redução em 64% das exacerbações de asma, e aumento de 120 mL do VEF1 125.
O tratamento com mepolizumabe diminuiu o número de exacerbações da asma e melhorou o VEF1 pré e pós-broncodilatador, assim como os sintomas e escores de controle da asma. Além disso, esses pacientes tiveram a necessidade de terapia com CO de manutenção reduzida ou em alguns casos descontinuados. O mepolizumabe parece ter um perfil de segurança favorável baseado em dados de segurança clínica, sendo os efeitos adversos mais frequentes a dor de cabeça e nasofaringite.
Dupilumabe
O dupilumabe liga-se à subunidade alfa do receptor de IL-4 e assim bloqueia a sinalização intracelular da IL-4, via o receptor Tipo I (IL-4Rα/γc), e a da IL-4 e IL-13 pelo receptor de Tipo II (IL-4Rα/IL-13Rα)52. Encontra-se em fase final de estudos para aprovação para o tratamento da asma no Brasil. O dupilumabe foi aprovado pelo FDA para o tratamento de pacientes com 12 anos ou mais, com asma grave com fenótipo eosinofílico, ou asma córtico-dependente41.
Redução do número de exacerbações clinicamente significantes e melhora da função pulmonar foi associada ao tratamento com dupilumabe em pacientes com asma moderada-grave não controlada e documentada por estudos recentes112,126. Embora em um desses estudos (QUEST) os pacientes tenham sido admitidos independentemente dos biomarcadores iniciais de inflamação T2, melhora mais acentuada ocorreu entre os com contagem absoluta de eosinófilos sanguíneos maior ou igual a 300 cel/mm3 (redução de 67%), e com nível elevado de FeNO (25 ppb ou maior) (redução de 61 a 65%)112.
O estudo VENTURE avaliou o efeito do dupilumabe no tratamento de pacientes sob uso crônico de corticosteroide sistêmico, e documentou a possibilidade de reduzir a dose de corticosteroide oral (CO) em 70%, e que mais da metade dos pacientes conseguiram interromper completamente o CO e, além disso, houve redução em 59% do risco de exacerbação de asma e aumento da função pulmonar quando comparado ao placebo126. Vale destacar que esses achados ocorreram mesmo na ausência de níveis pré-estabelecidos de eosinófilos sanguíneos à admissão (redução de 60% mesmo para os com níveis inferiores a 150 cel/mm3).
Revisão sistemática de quatro estudos seguida por metanálise com pacientes com asma grave não controlada, maiores de 18 anos e tratados com dupilumabe evidenciou redução da taxa anual de exacerbações de asma, aumento significante nos valores do VEF1, sem aumento de relato de eventos adversos, eventos graves ou capazes de levar à morte, descontinuação do tratamento por eventos adversos, ocorrência de infecção de vias aéreas superiores quando comparado aos tratados com placebo127. A análise de subgrupos documentou a mesma ação significante do dupilumabe entre os pacientes com taxa maior de 150 eosinófilos/mm3 127.
De modo similar aos estudos incluídos nessa metanálise, concluiu-se que a adição do dupilumabe para pacientes com asma grave não controlada foi associada a risco reduzido de exacerbações graves de asma, melhora do VEF1 sem haver aumento de eventos adversos, exceto pela reação no local da injeção com dupilumabe52,127.
De acordo com o FDA, o dupilumabe deve ser administrado por via SC na dose de 400 mg ou 600 mg, seguido por 200 mg ou 300 mg cada duas semanas. Preconiza-se a dose mais elevada para os pacientes dependentes de CO que têm dermatite atópica grave como comorbidade.
O perfil de segurança do dupilumabe em pacientes com asma é semelhante ao dos outros anticorpos monoclonais anti-IL-5, entretanto, incidência elevada de reações no local da injeção (até 18% dos pacientes) e hipereosinofilia (4 a 14% dos pacientes) tem sido observado126,128. A hipereosinofilia observada com o dupilumabe é transitória, e retorna aos níveis basais com a interrupção da terapia. Cogita-se que o dupilumabe por interferir com a homeostase dos eosinófilos, estes permaneceriam no interior dos vasos causando o seu aumento transitório129,130.
A disponibilidade futura do dupilumabe para o tratamento da asma, em nosso meio, o torna opção segura que poderá beneficiar aqueles pacientes que experimentaram respostas subótimas aos não biológicos, ou não responderam aos biológicos disponíveis aprovados.
Reslizumabe
A eficácia do reslizumabe no tratamento de pacientes com asma eosinofílica grave tem sido demonstrada pela capacidade em reduzir a frequência de exacerbações graves de asma, melhora da função pulmonar, reduzir a necessidade de agentes beta-2 agonistas de resgate, melhora da qualidade de vida e controle da asma111,131-133. A redução da taxa de exacerbações graves de asma tem ocorrido em 50% dos pacientes tratados122. Entretanto, a capacidade do reslizumabe em reduzir o uso de corticosteroide sistêmico ainda permanece não esclarecida. Todavia, estudo com pequeno número de pacientes em uso crônico de corticosteroide sistêmico com eosinofilia em escarro e exacerbações de asma apesar de serem tratados com mepolizumabe (100 mg, SC), mostrou redução da eosinofilia da via aérea e melhora do controle da asma134.
Com relação à função pulmonar, o reslizumabe mostrou melhora modesta na função pulmonar de aproximadamente 90 a 180 mL em cada um dos estudos principais111,131-133.
Revisão sistemática seguida por metanálise avaliou cinco estudos randomizados e controlados por placebo de pacientes com asma grave eosinofílica para avaliar a eficácia do tratamento com reslizumabe ou mepolizumabe135. A análise combinada dos cinco estudos documentou redução significante do número de exacerbações anuais de asma entre os tratados com anti-IL-5 em comparação ao placebo, apontando redução absoluta do risco de exacerbação em 53%, além de melhora da qualidade de vida135. Fato semelhante foi observado por outros111.
Estudo multicêntrico, prospectivo, aberto, de grupo único, avaliou a ação do reslizumabe em pacientes com asma eosinofílica grave não responsiva ao tratamento com omalizumabe136. Houve incremento do escore do ACT, redução do número de pacientes dependentes de CO (72,4 a 52,0%) e os eventos adversos foram de média intensidade e com incidência similar à descrita previamente para reslizumabe136. Melhora da função pulmonar (aumento de 100 mL no VEF1) e controle da asma (melhora do escore do Asthma Control Questionnaire) são apontados como preditores de boa resposta ao reslizumabe137.
A administração do reslizumabe por via SC parece não ter atingido os desfechos primários em estudos clínicos recentes138. Independentemente da via utilizada, os estudos mostram perfil de segurança satisfatório para ambas e houve relato de reações de hipersensibilidade50. O tratamento de longa duração tem sido o recomendado139, e à semelhança dos outros anti-IL-5, os eosinófilos séricos começam a ascender após 12 semanas de interrupção do tratamento.
O relato de três episódios de anafilaxia com o uso de reslizumabe132 gerou uma advertência do FDA, à semelhança dos outros biológicos. A administração deve ser realizada em local preparado para tratar reações adversas graves, como a anafilaxia140.
O reslizumabe, aprovado pelo FDA para uso em pacientes com 18 anos ou mais, com asma grave eosinofílica não controlada140, está aprovado no Brasil.
Lebrikizumabe
Estudos iniciais, randômicos e controlados mostraram resultados contraditórios sobre o efeito de lebrikizumabe no tratamento de pacientes adultos com asma moderada a grave. Em estudo de fase II em adultos com asma moderada a grave, e sem uso de corticosteroide inalado, o tratamento com lebrikizumabe não proporcionou melhora do VEF1 141. O mesmo ocorreu com estudo fase III com pacientes adultos com asma moderada a grave tratados com lebrikizumabe (150 mg SC), placebo ou montelucaste por 12 semanas2. À 12ª semana, embora os valores de VEF1 fossem maiores com lebrikizumabe, não houve significância estatística. Os autores comentam que o lebrikizumabe foi seguro e bem tolerado142.
Revisão sistemática seguida por metanálise avaliou a eficácia e a segurança do lebrikizumabe no tratamento de adultos com asma grave não controlada, apesar de estarem com doses elevadas de corticosteroides inalados e agente beta-agonista de longa duração72. Observou-se redução significante na taxa de exacerbações de asma e aumento significante do VEF1% previsto. A análise após estratificação segundo os níveis de periostina mostrou que o tratamento ativo naqueles com valores elevados aumentou significantemente a diferença entre os valores iniciais e finais do VEF1, fato que não foi observado entre os com níveis baixos. Não houve diferenças entre os tratados com lebrikizumabe e placebo com relação à incidência de eventos adversos72.
Esses efeitos foram corroborados por metanálise posterior que avaliou o tratamento de adultos com asma grave não controlada com anti-IL-13: lebrikizumabe e tralokinumabe71. O tratamento ativo acompanhou-se por redução das exacerbações da asma, do VEF1, redução do uso de medicação de resgate, melhora da qualidade de vida sem aumento da incidência de eventos adversos, sobretudo os graves. A periostina também foi confirmada como bom biomarcador para detectar um grupo específico de pacientes que podem se beneficiar com o tratamento com anti IL-1371.
O lebrikizumabe, assim como o tralokizumabe, não estão disponíveis para uso no Brasil.
Tezepelumabe (anti-TSLP)
O tezepelumabe é anticorpo monoclonal humanizado específico contra a linfopoietina do estroma tímico (TSLP), indicado para adultos com asma moderada a grave não controlada e com inflamação não-eosinofílica143.
Estudo de fase 2, duplo-cego controlado por placebo, avaliou o tezepelumabe subcutâneo em três doses diferentes contra placebo, por 52 semanas (Pathway) em adultos com asma moderada/grave não controlada com dose média/alta de CI e LABA inalados. O objetivo principal primário foi o número de exacerbações anuais na 52ª semana de tratamento. Independentemente da dose empregada (baixa, média, alta) houve redução significante da taxa anual de exacerbações de asma (média 66%), quando comparado ao placebo, isto independentemente do número de eosinófilos ao início do estudo. O VEF1 pré-broncodilatador à 52ª semana de tratamento foi significantemente maior que o do placebo para os três regimes de tratamento. Não houve diferenças relacionadas às doses-respostas58. Em relação aos biomarcadores de inflamação alérgica, observou-se redução substancial na contagem de eosinófilos séricos e nos níveis de FeNO em todos os grupos tratados com tezepelumabe, comparados com o placebo58.
No estudo conceitual com tezepelumabe, avaliouse os efeitos adversos do tratamento com tezepelumabe 700 mg, IV, por três meses. Não foi associado a alterações em exames laboratoriais, aumento da temperatura, pressão arterial, frequência cardíaca ou respiratória. Foram relatados 15 eventos adversos no grupo ativo, e 12 no grupo placebo. Não houve nenhum evento adverso grave ou morte64. No estudo Pathway, a incidência de eventos adversos foi semelhante em todos os grupos (61 a 67%), assim como a de ventos adversos sérios (9,0 a 12,3%). Ocorreram três eventos adversos sérios: dois no mesmo paciente do grupo de baixa dose (pneumonia e AVC, que o levou ao óbito), e uma síndrome de Guillain-Barré em paciente do grupo de média dose58. Os eventos adversos mais frequentes (mais de 5%) foram: asma (18,6 a 33,8%) e nasofaringite (10,3 a 14,5%). Reações no local da aplicação subcutânea de 1 mL do medicamento ou placebo ocorreram entre 1,4 e 3,4%58.
Outros estudos foram desenvolvidos com o propósito de avaliar o tezepelumabe no tratamento de adolescentes e adultos com asma, por tempo prolongado (Navigator)144, em adultos com asma grave e corticodependentes (Source)145, segurança por prazo de três anos (Destination)146 e avaliação de efeito poupador de corticosteroides (Cascade)147.
2. Dermatite atópica
A dermatite atópica (DA) é outra doença alérgica que ocorre inicialmente no processo da marcha atópica, caracterizada pela presença de inflamação crônica da pele, pruriginosa, recorrente ou persistente, que pode persistir até a fase adulta em cerca de 15 a 20% dos indivíduos. Associa-se com frequência à asma e à rinite alérgica, reforçando o papel da inflamação Th2 nessa doença148. A alteração da barreira epitelial cutânea, em especial por mutações da filagrina, foi observada em grande número de pacientes, e é considerada como um dos fatores genéticos importantes associados a DA149.
Como a asma, a DA é considerada uma doença multifatorial nas quais componentes genéticos diversos estão associados a fatores ambientais para o desencadeamento da doença. Esses fatores associados levam ao desequilíbrio da inflamação Th2 com elevado níveis de linfócitos de perfil Th2 circulantes, que proporcionam elevação dos níveis de IL-4, IL-5 e IL-13 que atraem eosinófilos e basófilos e ainda, promovem a produção de IgE pelas células B. Na DA, essas citocinas estão presentes na derme e epiderme, atuando nos queratinócitos que, ativados, atuam na quebra da função de barreira cutânea, permitindo a penetração de alérgenos, irritantes e patógenos que levam à liberação de TSLP, IL-33 e IL-25 pelas células epiteliais, perpetuando o ciclo lesão-prurido (coceira leva à lesão, que libera mais citocinas, que causam mais prurido)150. Elas também promovem a ativação das ILC2, que em seguida estimulam a inflamação Th2 e, ainda, células Th17 e Th182 (Figura 4).
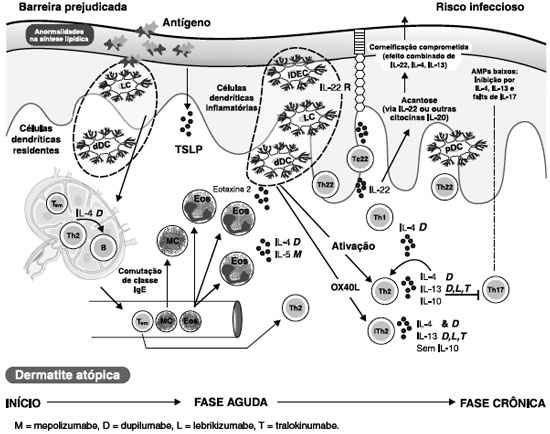
Figura 4 Citocinas envolvidas na patofisiologia da dermatite atópica. Adaptado de Manka LA & Wechsler ME80
A IL-31, que é produzida por células Th2, queratinócitos e mastócitos em reposta a peptídeos microbianos tem sido encontrada em níveis elevados na pele de pacientes com DA e em modelos murinos150. A presença de níveis elevados de IL-31 resultou em sintomas semelhantes ao de DA, especialmente o prurido, e por isso nemolizumabe, bloqueador da IL-31, tem sido estudado em pacientes com DA moderada a grave refratária ao tratamento, com significante melhora clínica dos pacientes na fase 2 de estudo151.
Podemos ainda incluir na lista de alvos terapêuticos potenciais na DA: IL-6, IL-17, IL-22, IL-12/IL-23p40, IL-33, TNF-α, JAK/STAT, fosfodiesterase 4 (PDE4), receptor 4 da histamina, muitos deles em diferentes fases de estudo152.
Omalizumabe
O omalizumabe no tratamento de DA mostrou resultados conflitantes. Embora a maioria dos dados seja decorrente de pequenos ensaios randomizados, séries de casos e relatos de casos com benefício clínico e resolução do eczema, um pequeno número de estudos não mostrou melhora da doença com o omalizumabe153. Essa variação de resposta ao tratamento poderia ser justificaticada por viés de seleção, ou seja, teriam sido identificados os pacientes com maior probabilidade de responder à terapia anti-IgE, por exemplo, ausência de mutações da filagrina e concentração séricas mais baixas de IgE total, apontados como fatores associados a uma provável resposta favorável ao omalizumabe154.
O tratamento com omalizumabe revelou bom perfil de segurança tanto em adultos quanto em crianças. No entanto, a ampla variabilidade de resposta ao tratamento permanece em grande parte obscura. É importante definir a dose a ser administrada, nível sérico limítrofe de IgE sérica total a partir do qual o omalizumabe não seria empregado, frequência das doses, tempo de tratamento, entre outros. Além disso, os estudos controlados por pacebo e disponíveis revelam melhora clínica similar de pacientes tratados com o omalizumabe e os com placebo152,155.
Dupilumabe
Dupilumabe em pacientes com DA moderada a grave, inadequadamente controlados com medicações tópicas, foi superior ao placebo na melhora dos sinais e sintomas da DA (incluindo prurido e o efeito no sono), com redução clinicamente significativa dos sintomas de ansiedade e depressão relatados pelos pacientes e melhor qualidade de vida relacionada à saúde. Reação no local de injeção e conjuntivite foram mais frequentes em pacientes que receberam dupilumabe do que naqueles que receberam placebo156,157.
Um estudo duplo-cego de um ano de duração avaliou a adição de dupilumabe ao tratamento padrão com corticosteroides tópicos, com ou sem inibidores tópicos de calcineurina. Este demonstrou eficácia em várias medidas de gravidade clínica, nos sinais e sintomas da DA, incluindo prurido, sintomas de ansiedade e depressão e melhora na qualidade de vida. Melhora significativa no prurido ocorreu a partir da segunda semana. Dupilumabe associado a corticosteroides tópicos também reduziu a incidência de crises e o uso de tratamentos tópicos e sistêmicos de resgate158. Este estudo dá evidência ao dupilumabe como terapia biológica primária a pacientes com DA moderada a grave que não são controlados com medicações tópicas. Os resultados validam o papel fundamental da IL-4 e da IL-13 na patogênese da DA e outras doenças alérgicas relacionadas à inflamação tipo 2 e associadas à dermatite atópica159.
O dupilumabe foi aprovado pela FDA em março de 2017, e, em 2019 no Brasil, para o tratamento da DA moderada a grave em maiores de 12 anos. Para adolescentes com até 60 Kg, a dose inicial é 400 mg (2 injeções de 200 mg), em dose única, seguida por 200 mg administrados uma vez a cada duas semanas. Para adolescentes com 60 Kg ou mais e adultos, a dose inicial é de 600 mg (duas injeções de 300 mg), seguida de 300 mg administrados uma vez a cada duas semanas, por via SC.
Estudo retrospectivo de pacientes com DA tratados com dupilumabe mostrou melhora da gravidade da DA em 66 (86%) deles, e em 30% houve desaparecimento completo dos sinais e sintomas. O dupilumabe, em geral, foi bem tolerado e não causou eventos adversos graves. Os efeitos colaterais mais comuns incluíram olhos secos, conjuntivite e ceratite. O motivo mais comum para a descontinuação do tratamento foi a falta de melhora clínica substancial ou a progressão da gravidade da doença, seguida por efeitos colaterais oculares. Esses resultados fornecem informações adicionais úteis sobre a segurança e a utilidade do tratamento com dupilumabe para a DA moderada a grave no cenário clínico do mundo real160.
Lebrikizumabe
A IL-13 desempenha papel central na inflamação do tipo 2, e certos polimorfismos genéticos estão associados ao aumento do risco de DA161. Observa-se expressão aumentada de RNAm de IL-13 em amostras de biópsia de pele de pacientes com DA em comparação às de controles saudáveis. Estes níveis de expressão de RNAm de IL-13 se correlacionam com a gravidade da DA161. Além disso, a superexpressão de IL-13 mostrou redução da integridade epitelial pela regulação negativa de componentes chave da barreira cutânea162. O tratamento da DA com ciclosporina pode diminuir os níveis de IL-13 na pele163, e estudos apontaram melhora da resposta clínica em pacientes com DA moderada a grave tratados com dupilumabe, um anticorpo monoclonal contra IL-4Rα, que inibe a sinalização de IL-13/IL-4158. Juntos, esses dados sustentam a IL-13 como um mediador chave na DA.
O lebrikizumabe é um anticorpo monoclonal que se liga especificamente, e, com alta afinidade, à IL-13, impedindo a heterodimerização da IL-13Rα1/IL-4Rα e subsequente sinalização164. O lebrikizumabe foi previamente investigado para o tratamento da asma, e os dados foram acumulados em 11 ensaios clínicos randomizados, envolvendo 4.411 indivíduos164-166. Após dados promissores da fase 2b na asma não controlada, apenas um dos dois estudos de fase 3 na asma grave demonstrou redução estatisticamente significante das exacerbações da asma na população de análise primária. No entanto, com base no envolvimento da IL-13 em várias vias da patogênese da DA, o lebrikizumabe representa uma nova terapia direcionada na DA.
Estudo fase II, randômico, duplo-cego, controlado por placebo, investigou a eficácia e segurança de lebrikizumabe como um complemento ao tratamento com corticosteroides tópicos (TCS). Um total de 209 adultos com DA moderada a grave participaram do estudo. Na 12ª semana, de modo significante, um maior número de pacientes mostrou melhora dos índices de gravidade com lebrikizumabe 125 mg a cada 4 semanas167.
Os autores discutem que o tratamento com corticosteroide tópico, duas vezes ao dia, requerido pelo protocolo, limitou a compreensão da eficácia do lebrikizumabe como monoterapia. A curta duração do estudo não permitiu avaliações de eficácia ou segurança de longo prazo. Todos os eventos advervos relatados não foram graves, nenhum levou à descontinuação do tratamento e não houve relação dose-resposta167.
Tralokinumabe
O tralokinumabe é um anticorpo monoclonal IgG4 humano que se liga à IL-13, de forma potente e específica, e neutraliza seus efeitos168.
Estudo de fase IIb avaliou a eficácia, segurança e tolerabilidade do tralokinumabe em adultos com DA moderada a grave169. Na dose de 300 mg durante 12 semanas de tratamento, tralokinumabe demonstrou melhora significativa na pontuação do EASI (Índice de Gravidade da Área de Eczema) quando comparado ao placebo. Observou-se melhor resposta do IGA (Avaliação Global do Investigador), no SCORAD (SCORing Atopic Dermatitis), no Índice de Qualidade de Vida em Dermatologia e na escala de classificação numérica de prurido entre os tratados com tralokinumabe. Respostas mais intensas ocorreram nos subgrupos que apresentavam concentrações aumentadas de dipeptidil peptidase-4 (DPP-4) e periostina, biomarcadores séricos de IL-13 aumentada. Infecção do trato respiratório superior foi o evento adverso mais frequente durante o tratamento169. O tratamento com tralokinumabe foi associado a resposta precoce e sustentada, com melhora dos sintomas da DA e perfil aceitável de segurança e tolerabilidade, fornecendo, assim, evidência para o alvo da IL-13 em pacientes com DA.
Nemolizumabe
A IL-31, citocina expressa predominantemente pelos linfócitos Th2, tem como alvo os queratinócitos, as células epiteliais, os eosinófilos, os basófilos e os monócitos. A IL-31 está com a expressão aumentada em lesões da pele, e a estimulação da IL-31 acompanha-se por doença cutânea pruriginosa inflamatória em modelos murinos170.
Nemolizumabe é um anticorpo monoclonal humanizado contra o receptor A da IL-31. Em estudo fase II, randomizado, duplo-cego, controlado por placebo, de 12 semanas, 216 adultos com DA moderada a grave inadequadamente controlada por tratamentos tópicos, foram tratados com nemolizumabe em doses diferentes151. O desfecho primário foi melhora do escore na escala visual-analógica de prurido na 12ª semana. As alterações na escala visual-analógica de prurido foram entre -44% e -63%, dependendo da dose de nemolizumabe aplicada, versus -21% no grupo placebo. A mudança no escore EASI foi menor e variou entre -23,0% e -42% nos grupos nemolizumabe versus -27% no grupo placebo. Nenhum efeito adverso grave foi observado. Os efeitos colaterais mais comuns foram agravamento da DA, nasofaringite, infecções do trato respiratório superior, edema periférico e elevação da creatinofosfoquinase.
O nemolizumabe também foi avaliado por até 64 semanas em pacientes adultos com DA171. Melhora no escore da escala analógica visual de prurido e nos escores de DA foram mantidos ou aumentados das semanas 12 a 64. Nenhum outro efeito colateral foi observado neste estudo de longo prazo.
Os pacientes com DA moderada a grave inadequadamente controlada por tratamentos tópicos e tratados com nemolizumabe relataram melhora da produtividade no trabalho e nas atividades diárias. A melhoria do prurido e no distúrbio do sono com nemolizumabe poderiam justificar a redução do ônus imposto ao paciente e relacionado à diminuição de produtividade na DA172.
Fezakinumabe
A IL-22 é uma citocina de células T que atua principalmente em células epiteliais e está relacionada à hiperplasia epidérmica, apoptose de queratinócitos e inibição da produção de peptídeos antimicrobianos relevantes para a DA173. O anticorpo anti-IL-22 específico, o fezakinumabe, foi estudado em ensaio randômico, duplo-cego, controlado por placebo, como monoterapia intravenosa, a cada 2 semanas, durante 10 semanas174. Na 12ª semana, as reduções médias no escore de gravidade SCORAD não foram significativas. A análise de subgrupo de pacientes mais graves (SCORAD superior a 50) revelou quedas significativamente maiores entre os tratados com fezakinumabe em comparação ao placebo.
Estudos futuros devem confirmar se o tratamento anti-IL-22 será primariamente indicado na DA grave.
Ustekinumabe
O ustekinumabe é um antagonista da IL-12 / IL-23p40 que suprime a ativação Th1, Th17 e Th22 e foi aprovado para o tratamento da psoríase175. Algumas séries de casos mostraram efeito benéfico do ustekinumabe no tratamento de DA grave176,177. Em estudo de fase II, duplo-cego, controlado por placebo, pacientes com DA moderada a grave foram tratados com ustekinumabe ou placebo175, com subsequente mudança de esquema de tratamento na 16ª semana. O grupo ustekinumabe mostrou apenas uma tendência de melhor resposta no SCORAD em comparação ao placebo. Por outro lado, os resultados ex-vivo mostraram que o perfil molecular do transcriptoma reage com modulação genética precoce e robusta em pacientes tratados. Os resultados clínicos não significativos neste estudo podem ter sido mascarados por uso de corticosteroides tópicos e, também, a possibilidade da dose utilizada do anticorpo ser insuficiente para DA, já que foi utilizada a preconizada para psoríase. Em estudo de fase II controlado por placebo, pacientes japoneses com DA grave receberam injeções subcutâneas de ustekinumabe ou placebo nas semanas 0 e 4, e foram acompanhados até a 24ª semana. O uso de corticosteroide tópico também foi permitido neste estudo. O tratamento com ustekinumabe não foi superior ao placebo no controle da DA178. Assim, mais estudos são necessários para avaliar a aplicabilidade do ustekinumabe no tratamento da DA.
Tezepelumabe
Evidências apontam papel importante da linfopoetina do estroma tímico (TSLP) na indução e persistência da inflamação alérgica e, portanto, tem sido considerada alvo potencial para o tratamento da dermatite atópica. Estudo de fase II avaliou a eficácia e a segurança do tezepelumabe (anti-TSLP) em adultos (18 a 75 anos) com dermatite atópica moderada a grave. Os pacientes receberam 280 mg a cada duas semanas ou placebo acompanhados de corticosteroide tópicos de alta potência diariamente. O desfecho foi redução igual ou maior a 50% no escore EASI (Eczema Area and Severity Index), além de melhora do SCORAD, e do índice de prurido NRS (Numerical Rating Scales). À admissão, os pacientes foram estratificados pelo nível de IgE sérica total (abaixo de 150 ou igual ou maior a 150 kU/L). Na 12ª semana de tratamento, apesar do grupo tratado com tezepelumabe (64,7%) tivesse apresentado maior número de pacientes com EASI50 em relação ao placebo (48,2%), essa diferença não foi significativa179. Apenas o índice de prurido mostrou redução significante maior entre os tratados com tezepelumabe179.
3. Urticária crônica
A urticaria crônica é caracterizada pelo surgimento de urticas, angioedema ou ambas por um período maior que seis semanas, e pode ser classificada em espontânea ou induzida, dependendo da presença de um desencadeante físico. A presença de sintomas incômodos por períodos prolongados leva a efeito negativo importante sobre a qualidade de vida dos pacientes e, às vezes, de seus familiares. A histamina liberada de mastócitos e basófilos é reconhecida como essencial na patogênese da urticária, e, por isso, os anti-histamínicos são a primeira linha de tratamento nos quadros de urticária crônica180.
Na atualidade, o emprego de terapia anti-IgE tem se mostrado efetiva para pacientes com urticária crônica espontânea, entretanto há ainda um grupo de pacientes não responsivos e que incentiva a busca por novas opções de tratamento. Os outros alvos terapêuticos para o controle da urticária crônica em estudo incluem moléculas em mastócitos como Syk (Spleen tyrosine kinase), PIK3 (Phosphatidylinositol 3-kinase), SHIP1 (Src homology 2 containing inositol phosphatases), SIGLEC8; células B como no CD20 e BTK (Bruton tyrosine kinase); em células T como IL-1, TNF, IL-4/IL-13, CRTH2 (Chemoattractant receptor-homologous molecule expressed on TH2 cells) e eosinófilos (IL-5), muitos em fases de pesquisa clínica181.
Anticorpos anti-IgE
Omalizumabe
O omalizumabe é um anticorpo monoclonal humanizado IgG que se liga à região Fc da IgE livre, impedindo a sua ligação aos receptores de alta afinidade em mastócitos e basófilos e, consequentemente, diminuindo a expressão dos receptores de alta afinidade. Com isso, ocorre uma redução na desgranulação e liberação de histamina pelos mastócitos182.
O estudo de prova-conceito X-CUISITE demonstrou a eficácia do omalizumabe em adultos com urticária crônica espontânea (UCE) refratários aos anti-histamínicos e com autoanticorpos IgE antitireoperoxidase. As doses utilizadas foram as mesmas preconizadas para o tratamento da asma. A resposta foi considerada completa pelos investigadores em 67% dos pacientes após as 24 semanas do estudo, em comparação a 4% dos que utilizaram placebo182.
Os estudos pivotais de fase 3, ASTERIA (I e II) e GLACIAL, realizados em pacientes com UCE refratários a doses habituais ou quadruplicadas de anti-histamínicos, respectivamente, compararam diferentes dosagens de omalizumabe (75 mg, 150 mg ou 300 mg) com placebo, durante 12 ou 24 semanas183-185. A dose que demonstrou melhor eficácia para diferentes desfechos foi a de 300 mg a cada 4 semanas183,184. Nos estudos ASTERIA I e II, após 12 semanas de tratamento, 35,8% e 44% dos pacientes apresentavam escore de atividade da urticária em 7 dias (UAS7) igual a zero, enquanto que no grupo placebo apenas 8,8% e 5% estavam totalmente controlados. Efeitos adversos graves não foram relatados pelos pacientes tratados com 300 mg de omalizumabe no ASTERIA I, em 6% dos tratados com omalizumabe no ASTERIA II, e em 5% e 3% do grupo placebo respectivamente, mas em nenhum deles o efeito foi associado à droga em estudo183,184. No estudo GLACIAL, 34% dos pacientes estavam sem sintomas na semana 12, comparado a apenas 5% dos pacientes no grupo placebo. A incidência de eventos adversos entre o omalizumabe e o placebo foi semelhante, sendo dor de cabeça e infecção de vias aéreas mais frequentes nos pacientes que receberam omalizumabe185.
Estudos de vida real (incluindo dados brasileiros) em pacientes com UCE refratária aos anti-histamínicos em altas doses demonstraram que a eficácia do omalizumabe é muito superior à observada nos estudos clínicos186,187. Metanálise destes estudos mostra que 72% dos pacientes apresentam controle completo dos sintomas, e 17,8% controle parcial. Além disso, a incidência de eventos adversos foi em média de apenas 4%187. Dados relacionados ao uso prolongado por mais de um ano indicam que a eficácia se mantém neste período, sem maior incidência de eventos adversos188,189. Segurança também foi observada no uso em gestantes190. Entre os pacientes respondedores ao omalizumabe, em cerca de 70% a resposta ocorre em até 7 dias após a primeira dose (respondedores rápidos), enquanto que nos demais respondedores o tempo para controle dos sintomas pode ser de até 3 meses (respondedores tardios)191.
Estudos em pacientes com urticárias induzidas evidenciaram eficácia do omalizumabe em dermografismo, urticária ao frio e solar, com boa tolerância ao tratamento e melhora significativa e rápida na qualidade de vida. Por outro lado, não há quase nenhuma evidência que suporte o seu uso no angioedema vibratório, urticária aquagênica e urticária de contato192.
Atualmente, o omalizumabe é recomendado como 3ª linha de tratamento para os pacientes com UCE refratária aos anti-histamínicos em doses quadruplicadas, maiores de 12 anos, na dose de 300 mg a cada 4 semanas180.
Ligelizumabe
O ligelizumabe é um anticorpo monoclonal IgG1 humanizado que se liga ao domínio Cε3 da IgE193. Estudo recente de fase 2b avaliou a eficácia e segurança do ligelizumabe em pacientes com urticária moderada/grave (UAS7 > 16) em doses subcutâneas de 24, 72 e 240 mg a cada 4 semanas, comparado ao placebo e ao omalizumabe 300 mg nos mesmos intervalos. Participaram deste estudo 382 pacientes cuja resposta ao tratamento foi avaliada às 12 semanas. Neste período, 51% dos pacientes tratados com ligelizumabe apresentaram resposta completa, contra 26% dos tratados com omalizumabe, e nenhum com placebo. A melhor resposta para o ligelizumabe foi obtida com a dose de 72 mg. A droga foi bem tolerada, e o perfil de segurança semelhante ao omalizumabe194. Estudos de fase 3 estão em andamento195.
Quilizumabe
O quilizumabe é um anticorpo monoclonal humanizado que tem como alvo o segmento principal M1 (M1 prime segment ) da IgE expressa na membrana de células B e plasmablastos com switch para IgE. Em estudos clínicos em voluntários sadios e pacientes com asma e rinite, o quilizumabe reduziu os níveis de IgE total e específica, redução esta que se manteve por 6 meses após a última dose196. Na urticária, um estudo com 32 pacientes com doença refratária aos anti-histamínicos associados ou não ao montelucaste foram tratados com quilizumabe 450 mg, SC, e comparados com placebo. No entanto, ao se avaliar o escore de prurido e o UAS7 após 20 semanas, não foram observadas diferenças significativas entre os grupos tratados com quilizumabe e placebo. Os autores especulam que doses maiores ou um tratamento mais prolongado poderiam ter proporcionado uma resposta mais eficiente197.
Anti-TNF
O fator de necrose tumoral alfa (TNF-α) é expresso na pele e no soro de pacientes com urticária. Assim, espera-se que drogas anti-TNF-α possam ter algum efeito nesta doença.
Em estudo de prova de conceito, nove pacientes com UCE refratária aos anti-histamínicos foram tratados com adalimumabe por 16 semanas e avaliados quanto à atividade da doença e qualidade de vida. A dose inicial utilizada foi de 80 mg, e depois 40 mg, em semanas alternadas. Três pacientes apresentaram resposta completa, e o restante resposta parcial. Dois pacientes não apresentaram redução do UAS7, embora tenham apresentado melhora significativa dos sintomas avaliados pela escala visual analógica, e também da qualidade de vida. Não foram observados efeitos adversos significativos em nenhum dos pacientes. Apesar da resposta clínica ter sido inferior à observada nos estudos com omalizumabe, sugere-se que o adalimumabe poderia ser indicado nos casos de falha terapêutica com a anti-IgE198.
Outros sete pacientes foram tratados com diferentes anti-TNF e apresentaram boa resposta, sendo um deles com urticária de pressão tardia199,200.
4. Alergia alimentar
As alergias alimentares (AA) apresentaram notório aumento de sua prevalência nas últimas décadas. Implicam em grande impacto na qualidade de vida do paciente e sua família, potencial risco de morte e tratamento ainda não definitivo, exceto pelas dietas de restrição do alimento envolvido.
Imunoterapias (IT) orais e subcutâneas parecem promissoras vias de dessensibilização, mas até o momento são limitadas quanto à indução de tolerância sustentada ao alérgeno, e podem apresentar efeitos colaterais significativos durante sua realização.
Deste modo, uma série de tratamentos adjuvantes à IT estão sob investigação, na tentativa de diminuir os efeitos colaterais e acelerar o processo de dessensibilização e tolerância. Seus principais objetivos compreendem o direcionamento da resposta de linfócito T helper 2 (Th2) para T helper 1 (Th1) e T reguladores (Treg), e o bloqueio de produtos finais da inflamação alérgica, como IgE e mastócitos.
Medicamentos imunobiológicos encontram-se em ensaios clínicos de fase II, em sua maioria, como adjuvantes à imunoterapia oral (ITO)201.
Omalizumabe
Principal imunobiológico utilizado em alergia atualmente, o omalizumabe bloqueia o receptor de ligação da IgE no mastócito, e é liberado pelo órgão regulamentador norte-americano FDA para uso em asma e urticária crônica espontânea. No Brasil, o seu uso é aprovado para asma. Atualmente encontra-se em fase II de estudos clínicos como adjuvante à ITO com alimentos201. Estudos pilotos e ensaios randomizados com a associação do omalizumabe à ITO para amendoim, ovo, leite de vaca (LV) e múltiplos alimentos demonstraram aceleramento das fases de indução de tolerância oral, com menor número e gravidade de efeitos colaterais.
No entanto, foram descritos recentemente, três pacientes com esofagite eosinofílica (EoE) submetidos a estudo de fase II/III de ITO para amendoim associado ao omalizumabe202. Dois deles desenvolveram sintomas gastrintestinais importantes com a ITO quando o omalizumabe foi suspenso, que foram controlados apenas após a suspensão da IT. O terceiro paciente, ainda, apresentou recorrência dos sintomas um ano após ITO, mesmo sem ingestão de amendoim202. A frequência de EoE encontrada pelos autores foi significantemente maior (15%) do que a relatada pela literatura entre os pacientes submetidos à ITO para amendoim associada ao omalizumabe (2-3%). Com esses resultados, os pesquisadores levantaram a hipótese de que a frequência de efeitos adversos relatados pelos estudos anteriores poderia estar subestimada. Assim, o uso de omalizumabe poderia ocultar sintomas de EoE202.
Paralelamente, Wood e colaboradores conduziram estudo duplo-cego e controlado por placebo em 56 pacientes com alergia ao leite de vaca (ALV) mediada por IgE utilizando omalizumabe ou placebo associado a ITO203. Os autores confirmaram a redução dos efeitos colaterais e da velocidade do tempo de indução no grupo que recebeu omalizumabe; no entanto, após dois meses do término do tratamento, não encontraram diferença na manutenção de tolerância entre os dois grupos. Concluíram, então, que a combinação da ITO com o imunobiológico abrevia tempo e segurança da ITO, mas não sua eficácia203. Adicionalmente, Frischmeyer-Guerrerio e colaboradores utilizaram o mesmo grupo para avaliar a reatividade dos basófilos verificando a porcentagem de expressão de CD63 (%CD63) e compararam aos efeitos colaterais apresentados204. Os autores observaram que os pacientes com %CD63 superior a 40% se beneficiam mais do omalizumabe para diminuição de efeitos adversos do tratamento, e aqueles com maior relação %CD63 pré e pós-omalizumabe apresentaram maior tolerância em longo prazo, sugerindo um possível marcador para selecionar pacientes que se beneficiariam mais do uso do medicamento204.
Agonistas de TLR-9
Consistem em oligonucleotídeos CpG abundantes em vírus e bactérias, capazes de estimular o sistema imunológico pela ligação ao receptor TLR-9. Atualmente encontram-se em fase pré-clínica para AA, onde estão sendo avaliados para fins de prevenção e como tratamento das AA. Modelos murínos tratados com a sequência CpG associada ao alimento reagem menos quando desencadeados, e a administração concomitante do imunobiológico à ITO diminui a ocorrência de anafilaxia201.
Agonistas de TLR-4
São lipopolissacarídeos atenuados ou sintéticos capazes de se ligar a receptores TRL-4 e estimular a resposta Th1/Treg.
Na Europa e nos EUA, os estudos encontram-se em fase II/III como adjuvantes para Imunoterapia Sublingual (ITSL) e Subcutânea (ITSC) para aeroalérgenos, diminuindo o tempo de indução, com eficácia e segurança mantidas. Soos e colaboradores utilizaram lipopolissacarídeos atenuados em um modelo murino de ITO com amendoim e demonstraram diminuição nos escores de anafilaxia1. Atualmente, um estudo fase I de lipopolissacarídeos como adjuvante na ITO com amendoim encontra-se em andamento.
A esofagite eosinofílíca (EoE) é uma doença crônica do esôfago, relativamente recente, caracterizada por infiltração de eosinófilos com mais de 15 eosinófilos por grande campo de aumento. Sua relação com a AA suscita inúmeras dúvidas, bem como os medicamentos liberados para seu tratamento. Dietas de restrição e uso de corticoides tópicos são as opções terapêuticas atuais, apesar da pouca eficácia em promover o controle adequado da doença.
A fisiopatologia da esofagite eosinofílica está intimamente associada à da dermatite atópica e da asma, bem como a associação dessas doenças nos pacientes, com a presença de uma inflamação do tipo 2205.
Um estudo propôs a entrada da esofagite eosinofílica como parte da marcha alérgica dos atópicos206. Por se tratar de uma doença nova, os seus critérios diagnósticos têm mudado nos últimos anos, assim como as opções de tratamento205. Casos refratários, assim como na asma e dermatite atópica, tem suscitado a necessidade de tratamento com drogas imunobiológicas para o seu controle. De forma similar, as drogas imunobiológicas direcionadas às citocinas relacionadas ao perfil Th2 têm sido estudadas no momento.
Mepolizumabe e reslizumabe, ambos antagonistas da IL-5, foram avaliados em três estudos duplo-cegos e controlados por placebo207. Houve diminuição dos infiltrados eosinofílicos no esôfago e redução dos sintomas em dois deles. Não foi descrita, no entanto, remissão histológica nos pacientes.
As medicações que inibem a IL-5 não alcançaram melhora clínica mensurável, apesar da redução da eosinofilia. O uso do bloqueador do IL-4Rα, por outro lado, demonstrou melhora nos escores clínicos, anátomo-patológicos, endoscópicos e no número de eosinófilos esofágicos81.
O omalizumabe, anti-IgE anteriormente descrito para outras formas de AA, foi avaliado em estudos conduzidos em adultos com EoE e não demonstrou diferenças quando comparado ao placebo em relação à contagem de eosinófilos e redução de sintomas207.
O infliximabe, um inibidor do TNF-α, foi avaliado em apenas três pacientes adultos e não se acompanhou de melhora clínica ou histológica nos pacientes quando utilizado na dose de 5 mg/kg de peso corporal. É possível que doses mais altas sejam mais efetivas, mas ainda assim, o bloqueio de TNF-α de forma isolada não parece reduzir satisfatoriamente os sintomas de EoE208.
QAX57, um anti-IL13, foi avaliado em 25 adultos com EoE em estudo duplo-cego, controlado por placebo e apontou a capacidade deste imunobiológico em reduzir a média do número de eosinófilos no esôfago em 60%, mas sem melhora dos sintomas clínicos209.
Dupilumabe, bloqueador do receptor de IL-4 aprovado pelo FDA e disponível no Brasil para uso em adultos com dermatite atópica, encontra-se em fase III para EoE210. A fase II, realizada com 47 adultos com EoE (2017), evidenciou melhora significativa na disfagia, na contagem de eosinófilos esofágicos (93%), nas características endoscópicas e histológicas e na distensibilidade esofageana. Mais estudos são necessários antes da liberação para uso na prática clínica.
5. Anafilaxia
A anafilaxia é uma reação de hipersensibilidade sistêmica generalizada, grave e com risco de morte, tanto pela imprevisibilidade de sua aparência, quanto pelo potencial de gravidade de sua progressão211. É a mais grave e assustadora das doenças alérgicas, exigindo reconhecimento e manejo imediatos pelos profissionais de saúde212.
A anafilaxia mediada pela imunoglobulina E (IgE) pode ser desencadeada por vários fatores ambientais, como medicamentos, alimentos, veneno de insetos, látex e estimulação física213.
Medicamentos biológicos não são licenciados para o tratamento da anafilaxia, no entanto, nos últimos anos esta classe farmacológica, em especial o anticorpo monoclonal anti-IgE (omalizumabe) tem sido avaliado como adjuvante na prevenção da reação anafilática provocada por diversos fatores, como imunoterapia oral para alimentos, para aeroalérgenos214 e venenos de himenópteros215,216, exercícios físicos217, drogas218, e até mesmo sêmen219.
A imunoterapia oral (ITO) e a sublingual (ITSL) para ovo, leite e amendoim têm demonstrado eficácia na indução de tolerância, mas existem algumas limitações, como o alto índice de reações adversas e o longo tempo de tratamento214,220.
A possibilidade de dessensibilizar os pacientes para múltiplos alérgenos alimentares, simultaneamente e rapidamente, foi testada em ensaio de fase I da ITO em combinação com omalizumabe. Vinte e cinco crianças com múltiplas alergias alimentares (confirmadas por provocação oral) receberam ITO para até cinco alimentos alergênicos simultâneamente, com administração de omalizumabe a partir da oitava semana antes de iniciada a ITO, e mantida por 16 semanas. Os participantes alcançaram a fase de manutenção de 4 g/dose em mediana de 18 semanas, enquanto que o tempo mediano para atingir esta dose apenas com ITO foi de 85 semanas. A taxa de reação (mediana) foi de 3,2 para cada 100 doses, com 94% das reações leves. Este foi o primeiro estudo a usar a ITO em combinação com o omalizumabe para múltiplos alérgenos alimentares simultaneamente; demonstrou-se que esse método de ITO permitiu a dessensibilização de forma segura221.
Estudo duplo-cego, controlado com placebo com indivíduos randomizados para omalizumabe ou placebo submetidos a ITO para leite de vaca, aberta, foi iniciada após quatro meses de omalizumabe/placebo com aumento da manutenção para 22 a 40 semanas, seguido de manutenção diária até o 28° mês. As reações adversas foram marcadamente reduzidas durante o escalonamento da ITO em indivíduos tratados com omalizumabe para porcentagem de dose por indivíduo capaz de provocar sintomas (2,1% versus 16,1%, p = 0,0005), reações relacionadas à dose que requer tratamento (0,0% versus 3,8%, p = 0,0008), e doses necessárias para atingir a manutenção (198 versus 225, p = 0,008). Neste primeiro ensaio randômico, duplo-cego, controlado por placebo do omalizumabe em combinação com ITO alimentar, houve melhorias significativas nas medidas de segurança182.
A IT com alérgeno tem sido usada há mais de 100 anos para o tratamento de doenças alérgicas, incluindo rinite alérgica intermitente e persistente, asma alérgica e alergia aos himenópteros222. Imunoterapia subcutânea ultrarrápida para asma e rinite provocadas por aeroalérgenos também apresentam eficácia, mas reações graves podem ocorrer222.
A adição de omalizumabe à IT pode reduzir as reações agudas. Pacientes adultos com rinite alérgica a gramíneas foram envolvidos em estudo multicêntrico controlado. Os pacientes receberam por nove semanas omalizumabe (0,016 mg/kg/IgE [UI/mL]/mês) ou placebo, seguido de IT ultrarrápida de um dia (dose máxima 1,2-4,0 mg Amb a 1) ou placebo. Os pacientes que receberam omalizumabe apresentaram menor frequência de eventos adversos do que aqueles que receberam IT isolada. A análise post hoc de grupos que recebem IT demonstrou que a adição de omalizumabe resultou em diminuição de cinco vezes o risco de anafilaxia causada por IT (odds ratio, 0,17; p = 0,026). O tratamento com omalizumabe aumenta a segurança da IT para rinite alérgica às gramineas. Além disso, combinar omalizumabe e IT com alérgenos pode ser uma estratégia eficaz para permitir doses mais rápidas e mais altas, com mais segurança e maior eficácia para pacientes com doenças alérgicas223.
Stelmach e colaboradores realizaram estudo de vida real, aberto, não controlado, de manutenção com omalizumabe em crianças e adolescentes com asma grave que não toleravam a IT antes do início da antiIgE224. Todos os pacientes tiveram alergias múltiplas; os alérgenos clinicamente mais importantes foram ácaros e fungos. Durante o estudo, a IT foi iniciada em 70,6% dos pacientes: 33% pacientes após três meses, em 42% pacientes após seis meses e em 25% pacientes após nove meses de tratamento - e foi continuado com sucesso de acordo ao esquema de IT. Em cinco crianças que não tinham tolerado a IT antes do tratamento omalizumabe, a IT foi introduzida após 6 meses de tratamento e foi continuada com sucesso224.
Na IT para veneno de himenópteros, é comum durante a fase de indução a ocorrência de anafilaxia. Isto pode ser modificado adaptando-se a dose da IT para o paciente. No entanto, alguns indivíduos não toleram o tratamento, e o mesmo deve ser descontinuado. Nos últimos anos, os resultados clínicos favoráveis têm sido relatados com o uso concomitante de omalizumabe com IT para evitar reações adversas. De fato, são apenas relatos de casos, de subconjuntos de pacientes, enquanto estudos randomizados estão em falta. No entanto, há que se observar o saldo entre custos e benefícios para cada paciente individualmente214.
Em pacientes adultos com mastocitose sistêmica que receberam omalizumabe por 17 meses (mediana, variação de 1 a 73 meses), houve resolução completa dos sintomas em 38,5%, boa resposta em 23,1%, resposta parcial em 23,1%, e 2 foram excluídos por evento adverso na primeira dose. O tratamento foi mais efetivo para prevenir a anafilaxia recorrente225.
Os dados disponíveis até o momento confirmam que adicionar omalizumabe à ITO e à IT, em casos selecionados, pode ser útil. No entanto, o alto custo do omalizumabe, associado ao custo da IT é um fator limitante. Embora existam fortes argumentos para a associação de omalizumabe e IT para o tratamento de doenças alérgicas, esse deve ser limitado àqueles pacientes que estão em fase de indução, ou nos quais a dose de manutenção não pode ser tolerada, e o uso de IT permanece obrigatório. Estudos com populações maiores, seleção adequada de pacientes e estabelecimento de esquemas e tempo de tratamento são necessários.
6. Rinossinusite e polipose nasal
A rinossinusite crônica (RSC) é classicamente definida como uma condição inflamatória da mucosa nasal e dos seios paranasais, persistindo por pelo menos 12 semanas, sendo caracterizada por dois ou mais sintomas nasosinusais, obrigatoriamente obstrução nasal ou secreção nasal, podendo haver também a presença de dor ou pressão facial e redução do olfato. Complementam o diagnóstico, achados à endoscopia nasal de secreção mucopurulenta e/ou obstrução da drenagem do meato médio, ou tomografia computadorizada (TC) dos seios paranasais demonstrando alterações no complexo ostiomeatal226,227. A RSC é primariamente uma condição clínica, que guarda profundas semelhanças em termos de fisiopatologia com a asma228.
Fenotipicamente a RSC pode ser dividida em: RSC com polipose nasal (RSCcPN) e sem polipose nasal (RSCsPN)227,228 e alguns autores consideram de maior utilidade classificar em RSCcPN com eosinofilia e sem eosinofilia tecidual, RSCsPN com eosinofilia e sem eosinofilia tecidual229.
O conhecimento das vias de inflamação envolvidas na RSC é ponto importante para facilitar a escolha de biológicos: Th1, Th2 e Th17. Estas vias podem ser dominantes ou mistas, resultando em inflamação primariamente eosinofílica ou não eosinofílica. A inflamação direcionada por mecanismos Th1 geralmente associa-se à RSCsPN, caracterizada predominantemente pelo aumento de neutrófilos e níveis elevados de interferon-gama, IL-2 e TNF-α. A inflamação mediada por mecanismo Th2 associa-se à RSCcPN em pacientes caucasianos e primariamente caracteriza-se pelo aumento de eosinófilos e níveis elevados de IL-4, IL-5, IL-10, IL-13 e da proteína catiônica eosinofílica. A IgE, associada à hipersensibilidade alérgica, está tipicamente elevada em pacientes com RSCcPN, havendo também a descrição de sua produção local nos pólipos. Células linfoides inatas tipo 2 (ILC2) e provavelmente mastócitos também contribuem para a produção de IL-5 e IL-13. A via do Th17 foi descrita como dominante em pacientes asiáticos com RSCcPN, associandose com aumento da expressão de IL-6, IL-17, IL-22e TNF-α230-234.
Desse modo, os dois fenótipos principais de RSC, com e sem polipose nasal, são entendidos atualmente como heterogêneos tanto pelos mecanismos subjacentes, como de população avaliada e de localização geográfica. Assim, fica claro que determinar o fenótipo/endotipo de RSC impacta diretamente nas decisões terapêuticas, tanto em termos de antibioticoterapia, resposta ao uso de corticoesteroides (subgrupo resistente), necessidade ou não de intervenção cirúrgica e indicação de imunobiológicos (anti-IgE, anti-IL5, anti-IL4/13)235.
Não há biomarcador até o momento que auxilie na seleção do paciente ideal, que seja preditivo de boa resposta a um medicamento específico ou que monitore o sucesso do tratamento236. Além disso, não existem terapias biológicas sob investigação para RSC não eosinofílica, ou para RSC com inflamação mediada por Th1 ou Th17. Os biológicos em testes clínicos para RSC estão focados nos pacientes com polipose nasal sobretudo por sua superposição com a fisiopatologia da asma236.
Terapia anti-IgE
Embora utilizada há mais de 10 anos para o tratamento da asma, poucos estudos tratam especificamente do seu uso em pacientes com RSCcPN. Estudo duplo-cego, randômico, placebo-controlado com omalizumabe na RSC demonstrou resultados contraditórios, com diferenças pouco significativas entre o grupo tratado e o placebo, possivelmente pelo número limitado de pacientes e o curto período de seguimento237.
Estudo de pacientes com RSC e asma associada mostrou redução significativa no escore endoscópico para polipose nasal após 16 semanas entre os tratados com omalizumabe, melhora nos escores de qualidade de vida e efeito benéfico sobre a obstrução nasal, rinorreia anterior, perda do olfato, sibilância e dispneia, independente da presença ou não de sensibilização alérgica. Concluiu-se que o omalizumabe demonstrou eficácia clínica no tratamento da polipose nasal com comorbidade asma238.
Estudo de vida real publicado recentemente demonstrou que o tratamento com omalizumabe para asma grave também melhorou a RSCcPN coexistente239. Segundo os autores, a melhora dos sintomas sinusais ocorreu paralelamente à melhora da asma, tanto em pacientes alérgicos como não alérgicos (testes cutâneos positivos para aeroalérgenos e níveis de IgE específica sérica), destacando que a produção local de IgE pode ser um importante direcionador na fisiopatologia da asma e da RSCcPN não alérgica239.
Atualmente, há no ClinicalTrials.gov estudos com o omalizumabe na RSC ainda não divulgados240-243.
Terapia anti-IL-5
A IL-5 é essencial para a sobrevivência, recrutamento, crescimento e ativação eosinofílica244. Três anticorpos monoclonais que têm como alvo a IL-5 estão disponíveis no mercado para tratamento de asma, e estão sob avaliação para utilização na RSC. São eles o reslizumabe, o mepolizumabe e o benralizumabe.
Reslizumabe
O reslizumabe foi utilizado pela primeira vez para tratamento de polipose nasal em estudo conceitual em que ficou demonstrado que uma única dose da medicação administrada por via venosa reduziu o tamanho do pólipo nasal em metade dos pacientes avaliados, e o nível nasal elevado de IL-5 (> 40 pg/mL) foi preditivo de uma boa resposta ao tratamento anti-IL-5245.
Estudo recente sobre os efeitos do reslizumabe em pacientes com asma eosinofílica e autorrelato de RSCcPN sugere ser este biológico altamente eficaz para os sintomas relacionados à asma, tanto em pacientes com RSCcPN, como em pacientes que autorrelataram sensibilidade à aspirina246.
Mepolizumabe
Estudo retrospectivo em pacientes com doença respiratória exacerbada pela aspirina (DREA) demonstrou que o tratamento com três ou mais doses de mepolizumabe 100 mg SC a cada 4 semanas diminuiu a contagem absoluta de eosinófilos e significativamente melhorou os sintomas tanto de vias aéreas superiores como de vias aéreas inferiores247. Neste estudo, o mepolizumabe especificamente melhorou a obstrução nasal e o olfato, importantes medidas de qualidade de vida. O escore geral do SNOT-22 melhorou 17 pontos247, enquanto que outros relataram melhora de 13,2 pontos em estudo sobre mepolizumabe na polipose nasal grave248, indicando que indivíduos com DREA parecem responder melhor ao mepolizumabe do que indivíduos com RSCcPN sem intolerância à aspirina.
Relato de caso de um paciente com DREA e espasmo coronariano descreve a rápida resposta à dose padrão de mepolizumabe 100 mg SC, reforçando a ideia de que o pólipo nasal associado à DREA pode representar um endótipo distinto de RSCcPN, altamente responsivo ao tratamento anti-IL5249.
Benralizumabe
Dois estudos randomizados, duplo-cegos, placebo-controlados de fase III: SIROCCO106 e CALIMA105 avaliaram a eficácia e segurança do benralizumabe em pacientes de 12 a 75 anos com asma eosinofílica grave. Em uma análise mais ampla, observou-se que aproximadamente 20% dos pacientes no estudo SIROCCO (n = 1.204) e 15% no estudo CALIMA (n = 1.306) apresentavam polipose nasal. A avaliação conjunta de ambos os estudos demonstrou que a presença de polipose nasal foi identificada como um preditor de melhor eficácia do benralizumabe em pacientes com asma grave, independente da contagem basal de eosinófilos séricos250. Entretanto, o efeito do benralizumabe sobre a polipose nasal não foi contemplado nestes estudos.
Atualmente há dois estudos clínicos em andamento com o uso de benralizumabe em pacientes com polipose nasal e com dados não publicados251,252.
É importante destacar que a redução das contagens de eosinófilos no sangue ocorre dentro de 2 a 3 dias após a primeira aplicação de qualquer uma das medicações anti-IL-5, confirmando o efeito biológico precoce sobre a IL-5253-255. Entretanto, novos estudos são necessários para confirmar se este efeito precoce sobre os eosinófilos séricos pode ser usado como preditor clínico de resposta à terapia anti-IL-5, tanto na asma, como na RSC.
Terapia anti-IL4/IL-13
Dupilumabe
Aprovado pelo FDA para uso em pacientes com dermatite atópica, e na RSCcPN256. Outras medicações que bloqueiam IL-5 ou o receptor de IL-5 continuam em andamento.
Bachert e colaboradores avaliaram o tratamento com dupilumabe em pacientes com RSCcPN e asma refratários ao tratamento com corticosteroide tópico nasal257. Apesar da amostra reduzida, a magnitude da resposta ao dupilumabe foi significativa e duradoura (redução do tamanho do pólipo, melhora do fluxo inspiratório nasal, redução do escore de sintomas nasais -SNOT-22, melhora da olfação e da função pulmonar nos com asma associada). Concluíram que o dupilumabe é opção de tratamento para pacientes com RSCcPN refratária à terapia com corticosteroide tópico nasal, entretanto, são necessários dados sobre eficácia de longo prazo e segurança. Análise posterior dos mesmos pacientes reforçou os achados anteriores258.
A avaliação dos efeitos locais do dupilumabe sobre os biomarcadores da inflamção tipo 2 revelam diminuição acentuada das concentrações de eotaxina e IgE na secreção nasal, assim como as de proteína catiônica eosinofílica, eotaxinas 2 e 3, IgE e IL-13 no tecido dos pólipos nasais, demonstrando que o antagonismo do IL-4Rα suprime os processos dependentes de IL-4/IL-13259.
Terapia anti-IL-33
Linfopoetina estromal tímica (TSLP), a IL-33 e a IL-25 são um grupo de citocinas derivadas primariamente do epitélio que estimulam a resposta Th2 nas mucosas. Alguns autores têm demonstrado que o feedback positivo entre TSLP, IL-33 e seus receptores e as citocinas Th2 pode facilitar a inflamação Th2 na RSCcPN eosinofílica260.
ClinicalTrials.gov registra um estudo de fase II iniciado em agosto de 2018 e com previsão de encerramento em dezembro de 2019, para a segurança e eficácia de múltiplas doses de etokimabe em adultos (18 a 65 anos) com RSCcPN. O etokimabe, previamente conhecido como ANB020, é um anticorpo que inibe a atividade da IL-33261.
Os imunobiológicos, apesar de promissores no tratamento das RSC, não são isentos de efeitos colaterais. Por isso, a grande maioria dos estudos em andamento tem seu foco não só em confirmar a eficácia, mas também a segurança do seu uso em longo prazo na RSC.
7. Imunodeficiências primárias ou Erros inatos da imunidade
Os erros inatos da imunidade (EII), nova nomenclatura proposta para as imunodeficiências primárias, compreendem diversos defeitos genéticos que afetam a imunidade inata e/ou adaptativa, resultando em aumento da susceptibilidade a infecções, processos inflamatórios, manifestações alérgicas e de autoimunidade e/ou neoplasias. São listadas cerca de 350 patologias causadas por mutações em diferentes genes262. O melhor entendimento acerca da fisiopatologia de cada uma dessas doenças trouxe muitas oportunidades para o tratamento personalizado, utilizando-se diferentes citocinas, anticorpos monoclonais, proteínas de fusão e moléculas bloqueadoras específicas para o controle das diversas manifestações desse grupo tão heterogêneo de patologias. Entretanto, muitos desses usos não constam nas bulas dos medicamentos, pela ausência de estudos de eficácia e segurança.
Citocinas
IFN-α, citocina de efeito antiviral comumente utilizada em hepatites C e B e infecções pelo papiloma vírus humano, tem sido usada em alguns EII. Uso bem-sucedido foi relatado em verrugas e molusco contagioso intratáveis, disseminados e/ou gigantes em pacientes com síndrome de hiper IgE por mutação de DOCK8 e linfopenia CD4263-265. Efeito benéfico também tem sido relatado em pacientes com encefalite recorrente por herpes simples e defeitos da via do Toll-like Receptor 3 (TLR3)266.
O IFN-γ está indicado em pacientes com doença granulomatosa crônica (DGC), sendo capaz de reduzir a frequência de infecções em até 70%267. Está liberado pelo FDA para uso contínuo, no entanto, em nosso meio, seu uso é possível somente via importação, o que dificulta sobremaneira sua inclusão no tratamento rotineiro desses pacientes. Essa substância tem sido usada também no controle de infecções graves e/ou de difícil tratamento por micobactérias, em pacientes com defeitos do eixo IFN-γ/IL-12 e com imunodeficiência combinada grave (SCID)268-270.
A IL-2 é citocina com ação estimulatória de células T e NK. Em pacientes com síndrome de Wiskott-Aldrich, o uso de IL-2 em baixas doses tem se mostrado eficaz no aumento de linfócitos, plaquetas e células Treg271. Doses baixas também têm se mostrado úteis no controle de quadros infecciosos, contagem e função de células T e NK em pacientes com imunodeficiência comum variável272, linfopenia CD4273 e deficiência de NEMO274.
Muitos EII cursam com desregulação imunológica e se apresentam com manifestações autoimunes e/ou linfoproliferação não maligna. Algumas dessas doenças já estão muito bem caracterizadas e medicamentos inicialmente desenvolvidos para o controle de doenças reumatológicas e neoplásicas são úteis no seu tratamento, ainda que muitas vezes o uso seja off label 262.
Como exemplos citamos a doença intersticial pulmonar granulomatosa linfocítica (GLILD), uma complicação da imunodeficiência comum variável275; as citopenias autoimunes refratárias que se apresentam em muitos EII; doença inflamatória intestinal e linfoproliferação induzida pelo vírus de Epstein-Barr276-277. Esses quadros podem demandar o uso de biológicos para seu controle, em especial o anti-CD20, o rituximabe, que é utilizado isoladamente ou em associação com outras drogas supressoras de células T275.
Um subgrupo de doenças autoinflamatórias de herança monogênica é caracterizado pela ativação excessiva do inflamassomo, que, em sua via final está associado ao aumento na expressão de IL-1. Para o controle dessas doenças, o bloqueio da IL-1 é fundamental. Existem três bloqueadores dessa citocina: anakinra, canaquinumabe e rilonacepte. Enquanto os dois últimos são respectivamente um anticorpo monoclonal anti-IL-1β e uma proteína de fusão Fc-IgG com dois receptores extracelulares de IL-1, o anakinra nada mais é do que uma proteína de fusão ligada ao antagonista do receptor de IL-1 recombinante. Atualmente, esses medicamentos são aprovados para o tratamento das síndromes autoinflamatórias clássicas, como criopirinopatias, deficiência da mevalonato-quinase, febre familiar do Mediterrâneo, síndrome de Majeed, deficiência do antagonista do receptor de IL-1 (DIRA), artrite piogênica com acne pustulosa (PAPA) e síndrome periódica associada ao receptor de TNF (TRAPS)278.
Inibidores do TNF-α (etanercepte, infliximabe, adalimimabe, certolizumabe e golimumabe) também podem ser utilizados em doença inflamatória intestinal associada a alguns EII e em muitas doenças autoinflamatórias, relacionadas ou não ao inflamassomo, tais como febre familiar do Mediterrâneo, deficiência de mevaloto-quinase, PAPA, autoinflamação associada a pirina com dermatose neutrofílica (PAAND), síndrome de Blau e deficiência do antagonista do receptor de IL-36 (DITRA)279.
Na haploinsuficiência de CTLA-4 (cytotoxic T-lymphocyte-associated protein 4 -uma molécula co-estimulatória essencial na regulação negativa da ativação linfocitária durante a apresentação antigênica) existe uma ativação linfocitária excessiva que gera imunodesregulação com diversas manifestações autoimunes, assim como linfoproliferação não maligna10. O abatacepte e o alefacepte são proteínas de fusão que consistem na fração Fc de IgG ligada a uma molécula de CTLA-4, visando a ligação ao CD80/CD86 presente na célula apresentadora de antígenos, e dessa maneira impedindo a ativação do linfócito T. Recentemente, o abatacepte foi usado no tratamento da haploinsuficiência de CTLA-4 e da deficiência de LRBA (lipopolysaccharide-responsive and beige-like anchor protein), outro EII em que há redução da expressão de CTLA-4280.
O ganho de função de STAT3 é outra doença caracterizada por desregulação imunológica, descrita recentemente e também associada à linfoproliferação e autoimunidade. A IL-6 aumenta a fosforilação de STAT3, e assim, foi reconhecida como alvo para o tratamento. O uso de tocilizumabe, um bloqueador do receptor de IL-6, promove melhora clínica de diversas manifestações associadas a esse defeito281. Mais recentemente, a adição de inibidores de JAK ao tratamento com tocilizumabe mostrou redução ainda maior na sintomatologia282.
Ustekinumabe, um anticorpo monoclonal que bloqueia a porção p40 da IL-12 e da IL-23, mostrouse útil no tratamento de grave doença periodontal e ferida cutânea em paciente com defeito de adesão leucocitária I (LAD I)283.
Terapia de reposição com Imunoglobulinas policlonais
A terapia de reposição com imunoglobulinas policlonais é a modalidade mais frequente e mais importante de tratamento dos EII que cursam com defeitos na produção de anticorpos e que constituem cerca de 70 a 80% dos casos de imunodeficiências primárias: defeitos predominantemente de anticorpos, defeitos combinados de células T e B e síndromes associadas a imunodeficiências combinadas284.
As imunoglobulinas policlonais são obtidas do plasma de doadores, após extração bioquímica, fracionamento, purificação e estabilização. O produto final desejado deve conter primariamente IgG purificada e policlonal, com subclasses presentes em proporção similar às do plasma humano normal. Deve ser livre de IgA ou IgM contaminantes, ou fatores da coagulação285.
Com relação à estabilização, deve ser composta de IgG monomérica e livre de agregados. Inicialmente, utilizavam-se sais e açúcares (sacarose) para esta estabilização. Nas apresentações mais modernas, são usados aminoácidos, como glicina ou prolina. É essa uma significativa vantagem para pacientes cardiopatas, nefropatas, hipertensos, diabéticos e para crianças prematuras286.
A terapia de reposição de imunoglobulinas é indicada para todos os EII que cursam com defeito na produção de anticorpos e em doses maiores, visando imunomodulacão, está indicada para algumas manifestações autoimunes associadas a essas doenças284,285.
A dose habitual para reposição é de 400 a 600 mg/kg/mês para a apresentação intravenosa, ou 100 a 150 mg/kg/semana para a apresentação subcutânea. Doses mais elevadas podem ser necessárias, particularmente nos pacientes com doença pulmonar crônica, perdas ou com aumento da metabolização de imunoglobulinas285.
Doses mais elevadas, entre 1 a 2 g/kg de peso, são utilizadas para imunomodulação em manifestações autoimunes, principalmente em citopenias autoimunes que ocorrem em muitos dos EII285,286.
Os efeitos adversos mais frequentes são cefaleia, mal-estar geral, náuseas, tremor, febre, dor torácica e alterações da coagulação, particularmente com a administração intravenosa, e diretamente relacionados com a dose e a velocidade de administração. Na apresentação subcutânea, os efeitos adversos sistêmicos são bem menos frequentes. Mais comumente, o uso SC está associado à uma irritação local, que diminui com a continuidade do tratamento285,286.
É necessário monitorar hemograma, função hepática, função renal e eletroforese de proteínas antes de iniciar o tratamento e depois, ao longo do tratamento, a cada seis meses ou de acordo com a evolução clínica do paciente285,286.
Assim como outros imunobiológicos, as imunoglobulinas policlonais são produtos únicos, não genéricos, intercambiáveis somente mediante exceções ou efeitos adversos, e não como rotina. Deve-se, portanto, evitar a troca frequente de produtos.
Estão disponíveis em apresentações a 5 ou 10% para infusão intravenosa, e a 10 ou 20% para infusão subcutânea. Há também uma apresentação de imunoglobulina a 10% conjugada com hialuronidase para infusão subcutânea285,286.
A apresentação e a via de administração escolhidas determinam diferentes perfis farmacocinéticos para absorção de imunoglobulinas. A absorção imediata e os altos níveis alcançados rapidamente por meio da infusão intravenosa são particularmente úteis para o controle de manifestações autoimunes associadas às imunodeficiências285,286. A aplicação subcutânea regular é vantajosa para manutenção de níveis sanguíneos constantes e melhor controle das infecções. A infusão subcutânea conjugada com hialuronisade representa um padrão farmacocinético intermediário entre a intravenosa e a subcutânea regular287-290.
Graças a um esforço em educação continuada sobre diagnóstico e tratamento das imunodeficiências primárias para médicos brasileiros, o consumo de imunoglobulinas aumentou nos últimos 3 anos, por conta de um aumento da taxa diagnóstica superior a 100%291.
A experiência nos últimos anos demonstra que os pacientes com EII devem ser tratados em centros específicos, evitando-se centros de infusão de oncologia e centros de infusão genéricos, onde efeitos adversos e erros na administração são frequentes, tanto em âmbito público quanto privado.
8. Angioedema hereditário
O angioedema hereditário (AEH) é uma condição genética autossômica dominante, caracterizada pelo aparecimento de edemas recorrentes acometendo a derme e o tecido subcutâneo ou submucosas, principalmente dos tratos respiratório superior e digestório292. O edema é causado pelo excesso de produção de bradicinina, com sintomas intermitentes, podendo haver fatores desencadeantes tais como trauma ou estresse, ou sem desencadeante conhecido.
Existem dois tipos principais: com deficiência da proteína sérica inibidora da C1 esterase (AEH C1-INH), ou sem alteração dessa proteína, denominado angioedema hereditário com C1-INH normal (AEH C1-INHn). No AEH C1-INH são identificados dois subtipos: com deficiência quantitativa do C1-INH (tipo I) e com deficiência funcional (tipo II)278. No AEH C1-INHn a alteração genética não está determinada em todos os casos, porém existem alterações identificadas em três genes: fator XII, plasminogênio e angiopoietina-1. Portanto, atualmente o AEH C1-INHn se subdivide em quatro categorias: AEH-FXII, AEH-PLG, AEH-ANGPT1 e o AEH-UNK (sem mutação conhecida)293.
Existem mais de 450 mutações descritas no gene SERPING1 do C1-INH e, dessa forma, o quadro clínico é variável294. O C1-INH é o principal inibidor de várias proteases do complemento (C1r, C1s e MASP 1 e 2), de proteases do sistema de contato (calicreína plasmática e fator XIIa) assim como, em menor intensidade, inibidor do sistema fibrinolítico320. Portanto, a deficiência do C1-INH resulta em maior formação de bradicinina. Esse mediador é gerado a partir da ativação do fator XII que forma a calicreína após ação na pré-calicreína que cliva o cininogênio de alto peso molecular e gera a bradicinina, que aumenta a permeabilidade vascular e resulta na formação do angioedema. A fisiopatologia do AEH C1-INHn não se encontra totalmente definida, mas provavelmente envolve a maior formação de bradicinina293.
O tratamento do AEH é dividido em três modalidades: profilaxia de longo prazo, tratamento das crises e profilaxia de curto prazo usado antes de procedimentos dentários, cirúrgicos ou diagnósticos associados com desencadeamento de crises321. Existem apenas estudos clínicos randomizados para o tratamento do AEH C1-INH e, portanto, todas as indicações de tratamento no AEH se referem apenas a esse tipo de angioedema hereditário.
Baseados no conhecimento da fisiopatologia do AEH, diversas terapias biológicas foram desenvolvidas, sendo que algumas já foram aprovadas pelas agências regulatórias, e outras se encontram em fase de estudo297. Os únicos medicamentos biológicos aprovados para o tratamento do AEH no Brasil são o icatibanto (Firazyr®) e o concentrado de C1-INH derivado do plasma (Berinert®), ambos aprovados para uso nas crises agudas de edema298. Outros biológicos aprovados em outros países são: concentrado C1-INH de uso intravenoso (Cinryze®), concentrado C1-INH subcutâneo (HAEGARDA®), concentrado de C1-INH recombinante (Ruconest®), ecallantide (Kalbitor®) e o anticorpo monoclonal anticalicreína (Lanadelumabe, Takhzyro®)296,299,300.
Icatibanto
O icatibanto é um peptídeo sintético antagonista específico e seletivo dos receptores B2 da bradicinina e inibe a vasodilatação induzida por esse mediador. Deve ser utilizado por via subcutânea para tratamentos da crise de AEH C1-INH. A eficácia e segurança do icatibanto foram demonstradas em três estudos duplo-cegos, randomizados e multicêntricos em comparação com placebo ou ácido tranexâmico. Foram avaliados a redução na gravidade dos sintomas, tempo de início da melhora dos sintomas e resolução completa dos sintomas301-303. A administração precoce do icatibanto, de preferência nas primeiras seis horas após início dos sintomas, resultou em melhor eficácia304. O icatibanto é seguro, efetivo e bem tolerado em crianças a partir dos dois anos de idade305.
O icatibanto é apresentado em seringas preenchidas de 3 mL contendo 30 mg, que deve ser administrado por via subcutânea lenta, de preferência na região abdominal, em caso de crise de edema326-328. Embora na maioria das vezes uma ampola seja suficiente, essa dose pode ser repetida após seis horas na ausência de melhora, e pode-se usar até três ampolas em 24 horas. Inicialmente era usado apenas em adultos, mas recentemente o icatibanto foi aprovado no Brasil para uso em crianças e adolescentes, sendo que a dose recomendada é baseada no peso corporal (10 mg para 12 a 25 kg; 15 mg, de 26 a 40 kg;20 mg de 41 a 50 kg;25 mg de 51 a 65 kg e 30 mg acima de 65 kg)305. A segurança e eficácia não foram estabelecidas em crianças abaixo de dois anos de idade ou com peso inferior a 12 kg. O icatibanto é licenciado para autoadministração, e a via subcutânea facilita o tratamento prevenindo problemas de acesso venoso, particularmente na população pediátrica296. De modo geral, se trata de medicação segura, sendo que as reações adversas mais comuns são dor no local da administração e eritema local que geralmente desaparecem em poucas horas, sem necessidade de tratamento. O icatibanto é contraindicado em eventos isquêmicos agudos para evitar inibição dos efeitos vasodilatadores da bradicinina301-303.
C1-INH derivado do plasma
Os concentrados do C1-INH derivados do plasma (pdC1-INH) para uso intravenoso são eficazes e seguros no tratamento das crises do AEH C1-INH, assim como podem ser usados na profilaxia de longo prazo e na profilaxia de curto prazo antes de procedimentos com risco de desencadear crises de edema5. Atuam nos mesmos alvos do C1-INH endógeno, e, dessa forma, regulam os sistemas de proteases que produzem bradicinina. Uma unidade de pdC1-INH corresponde a quantidade média da proteína C1-INH presente em 1 mL de plasma fresco normal.
Os preparados de pdC1-INH são obtidos pela separação do C1-INH do plasma humano criodepletado por adsorção e precipitação, purificação, pasteurização e filtração de vírus296. Existem dois preparados de pdC1-INH para administração intravenosa e utilizados nas crises de edema ou na profilaxia de longo prazo: Berinert® (CSL Behring) e Cinryze® (Takeda - Shire). Apenas o Berinert® é aprovado para uso no Brasil298. Os concentrados de pdC1-INH são seguros e bem tolerados, com poucos efeitos adversos, risco mínimo de reação alérgica e sem documentação da transmissão de agentes infecciosos306-309. Eventos tromboembólicos associados a pdC1-INH ocorreram apenas em pacientes com cateteres venosos centrais. Ambos concentrados são disponibilizados na forma liofilizada com 500 U por frasco e, após reconstituição com diluente próprio, podem ser administrados por via intravenosa, sendo aprovados para autoadministração domiciliar. O Berinert® deve ser usado na dose de 20 U/kg nas crises de edema em quaisquer localizações ou na profilaxia de curto prazo. Em média, o início de alívio dos sintomas nos principais estudos foi de 0,46 horas, e a resolução completa em 15,5 horas308. O Cinryze® é aprovado para autoadministração domiciliar na profilaxia de longo prazo e tratamento das crises na Europa, e apenas para profilaxia de longo prazo nos Estados Unidos298. A dose utilizada nas crises é 1.000 U, e na profilaxia de longo prazo essa dose é administrada duas vezes por semana296. Ambos preparados de pdC1-INH devem ser administrados precocemente nas crises para melhor eficácia, e, dessa forma, o paciente deve ser orientado para fazer a autoadministração no início da crise310. Na profilaxia de curto prazo ambos preparados podem ser administrados entre uma e seis horas antes do procedimento, além de serem aprovados para uso em crianças e gestantes296,298.
Além da via intravenosa, estudos recentes com preparado de pdC1-INH por via subcutânea nas doses de 40 ou 60 U/kg foi eficaz quando administrado duas vezes por semana na profilaxia de longo prazo, prevenindo o aparecimento de crises299. A dose maior resultou em redução das crises de 95%, quando comparado ao placebo, e com uma diminuição de 100% do uso de medicação de resgate. Os efeitos adversos são na maioria leves, predominando nos locais de administração subcutânea, além de tontura e sintomas nasais. Portanto, foi aprovado pelo FDA na dose de 60 U/kg para adolescentes e adultos para autoadministração, duas vezes por semana, por via subcutânea (HAEGARDA®, CSL Behring), sendo disponibilizado na forma liofilizada em apresentações de 2.000 U, ou 3.000 U em cada frasco, de forma que após a reconstituição haja a concentração de 500 U/mL. O uso da via subcutânea, além de ser mais conveniente para administração que a via intravenosa, mantém concentrações plasmáticas mais estáveis de C1-INH311. Esse produto ainda não está aprovado para uso no Brasil.
C1-INH recombinante humano
Devido à necessidade de um produto que não dependesse da disponibilidade de plasma humano para sua obtenção, foi desenvolvido o concentrado de C1-INH recombinante humano (rhC1-INH) (Ruconest®, Pharming), obtido do leite de coelhas transgênicas, e não deve ser utilizado em pacientes alérgicos a coelhos298. Não se detectou a formação de anticorpos IgE anticoelho em pacientes tratados com rhC1-INH297. O modo de ação é idêntico ao pdC1-INH, entretanto com meia-vida mais curta. Inicialmente foi indicado apenas para o tratamento das crises, quando se demonstrou ser eficaz e seguro, sem a ocorrência de eventos trombóticos com perfil de reações adversas similar às do placebo312,313. Embora aprovado na Europa e nos Estados Unidos, o Ruconest® não é aprovado no Brasil. A dose utilizada é de uma injeção intravenosa de 50 U/kg em adultos e adolescentes com peso inferior a 84 kg, e 4.200 U (dois frascos) nos indivíduos com peso superior, sendo liberado para autoadministração313. O medicamento é apresentado na forma liofilizada (2.100 U por frasco), e deve ser diluído para formar uma solução de 150 U/mL. Estudos com placebo mostraram que o Ruconest® também é efetivo na prevenção das crises quando administrado uma a duas vezes por semana por via intravenosa314,315. Não houve aumento de eventos adversos com a administração de doses adicionais do rhC1-INH utilizadas para tratar crise nos pacientes em uso para profilaxia de longo prazo, com doses repetidas nas crises ou nos casos de doses mais altas (100 U/kg)316. Existem relatos da eficácia do Ruconest® na profilaxia em curto prazo, assim como da segurança na gravidez297.
Ecallantide
Ecallantide (Kalbitor®, Takeda-Shire) é uma proteína recombinante com inibição potente e seletiva da calicreína plasmática que resulta em menor produção de bradicinina, com melhora dos sintomas297. Foi aprovado para utilização nas crises de edema em pacientes a partir dos 12 anos de idade, apenas nos Estados Unidos. Foram realizados dois ensaios clínicos de fase III, controlados com placebo, que demonstraram a eficácia desse biológico317,318. A dose recomendada é de 30 mg (3 mL), administrada por via subcutânea em três injeções de 10 mg (1 mL) e caso os sintomas persistam, nova dose de 30 mg pode ser administrada num período de 24h. O medicamento não foi aprovado para autoadministração domiciliar devido a ocorrência de anafilaxia. Essas reações de hipersensibilidade ocorreram em até 10,8% dos casos, sendo que em 4,4% os sintomas iniciaram em 1 hora da administração do ecallantide.
Anticorpo monoclonal anti-calicreína
Lanadelumabe (Takhzyro®, Takeda - Shire) é um anticorpo monoclonal totalmente humanizado que se liga e inibe a calicreína plasmática, e dessa forma previne a clivagem do cininogênio de alto peso molecular e a formação de bradicinina300. Não ocorre inibição do sistema de cinina-calicreína tissular que mantém níveis de bradicinina para importantes papéis fisiológicos e na função cardiovascular. Foi aprovado em agosto de 2018 nos Estados Unidos, não sendo disponível no Brasil. É indicado para a profilaxia de longo prazo, na dose de 300 mg por via subcutânea a cada duas semanas em pacientes com AEH C1-INH, a partir dos 12 anos de idade. Em pacientes estáveis, sem crises, essa mesma dose poderá ser administrada a cada quatro semanas, particularmente em indivíduos com menos peso297. O lanadelumabe, além de ser eficaz na redução do número de crises, apresenta um bom perfil de segurança. A maioria dos eventos adversos relatados são no sítio de injeção, e consistem de dor local, assim como a ocorrência de tontura300.
O uso de medicamentos biológicos no AEH C1-INH foi um grande avanço na terapêutica dos pacientes acometidos. A maioria deles apresenta um bom perfil de segurança e são eficazes. Embora existam apenas dois desses medicamentos aprovados para uso no Brasil para o tratamento da crise, a utilização de outros biológicos nos Estados Unidos e Europa indicam que em breve os outros medicamentos devem ser aprovados no nosso meio. A possibilidade de autoadmistração dos biológicos nos pacientes possibilita uma maior rapidez do tratamento e, consequentemente, melhor eficácia na terapêutica das crises de edema. Além disso, o uso de biológicos na profilaxia em longo prazo também por via subcutânea (além da via intravenosa) representa um ganho na qualidade de vida desses pacientes, particularmente quando administrados a cada duas semanas.
V - Biológicos em desenvolvimento
As doenças alérgicas, incluindo asma e dermatite atópica (DA), são doenças de ocorrência frequente e distribuição mundial. Embora vários tratamentos estejam disponíveis, muitos pacientes permanecem com sintomas não controlados, e fica evidente a apresentação heterogênea destas doenças80. Quanto mais sabemos sobre os mecanismos fisiopatológicos das doenças alérgicas, mais claro nos fica que características clínicas semelhantes podem ser decorrentes de diferentes agentes desencadeantes.
A tecnologia possibilitou o conhecimento de mecanismos moleculares subjacentes às doenças alérgicas, o que contribuiu para o descobrimento e melhor definição de alvos terapêuticos. Desse modo, pode-se modificar o curso natural das doenças alérgicas, em vez de simplesmente controlar os sintomas.
Os imunobiológicos representam um campo ativo em pesquisas e desenvolvimento de medicações para doenças imunológicas. A melhor caracterização clínica, molecular e genética das doenças alérgicas (biomarcadores, fenótipos, endotipos) vem possibilitando a expansão do campo de pesquisa em tratamentos biológicos319.
Como exemplo, a alergia alimentar: embora sua prevalência tenha aumentado significativamente nos últimos anos, não há tratamentos aprovados além de se evitar a exposição ao alimento envolvido e tratar as reações de exposições acidentais. O objetivo do tratamento com imunoterapia oral e sublingual com alérgenos alimentares é induzir a dessensibilização e promover tolerância imunológica permanente ao alérgeno. Enquanto a eficácia da imunoterapia tem sido ativamente estudada, as grandes taxas de reações adversas, o tempo de tratamento prolongado e a perda da tolerância ao fim do tratamento são limitações importantes e, portanto, há necessidade de novas alternativas ou tratamentos adjuvantes para aumentar segurança e eficácia320. Alguns biológicos podem ter efeito adjuvante neste tratamento, melhorando a tolerância, diminuindo a sensibilidade ao alérgeno e a gravidade das reações. Os potenciais biológicos com estes efeitos estão dispostos na Tabela 2.
A indústria farmacêutica sempre focou no desenvolvimento de biológicos para o tratamento de doenças como psoríase, no entanto, as alergias de pele têm necessitado de novos tratamentos e, consequentemente, biológicos têm sido estudados com esse fim322. A dermatite atópica é a doença crônica de pele inflamatória mais comum, podendo afetar até 10% das crianças, e 3% dos adultos. O tratamento da dermatite atópica depende da gravidade, e diferentes endotipos respondem de maneira distinta aos tratamentos existentes. Biológicos com diferentes mecanismos de ação estão sendo estudados, conforme disposto na Tabela 3.
Dupilumabe é a única medicação biológica aprovada para rinossinusite crônica com pólipos nasais, mas terapias anti-IgE, anti-IL-5 têm sido estudadas (vide ítem 6).
Em relação às doenças respiratórias, a asma é a doença respiratória crônica mais comum entre as crianças, e afeta 358 milhões de pessoas no mundo319. A doença pulmonar obstrutiva crônica (DPOC) é um diagnóstico diferencial de asma, e pode estar presente nos asmáticos (ACO - Asthma-COPD Overlap). Por este motivo, o tratamento da asma deve ter entre os principais objetivos a mudança do curso natural da doença, não apenas o controle dos sintomas.
A asma é frequentemente associada a respostas imunológicas dirigidas por células Th2, ILC2 e Th9, bem como por células efetoras como eosinófilos e mastócitos. Assim sendo, alvos específicos para o tratamento da asma englobam mecanismos envolvidos na resposta T2, como IgE, IL-4, IL-5 e IL-13 e seus respectivos receptores; e receptores de prostaglandina D2. A Tabela 4 mostra os biológicos que estão sendo estudados para o tratamento de asma e DPOC.
As medicações biológicas têm custo elevado e a duração do tratamento, benefícios em longo prazo e efeitos adversos ainda não são bem conhecidos. Além disso, biológicos com o mesmo mecanismo de ação não foram diretamente comparados em relação à segurança e eficácia320.
Outras terapias
Biológicas
Rituximabe - Anti-CD20
O rituximabe é um anticorpo monoclonal, quimérico, murino/humano, anti-CD20 que depleta os linfócitos B de memória que são necessários para a produção de autoanticorpos323. Registrado no Brasil como antineoplásico e antirreumático, é apresentado em caixas com dois frascos com 10 mL (10 mg/mL), ou caixa com um frasco com 50 mL (10 mg/mL), além de solução para diluição para infusão IV202. É indicado para adultos com alguma doença em que os linfócitos B desempenhem papel importante, e pode ser usado isoladamente, ou em associação a outros medicamentos324.
O rituximabe tem sido utilizado com sucesso no tratamento de várias doenças autoimunes e nos erros inatos da imunidade, como anteriormente citado. Em decorrência da depleção de células B sugere-se que induza decréscimo da produção de autoanticorpos IgG, e consequentemente atue na UCE de origem autoimune325. Há relatos de sua eficácia em pacientes com UCE. O rituximabe foi eficaz em quatro pacientes com urticária crônica autoimune325-327, porém, falhou em outro328. Estudo posterior de fase I-II foi interrompido pelo FDA devido à segurança do produto329.
É possível que o rituximabe venha a ser uma opção terapêutica em casos de pacientes com urticária crônica autoimune refratária ao tratamento convencional. Entretanto, o seu perfil de segurança precisa ser levado em consideração.
Anakinra
A IL-1 é uma potente citocina inflamatória descrita nos anos 70, e foi inicialmente denominada de fator ativador de linfócitos330,331, ou interleucina pirogênica332. A IL-1 pertence à família dos ligantes de IL-1 que desempenham um papel central na resposta imune inata333. É indicado para adultos no tratamento dos sinais e sintomas da artrite reumatoide (AR) em combinação com metotrexato, para os com resposta inadequada ao metotrexato administrado isoladamente334. É apresentado na dose de 100 mg em seringa pré-cheia com solução injetável (0,67 mL ou 159 mg/mL)334. Não é disponível no Brasil.
O antagonista do receptor da IL-1 (anakinra) é produzido em células de E. coli por tecnologia de DNA recombinante. É indicado para adultos no tratamento dos sinais e sintomas da artrite reumatoide (AR) em combinação com metotrexato, na resposta inadequada ao metotrexato administrado isoladamente334. Tem se mostrado efetivo no tratamento de diversas síndromes autoinflamatórias como Síndrome familiar do Mediterrâneo335, Schnitzler336, Hiper IgD337 e Síndrome periódica associada ao receptor TNF338. Mais recentemente, foi descrito o primeiro relato do uso desta medicação na urticária ao frio idiopática339. Paciente de 62 anos que apresentava lesões urticariformes e angioedema de orofaringe graves desde a infância associados à exposição ao frio. A paciente era refratária à terapia tradicional com anti-histamínicos. Com o uso da anakinra os sintomas regrediram, houve melhora significativa da qualidade de vida, sem recorrência do quadro no período de dois anos. A paciente evoluiu com deterioração neurológica progressiva, sendo firmado o diagnóstico de esclerose lateral amiotrófica, e faleceu em decorrência de complicações neurológicas da doença.
Canaquinumabe - Anti IL-1β
O canaquinumabe é anticorpo monoclonal humano isotipo IgG1/kappa que atua especificamente contra a IL-1β. A IL-1β tem como função central defender o organismo contra infecções por microrganismos patogênicos, incluindo bactérias340, fungos341 e vírus342. Além de seu papel fisiológico na proteção do hospedeiro, a IL-1β é conhecida por ser importante em várias doenças inflamatórias graves208. Liberado para uso em pacientes maiores de dois anos de vida com: síndromes febris periódicas autoinflamatórias, síndromes periódicas associadas à criopirina (CAPS), síndrome periódica associada ao receptor do fator de necrose tumoral (TRAPS), síndrome da hiperimunoglobulinemia D (HIDS)/deficiência da mevalonato quinase (MKD), febre familiar do Mediterrâneo e artrite idiopática juvenil sistêmica343. Pode ser usado como monoterapia, ou em combinação com metotrexato. É disponível em frasco-ampola com 150 mg de canaquinumabe em pó para solução injetável343.
O canaquinumabe atua ao se ligar com alta afinidade à IL-1β humana, neutralizando sua atividade biológica pelo bloqueio de sua interação com os receptores IL-1β, desta forma, impedindo a ativação genética induzida pela IL-1β e a produção de mediadores inflamatórios, como a IL-6 ou a ciclooxigenase-2.
Achados recentes sugerem que a IL-1β está relacionada com o rash urticariforme nas doenças autoinflamatórias, e que pode estar associada também a outras doenças alérgicas como a asma, dermatite de contato e a dermatite atópica. Além da excelente resposta ao tratamento bloqueador da IL-1β nas doenças autoinflamatórias, tem se observado que esta pode ser efetiva também em alguns subtipos de urticária, como na urticária de pressão tardia e na urticária ao frio339,344.
Estudos clínicos estão sendo conduzidos para elucidar o papel da inibição da IL-1 na UCE. Um deles avalia pacientes adultos com UCE moderada a grave. É um estudo de fase II de canaquinumabe, randomizado, duplo-cego, placebo-controlado e unicêntrico. Estima-se que o estudo piloto inclua 20 pacientes, e a eficácia da administração SC do produto (150 mg) seja avaliada com escores de atividade da urticária e com escores diários de urticas nas semanas 1, 2, 4 e 8 após a injeção da medicação329.
Rilonacepte
É um receptor solúvel que neutraliza tanto a IL-1α como a IL-1β. Esta terapia provavelmente trará benefício apenas para um subgrupo de pacientes com urticária. Na urticária ao frio, alguns subtipos não são responsivos aos anti-histamínicos, e estes provavelmente estão relacionados à IL-1. Um potencial biomarcador desses pacientes pode ser a velocidade de hemossedimentação (VHS) e a proteína C-reativa (PCR), que estão aumentadas nas doenças causadas pela IL-1. Nestes casos, os pacientes podem ser responsivos ao rilonacepte181.
Aprovado para uso em adolescentes a partir dos 12 anos de vida, tem indicação no tratamento da síndrome periódica associada à criopirina (CAPS), incluindo a síndrome autoinflamatória familiar ao frio (FCAS), e a síndrome Muckle-Wells. A posologia preconizada é de 320 mg em 2 mL por via subcutânea (SC), ou 160 mg aplicados em duas zonas diferentes no mesmo dia. Posteriormente, segue-se com 160 mg SC a cada semana, rodiziando o local da injeção345. As reações adversas mais comumente relatadas foram edema, dermatite, urticária, eritema, prurido, reação no sítio da injeção, náuseas, diarreia, infecção respiratória alta (sinusite)345.
Não biológicas: inibidores de JAK/STAT
O EII com ganho de função (GoF) de STAT1 leva à fosforilação aumentada e sustentada com aumento da expressão de genes estimulados por interferon e, clinicamente, é caracterizada por candidíase mucocutânea crônica e fenômenos autoimunes346. O bloqueio de JAK1 e JAK2, sinalizadores anteriores à STAT1, podem suprimir essa ativação excessiva. O tratamento dos pacientes com o ruxolitinibe, um inibidor de JAK1/JAK2 tem se mostrado eficaz no controle dos pacientes com GoF STAT1347.
Inibidores da JAK (ruloxitinibe, baricitinibe e tofacitinibe) também são úteis em pacientes com doenças autoinflamatórias monogênicas com assinatura de interferon tipo I, como a vasculopatia associada a STING de início na infância (SAVI) e a dermatite neutrofílica crônica atípica e lipodistrofia (CANDLE)279. Há ensaios clínicos em curso sobre seu uso na síndrome de Aicardi-Goutieres.
O uso de imunobiológicos em pacientes com EII é uma realidade crescente à medida que aumenta o conhecimento sobre seus determinantes genéticos, ampliando também o entendimento sobre sua fisiopatologia e os biomarcadores que podem se constituir em alvo de medicamentos biológicos com ação específica. A incorporação desses medicamentos pelas agências governamentais reguladoras deve considerar a raridade dos casos e a consequente limitação na realização de estudos com grande número amostral.
VI - Medicamentos biossimilares
O uso de medicamentos biológicos foi expandido nas últimas décadas, e tem contribuído para o aumento significativo nos custos globais em saúde nos países desenvolvidos. Após um período de uso exclusivo de biológicos originais, vários produtos tiveram as suas patentes expiradas, implicando no desenvolvimento de biossimilares. O primeiro biológico desenvolvido para doenças alérgicas - omalizumabe - teve a sua patente vencida recentemente, apontando para a possibilidade de abertura do mercado para os produtos biossimilares.
Os biossimilares representam a possibilidade de redução de custos para o sistema de saúde e, consequentemente, a possibilidade de expansão do acesso a medicamentos de alto custo para um maior número de pacientes.
Na Europa, o primeiro biossimilar - somatotropina - foi lançado em 2006, enquanto que nos EUA, somente em 2015 foi licenciado o primeiro biossimilar - filgrastina349. O primeiro biossimilar de rituximabe, produzido pela Sandoz, foi lançado no Brasil para tratamento de doenças hematológicas e reumatológicas.
Pacientes, médicos e outros profissionais de saúde, com frequência, expressam a sua preocupação com a segurança dos biossimilares, em especial com relação à imunogenicidade. Os biossimilares não são réplicas exatas das moléculas inovadoras, uma vez que são produzidos em organismos vivos. Podem apresentar pequenas diferenças estruturais ou funcionais, designadas como "micro-heterogeneidade".
O principal receio é que a micro-heterogeneidade dos biossimilares possa se traduzir na prática clínica por diferenças na imunogenicidade, resultando em maior risco de anafilaxia, doença do soro e anticorpos antidroga (ADA). Um exemplo comumente citado é o aumento da incidência de anticorpos anti-hemácia entre pacientes com doença renal crônica com anemia, relacionada ao biossimilar da eritropoietina-α. A preocupação com a segurança representa uma importante barreira para a aceitação na prática clínica dos medicamentos biossimilares350,351.
Conceito de biossimilar
Os medicamentos biossimilares são proteínas terapêuticas com alto nível de similaridade, estrutura comparável e eficácia similar à dos produtos originais de referência. Portanto, são similares, e não idênticos ao produto biofarmacêutico original, porque as moléculas farmacêuticas não são quimicamente indistinguíveis, não podendo ser considerados uma forma genérica. Um biossimilar não deve diferir do produto biológico original em mais ou menos 20%, pois a faixa de 80 a 120% é utilizada como o padrão de equivalência, no intervalo de 90% de confiança, para os testes de farmacocinética e farmacodinâmica352.
Desenvolvimento de biossimilares
O desenvolvimento de biossimilares segue uma abordagem passo a passo, que inclui quatro etapas: caracterização, adequação, comparação e confirmação. O produtor do biossimilar não tem conhecimento do processo de manufatura original, assim sendo, a etapa de caraterização envolve análises extensas das caraterísticas estruturais, físico-químicas e biológicas do produto de referência para definir intervalos-alvo para o produto biossimilar. O processo de fabricação do biossimilar passa por ajustes para que os atributos de qualidade do produto se aproximem ao máximo possível ao do medicamento de referência349,353,354.
A etapa de comparação inclui estudos analíticos extensos, sendo realizados na faixa de 20-40 diferentes métodos de testes para examinar todos os aspectos relevantes da estrutura e função da molécula. Para estabelecer a biossimilaridade, esses estudos devem demonstrar que a sequência primária de aminoácidos é idêntica à da proteína original, e que existe semelhança em termos de estrutura de ordem superior, pureza, atividades físicas e conteúdo proteico. Isso significa que para cada teste analítico, os resultados para o biossimilar devem demonstrar que estão dentro da faixa testada do produto de referência. Diferenças menores nos atributos de qualidade (por exemplo, glicosilação, processo realcionados com impurezas) podem ser permitidas, uma vez tenha sido demonstrado que tais diferenças não são clinicamente significativas. Ensaios comparativos in vitro fornecem uma comparação detalhada de efeitos funcionais relevantes. Os testes in vivo em animais podem ser utilizados na avaliação de farmacocinética (PK), farmamacodinâmica (PD) e toxicologia353-355.
A etapa de confirmação deve demonstrar que o produto de referência e o medicamento biossimilar apresentam desempenho clínico comparável. Deve ser utilizada em população homogênea de pacientes, suficientemente sensível para detectar possíveis diferenças entre o biossimilar e o produto de referência. Estudos clínicos iniciais avaliam comparativamente as características do biossimilar e do produto de referência com relação à PK e PD, e estudos posteriores de desenvolvimento clínico devem demonstrar eficácia e segurança comparáveis. Os dados comparativos de imunogenicidade são geralmente requeridos. Quando a incidência da resposta imunológica é rara e provavelmente não identificada durante os estudos clínicos, estudos de pós-marketing podem ser necessários356,357.
Uma vez aprovado, o produto biossimilar pode receber autorização para uso em todas as indicações do produto inovador, com base no conceito de extrapolação de dados de eficácia e segurança358.
Dados oriundos de estudos clínicos pré-autorização são frequentemente insuficientes para identificar potenciais diferenças no perfil de segurança, em termos de natureza, gravidade e incidência dos efeitos adversos, entre o biossimilar e o produto de referência. Além disso, o desenvolvimento de imunogenicidade pode ser imprevisível. Deste modo, uma vez aprovado, o produto biossimilar deve ser monitorado através de estudos observacionias (retrospectivos e prospectivos) e programas de farmacovigilância eficientes348.
Regulamentações internacionais
O primeiro processo legal de regulamentação para biossimilares foi estabelecido pela European Medicine Agency (EMA), em 2005, e apresentava as pedras angulares para o processo de aprovação de biossimilares - experimentação pré-clínica, estudos de eficácia, extrapolação, observação de segurança e estudos de farmacovigilância pós-marketing. Esta normatização levou à aprovação do primeiro biossimilar da somatotropina em 2006, e de três biossimilares da eritropoeitina-α para o tratamento da anemia grave343.
Em 2009, a Organização Mundial de Sáude (OMS/WHO) desenvolveu uma normatização baseada nas diretrizes da EMA para o desenvolvimento de biossimilares a ser adotada em todos os países membros359. Posteriormente, em 2009, o Food and Drug Administration (FDA) publicou o Biologic Price Competition and Innovation Act, e, em 2012, uma diretriz para a indústria farmacêutica352,354.
O propósito destas diretrizes é garantir que um biossimilar seja comparável ao produto de referência em termos de qualidade, perfil de segurança e eficácia e propor critérios para a equivalência da formulação terapêutica. Além disso, de acordo com estas diretrizes, a imunogenicidade é um risco para todas as drogas proteicas, e deve ser considerada e investigada profundamente com ensaios de screening de anticorpos, associados a avaliações da tolerabilidade de longo prazo349,352.
Biossimilares devem ser caracterizados em seus atributos físico-químicos e biofísicos, incluindo sequência de aminoácidos, estrutura secundária e terciária, perfil de impurezas, excipientes, atividade biológica e análises comparativas com o produto de referência. Um biossimilar deve atender integralmente a lista de critérios de equivalência em termos de tamanho, estrutura, relação estrutura-função, estabilidade e micro-heterogeneidade, pois pequenas alterações na estrutura proteica tridimensional e na quantidade de variantes ácido-base podem resultar em alterações na segurança e eficácia356,360.
Permutabilidade
Uma questão crucial para a comunidade médica é se os biossimilares devem ser reservados para os pacientes que estão iniciando a terapia biológica, ou se é apropriado em pacientes em uso de produto de referência, a mudança para um produto biossimilar. De acordo com o EMA, a permutabilidade refere-se à possibilidade de trocar um medicamento por outro, cujo efeito clínico esperado é o mesmo. Entretanto, o EMA não tem recomendações estabelecidas para a substituição de produtos biológicos349.
Nos EUA, um "produto permutável" é um biossimilar que atende aos padrões regulatórios adicionais relativos à permutabilidade, incluindo estudos clínicos avaliando a substituição de produtos de referência por biossimilares. Produtos permutáveis podem ser substituídos sem a intervenção do prescritor original, uma vez que a legislação americana permite esta prática361.
A comunidade médica tem expressado reservas sobre a permutabilidade e troca entre produtos biológicos originais e biossimilares. A maior preocupação é relacionada ao risco de imunogenicidade. Contudo, vários estudos internacionais de substituição foram conduzidos, fornecendo embasamento para esta conduta. Além disso, os estudos clínicos pré-aprovação dos biossimilares frequentemente incorporam a avaliação da substituição do produto de referência pelo biossimilar349.
Embora os estudos de substituição não sejam requeridos na Europa, o European Public Assesment Reports, disponível no site da EMA, apresenta dados de substituição de produtos originais por biossimilares, incluindo a somatotropina, eritropoietina-α, filgrastina, insulina glargina, adalimumabe, etanercept e rituximabe. Revisão recente identificou 90 estudos de substituição de produtos originais por biossimilares conduzidos até junho de 2017. Os autores concluíram que a grande maioria dos estudos não relatou qualquer diferença com relação à segurança, eficácia e imunogenicidade após a substituição do biológico de referência pelo biossimilar362. A maioria dos estudos de substituição foi realizada com o biossimilar do infliximabe CT-P13, que foi o primeiro anticorpo monoclonal biossimilar aprovado na Europa e EUA, em 2013 e 2016, respectivamente363,364.
Os biossimilares diferem dos medicamentos genéricos e, assim sendo, considerações específicas sobre a permutabilidade com produtos originais são necessárias. Vigilância e monitoramento clínico devem ser mantidos após qualquer troca. No caso de produtos aplicados pelo paciente ou cuidadores, é importante o treinamento para a utilização correta dos novos dispositivos349,352. O efeito "nocebo" pode influenciar na percepção da efetividade (expectativa negativa), e também no aumento de efeitos adversos. Um estudo recente apontou que 12,5% dos pacientes reumatológicos que haviam substituído o infliximabe por biossimilar apresentaram o efeito "nocebo"365.
Políticas internacionais
A penetração de biossimilares no mercado europeu é variável. Em 2016, por exemplo, a participação dos biossimilares anti-TNF versus o produto de referência variou de 5% na Bélgica para 90% na Dinamarca. Alguns países implementaram políticas de biossimilares, muitas destas direcionadas para a permutabilidade. As estratégias envolvem a concorrência, incentivos para os profissionais de saúde e políticas de substituição349.
A concorrência pode resultar em redução de custos, tanto para os produtos biológicos originais, como para os biossimilares. Na Noruega, a Norwegian Drug Procurement Cooperation negocia os preços junto às companhias farmacêuticas, produzindo uma lista de recomendações que são implementadas em hospitais. O resultado desta política resultou em descontos no valor dos biossimilares inibidores anti-TNF de 39% em 2014, e de 69% em 2015. O governo da Noruega apoia ativamente a adoção de biossimilares, e patrocina o estudo NOR-SWITCH com o objetivo de confirmar a segurança da substituição dos produtos de referência por biossimilares366.
Vários outros países têm desenvolvido políticas específicas para a ampliação do uso de biossimilares, destacando-se a Dinamarca, Alemanha, Itália, Suécia, Reino Unido e Austrália349.
Considerações finais
Os medicamentos biológicos, em especial os anticorpos monoclonais, representam uma nova era na Medicina e propiciaram avanços terapêuticos em várias especialidades médicas, incluindo Oncologia, Reumatologia, Gastroenterologia, Dermatologia, Alergia e Imunologia. O advento de anticorpos monoclonais para o tratamento de doenças alérgicas graves possibilita o tratamento alvo-específico, redução da morbidade e redução de efeitos adversos da corticoterapia sistêmica e tratamentos imunossupressores. Entretanto, a terapia biológica tem alto custo financeiro, e a sua utilização na prática clínica é limitada pelo impacto no orçamento dos sistemas de Saúde Pública e Suplementar. Neste contexto, o desenvolvimento de biossimilares pode representar não somente a redução de custos, mas também a possibilidade de acesso à terapia biológica para um maior número de pacientes.
Contudo, a incorporação de medicamentos biossimilares deve ser fundamentada em regulamentação específica, estudos bem delineados, estudos clínicos no "mundo real" e programas de farmacovigilância eficientes com o objetivo de detectar, compreender e prevenir eventos adversos. Estas ações irão dar maior credibilidade e confiança no uso de biossimilares para os médicos prescritores e pacientes. É desejável que se estabeleça cooperação entre as autoridades regulatórias, comunidade científica e indústria farmacêutica.
Referências
1. Gross CP, Sepkowitz KA. The myth of the medical breakthrough: smallpox, vaccination, and Jenner reconsidered. Int J Infect Dis. 1998;3(1):54-60.
2. Lewiecki EM. Biological therapy: chronicling 15 years of progress. Expert Opin Biol Ther. 2015;15(5):619-21.
3. Finco O, Rappuoli R. Designing vaccines for the twenty-first century society. Front Immunol. 2014;5:12.
4. Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 1975;256(5517):495-7.
5. Ecker DM, Jones SD, Levine HL. The therapeutic monoclonal antibody market. MAbs. 2015;7(1):9-14.
6. Gaughan CL. The present state of the art in expression, production and characterization of monoclonal antibodies. Mol Divers. 2016;20(1):255-70.
7. Medzhitov R, Janeway C. Innate immunity. N Engl J Med. 2000;343(5):338-44.
8. Parren PWHI, Carter PJ, Plückthun A. Changes to International Nonproprietary Names for antibody therapeutics 2017 and beyond: of mice, men and more. MAbs. 2017;9(6):898-906.
9. Flanagan SE, Haapaniemi E, Russell MA, Caswell R, Allen HL, De Franco E, et al. Activating germline mutations in STAT3 cause early-onset multi-organ autoimmune disease. Nat Genet. 2014;46(8):812-4.
10. Kuehn HS, Ouyang W, Lo B, Deenick EK, Niemela JE, Avery DT, et al. Immune dysregulation in human subjects with heterozygous germline mutations in CTLA4. Science. 2014;345(6204):1623-7.
11. Sebastiani GD, Scirocco C, Galeazzi M. Rheumatic immune related adverse events in patients treated with checkpoint inhibitors for immunotherapy of cancer. Autoimmun Rev. 2019 Aug;18(8):805-13.
12. Clark EA, Ledbetter JA. How does B cell depletion therapy work, and how can it be improved? Ann Rheum Dis. 2005;64 Suppl 4:iv77-80.
13. Browne SK, Zaman R, Sampaio EP, Jutivorakool K, Rosen LB, Ding L, et al. Anti-CD20 (rituximab) therapy for anti-IFN-γ autoantibody-associated nontuberculous mycobacterial infection. Blood. 2012;119(17):3933-9.
14. Chase NM, Verbsky JW, Hintermeyer MK, Waukau JK, Tomita-Mitchell A, Casper JT, et al. Use of combination chemotherapy for treatment of granulomatous and lymphocytic interstitial lung disease (GLILD) in patients with common variable immunodeficiency (CVID). J Clin Immunol. 2013;33(1):30-9.
15. Gobert D, Bussel JB, Cunningham-Rundles C, Galicier L, Dechartres A, Berezne A, et al. Efficacy and safety of rituximab in common variable immunodeficiency-associated immune cytopenias: a retrospective multicentre study on 33 patients. Br J Haematol. 2011;155(4):498-508.
16. Easthope S, Jarvis B. Omalizumab. Drugs. 2001;61(2):253-60.
17. Holgate ST, Polosa R. Treatment strategies for allergy and asthma. Nat Rev Immunol. 2008;8(3):218-30.
18. Djukanovi R, Wilson SJ, Kraft M, Jarjour NN, Steel M, Chung KF, et al. Effects of treatment with anti-immunoglobulin E antibody omalizumab on airway inflammation in allergic asthma. Am J Respir Crit Care Med. 2004;170(6):583-93.
19. Belliveau PP. Omalizumab: a monoclonal anti-IgE antibody. Med Gen Med. 2005;7(1):27.
20. Genentech. Xolair (omalizumab) for subcutaneous use prescribing information. South San Francisco, CA; 2014 sep. Revised 05/2019. Disponível em: https://www.gene.com/download/pdf/xolair_prescribing.pdf. Acessado em junho de 2019.
21. Johansson SG, Haahtela T, O'Byrne PM. Omalizumab and the immune system: an overview of preclinical and clinical data. Ann Allergy Asthma Immunol. 2002;89:132-8.
22. Oliver J, Tarleton C, Gilmartin L, Archibeque T, Qualls C, Diehl L, et al. Reduced FcepsilonRI-mediated release of asthma-promoting cytokines and chemokines from human basophils during omalizumab therapy. Int Arch Allergy Immunol. 2010;151(4):275-84.
23. MacGlashan DW, Bochner BS, Adelman DC, Jardieu PM, Togias A, McKenzie-White J, et al. Down-regulation of Fc(épsilon)RI expression on human basophils during in vivo treatment of atopic patients with anti-IgE antibody. J Immunol. 1997;158:1438-45.
24. Beck LA, Marcotte GV, MacGlashan Jr D, Togias A, Saini S. Omalizumab-induced reductions in mast cell Fcε RI expression and function. J Allergy Clin Immunol. 2004,114(3):527-30.
25. Chanez P, Contin-Bordes CC, Garcia G, Verkindre C, Didier A, De Blay Fdr, et al. Omalizumab-induced decrease of Fcε RI expression in patients with severe allergic asthma. Respir Med. 2010;104(11):1608-17.
26. Shields RL, Whether WR, Zioncheck K, O'Connell L, Fendly B, Presta LG, et al. Inhibition of Allergic Reactions with Antibodies to IgE. Int Arch Allergy Immunol. 1995;107(1-3):308-12.
27. Hamilton RG. Accuracy of US Food and Drug Administration-cleared IgE antibody assays in the presence of anti-IgE (omalizumab). J Allergy Clin Immunol. 2006;117:759.
28. Massanari M, Holgate ST, Busse WW, Jimenez P, Kianifard F, Zeldin R. Effect of omalizumab on peripheral blood eosinophilia in allergic asthma. Resp Med. 2009;104(2):188-96.
29. Van Rensen ELJ, Evertse CE, Van Schadewijk WAAM, Van Wijngaarden S, Ayre G, Mauad T, et al. Eosinophils in bronchial mucosa of asthmatics after allergen challenge: effect of anti-IgE treatment. Allergy. 2009;64(1):72-80.
30. Lin H, Boesel KM, Griffith DT, Prussin C, Foster B, Romero FA, et al. Omalizumab rapidly decreases nasal allergic response and FcepsilonRI on basophils. J Allergy Clin Immunol. 2004;113(2):297-302.
31. Hochhaus G, Brookman L, Fox H, Johnson C, Matthews J, Ren S, et al. Pharmacodynamics of omalizumab: implications for optimized dosing strategies and clinical efficacy in the treatment of allergic asthma. Curr Med Res Opin. 2003;19:491-8.
32. Solèr M, Matz J, Townley R, Buhl R, O'Brien J, Fox H, et al. The anti-IgE antibody omalizumab reduces exacerbations and steroid requirement in allergic asthmatics. Eur Respir J. 2001;18(2):254-61.
33. Corren J, Wood RA, Patel D, Zhu J, Yegin A, Dhillon G, et al. Effects of omalizumab on changes in pulmonary function induced by controlled cat room challenge. J Allergy Clin Immunol. 2011;127(2):398-405.
34. Nopp A, Johansson SG, Adedoyin J, Ankerst J, Palmqvist M, Oman H. After 6 years with Xolair: a 3-year withdrawal follow-up. Allergy. 2010;65:56-60.
35. Corren J, Casale TB, Lanier B, Buhl R, Holgate S, Jimenez P. Safety and tolerability of omalizumab. Clin Exp Allergy. 2009;39:788-97.
36. Cox L, Platts-Mills TA, Finegold I, Schwartz LB, Simons FE, Wallace DV, et al. American Academy of Allergy, Asthma & Immunology/ American College of Allergy, Asthma and Immunology Joint Task Force Report on omalizumab-associated anaphylaxis. J Allergy Clin Immunol. 2007;120:1373-7.
37. Tan LD, Bratt JM, Godor D, Louie S, Kenyon NJ. Benralizumab:a unique IL-5 inhibitor for severe asthma. J Asthma Allergy. 2016;9:71-81.
38. Markham A. Benralizumab: First Global Approval. Drugs. 2018;78(4):505-11.
39. FASENRATM benralizumabe - Bula profissional disponível em https://www.astrazeneca.com.br/content/dam/az-br/Medicine/InfoFasenra/Fasenra_Bula_Profissional%20-%20FSN003.pdf. Acesso em junho de 2019.
40. Smith DA, Minthorn EA, Beerahee M. Pharmacokinetics and pharmacodynamics of mepolizumab, an anti-interleukin-5 monoclonal antibody. Clin Pharmacokinet. 2011;50(4):215-27.
41. Krings JG, McGregor MC, Bacharier LB, Castro M. Biologics for severe asthma: treatment-specific effects are important in choosing a specific agent. J Allergy Clin Immunol Pract. 2019;7(5):1379-92.
42. Gnanakumaran G, Babu KS. Technology evaluation: mepolizumab, GlaxoSmithKline. Curr Opin Mol Ther. 2003;5(3):321-5.
43. Molfino NA, Gossage D, Kolbeck R, Parker JM, Geba GP. Molecular and clinical rationale for therapeutic targeting of interleukin-5 and its receptor. Clin Exp Allergy. 2012;42(5):712-37.
44. Ortega HG, Yancey SW, Mayer B, Gunsoy NB, Keene ON, Bleecker ER, et al. Severe eosinophilic asthma treated with mepolizumab stratified by baseline eosinophil thresholds:a secondary analysis of the DREAM and MENSA studies. Lancet Respir Med. 2016;4(7):549-56.
45. Cardet JC, Israel E. Update on reslizumab for eosinophilic asthma. Expert Opin Biol Ther. 2015;15:1531-9.
46. Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014;43(2):343-73.
47. Nucala (mepolizumabe) - Nova indicação. Disponível em: http://portal.anvisa.gov.br/informacoes-tecnicas13?p_p_id=101_INSTANCE_WvKKx2fhdjM2&p_p_col_id=column-2&p_p_col_pos=1&p_p_col_count=2&_101_INSTANCE_WvKKx2fhdjM2_groupId=219201&_101_INSTANCE_WvKKx2fhdjM2_urlTitle=nucala-mepolizumabe-&_101_INSTANCE_WvKKx2fhdjM2_struts_action=%2Fasset_publisher%2Fview_content&_101_INSTANCE_WvKKx2fhdjM2_assetEntryId=5584341&_101_INSTANCE_WvKKx2fhdjM2_type=content . Acesso em agosto de 2019.
48. 125526 Mepolizumab Statistical PREA - FDA. Disponível em: www.fda.gov/media/95129/download. Acesso em junho de 2019.
49. Pouliquen IJ, Kornmann O, Barton SV, Price JA, Ortega HG. Characterization of the relationship between dose and blood eosinophil response following subcutaneous administration of mepolizumab. Int J Clin Pharmacol Ther. 2015;53(12):1015-27.
50. Matucci A, Vultaggio A, Danesi R. The use of intravenous versus subcutaneous monoclonal antibodies in the treatment of severe asthma: a review. Respir Res. 2018;19:154.
51. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014;371:1198-207.
52. Busse WW. Biological treatments for severe asthma: A major advance in asthma care. Allergol Int. 2019; Feb 18. [Epub ahead of print].
53. Sulaiman I, Lim JCW, Soo HL, Stanslas J. Molecularly targeted therapies for asthma: Current development, challenges and potential clinical translation. Pulm Pharmacol Ther. 2016;40:52-68.
54. Lieberman P, Patterson R, Kunske R. Complications of long-term steroid therapy for asthma. J Allergy Clin Immunol. 1972;49:329-36.
55. Take Action With DUPIXENT® (dupilumab). Disponível em: https://www.dupixent.com/ . Acesso em junho de 2019.
56. CINQAERO, INN-reslizumab - European Medicines Agency - europa. eu. Disponível em: https://www.ema.europa.eu/en/documents/product-information/cinqaero-epar-product-information_en.pdf. Acesso em junho de 2019.
57. Verstraete K, Peelman F, Braun H. Structure and antagonism of the receptor complex mediated by human TSLP in allergy and asthma. Nat Commun. 2017;8:14937.
58. Corren J, Parnes JR, Wang L, Mo M, Roseti SL, Griffiths JM, et al. Tezepelumab in adults with uncontrolled asthma. N Engl J Med. 2017;377:936-46.
59. Ziegler SF, Artis D. Sensing the outside world: TSLP regulates barrier immunity. Nat Immunol. 2010;11:289-93.
60. Kato A, Favoreto S Jr, Avila PC, Schleimer RP. TLR3- and Th2 cytokine dependent production of thymic stromal lymphopoietin in human airway epithelial cells. J Immunol. 2007;179:1080.
61. Allakhverdi Z, Comeau MR, Jessup HK, Yoon BR, Brewer A, Chartier S, et al. Thymic stromal lymphopoietin is released by human epithelial cells in response to microbes, trauma, or inflammation and potently activates mast cells. J Exp Med. 2007;204(2):253-8.
62. Shikotra A, Choy DF, Ohri CM, Doran E, Butler C, Hargadon B, et al. Increased expression of immunoreactive thymic stromal lymphopoietin in patients with severe asthma. J Allergy Clin Immunol. 2012;129:104-11.
63. He JQ, Hallstrand TS, Knight D, Chan-Yeung M, Sandford A, Tripp B, et al. A thymic stromal lymphopoietin gene variant is associated with asthma and airway hyperresponsiveness. J Allergy Clin Immunol. 2009;124:222-9.
64. Gauvreau GM, O'Byrne PM, Boulet LP, Wang Y, Cockcroft D, Bigler J, et al. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med. 2014;370:2102-10.
65. Parnes JR, Sullivan JT, Chen L, Dias C. Pharmacokinetics, Safety, and Tolerability of Tezepelumab (AMG 157) in Healthy and Atopic Dermatitis Adult Subjects. Clin Pharmacol Ther. 2019; Feb 19. doi: 10.1002/cpt.1401.
66. Tezepelumab granted Breakthrough Therapy Designation by US FDA. Disponível em: https://www.astrazeneca.com/media-centre/press-releases/2018/tezepelumab-granted-breakthrough-therapy-designation-by-us-fda-07092018.html. Acesso em julho de 2019.
67. Study to Evaluate Tezepelumab in Adults With Severe Uncontrolled Asthma (DIRECTION). Disponível em: https://clinicaltrials.gov/ct2/show/study/NCT03927157. Acesso em julho de 2019.
68. Fichtner-Feigl S, Strober W, Kawakami K, Puri RK, Kitani A. IL-13 signaling through the IL-13alpha2 receptor is involved in induction of TGF-beta1 production and fibrosis. Nat Med. 2006;12:99-106.
69. O'Dwyer DN, Moore BB. The role of periostin in lung fibrosis and airway remodeling. Cell Mol Life Sci. 2017;74:4305-14.
70. Matsumoto H. Serum periostin: a novel biomarker for asthma management. Allergol Int. 2014;63:153-60.
71. Li H, Wang K, Huang H, Cheng W, Liu X. A meta-analysis of anti-interleukin-13 monoclonal antibodies for uncontrolled asthma. PLoS ONE 14(1):e0211790.
72. Liu Y, Zhang S, Chen R, Wei J, Guan G, Zhou M, et al. Meta-analysis of randomized controlled trials for the efficacy and safety of anti-interleukin-13 therapy with lebrikizumab in patients with uncontrolled asthma. Allergy Asthma Proc. 2018;39(5):332-7.
73. Steinke JW. Anti-interleukin-4 therapy. Immunol Allergy Clin North Am. 2004;24:599-614.
74. Pelaia G, Vatrella A, Maselli R. The potential of biologics for the treatment of asthma. Nat Rev Drug Discov. 2012;11:958-72.
75. Kao CC, Parulekar AD. Spotlight on fevipiprant and its potential in the treatment of asthma: evidence to date. J Asthma Allergy. 2019;12:1-5.
76. Bateman ED, Guerreros AG, Brockhaus F, Holzhauer B, Pethe A, Kay RA, et al. Fevipiprant, an oral prostaglandin DP2 receptor (CRTh2) antagonist, in allergic asthma uncontrolled on low-dose inhaled corticosteroids. Eur Respir J. 2017;50(2). pii: 1700670.
77. Kuna P, Bjermer L, Tornling G. Two Phase II randomized trials on the CRTh2 antagonist AZD1981 in adults with asthma. Drug Des Devel Ther. 2016;10:2759-70.
78. Zhu L, Ciaccio CE, Casale TB. Potential new targets for drug development in severe asthma. World Allergy Organ J. 2018;11(1):30.
79. Darveaux J, Busse WW. Biologics in asthma - the next step toward personalized treatment. J Allergy Clin Immunol Pract. 2015;3:152-60.
80. Manka LA, Wechsler ME. New biologics for allergic diseases. Expert Rev Clin Immunol. 2018;14:285-96.
81. Vignesh P, Rawat A, Singh S. An Update on the Use of Immunomodulators in Primary Immunodeficiencies. Clin Rev Allergy Immunol. 2017;52:287-303.
82. Israel E, Reddel HK. Severe and difficult-to-treat asthma in adults. N Engl J Med. 2017;377:965-76.
83. Olin JT, Wechsler ME. Asthma: pathogenesis and novel drugs for treatment. BMJ. 2014;349:g5517.
84. Gonem S, Berair R, Singapuri A, Hartley R, Laurencin MFM, Bacher G, et al. Fevipiprant, a prostaglandin D2 receptor 2 antagonist, in patients with persistent eosinophilic asthma: a single-centre, randomised, double-blind, parallel-group, placebo-controlled trial. Lancet Respir Med. 2016;4:699-707.
85. Desai M, Oppenheimer J, Lang DM. Immunomodulators and Biologics. Beyond stepped-care therapy. Clin Chest Med. 2019;40:179-92.
86. Busse W, Corren J, Lanier BQ, McAlary M, Fowler-Taylor A, Cioppa GD, et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol. 2001;108(2):184-90.
87. Humbert M, Beasley R, Ayres J, Slavin R, Hébert J, Bousquet J, et al. Benefits of omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy. 2005;60(3):309-16.
88. Chan MA, Gigliotti NM, Dotson AL, Rosenwasser LJ. Omalizumab may decrease IgE synthesis by targeting membrane IgE+ human B cells. Clin Transl Allergy. 2013;3(1):29.
89. Teach SJ, Gill MA, Togias A, Sorkness CA, Arbes SJ Jr, Calatroni A, et al. Preseasonal treatment with either omalizumab or an inhaled corticosteroid boost to prevent fall asthma exacerbations. J Allergy Clin Immunol. 2015;136(6):1476-85.
90. Global Initiative for Asthma - update 2019. Disponível em: ginasthma.org/wp-content/uploads/2019/04/GINA-2019-main-Pocket-Guide-wms.pdf. Acesso em abril de 2019.
91. Carvalho-Pinto RM, Agondi RC, Giavina-Bianchi P, Cukier A, Stelmach R. Omalizumab in patients with severe uncontrolled asthma: well-defined eligibility criteria to promote asthma control. J Bras Pneumol. 2017;43(6):487-9.
92. Karpel J, Massanari M, Geba GP, Kianifard F, Inhaber N, Zeldin RK. Effectiveness of omalizumab in reducing corticosteroid burden in patients with moderate to severe persistent allergic asthma. Ann Allergy Asthma Immunol. 2010;105(6):465-70.
93. Bhutani M, Yang WH, Hébert J, de Takacsy F, Stril JL. The real world effect of omalizumab add on therapy for patients with moderate to severe allergic asthma: The ASTERIX Observational study. PLoS One. 2017;12(8):e0183869.
94. Bousquet J, Cabrera P, Berkman N, Buhl R, Holgate S, Wenzel S, et al. The effect of treatment with omalizumab, an anti-IgE antibody, on asthma exacerbations and emergency medical visits in patients with severe persistent asthma. Allergy. 2005 Mar;60(3):302-8.
95. LaiT, Wang S, Xu Z, Zhang C, ZhaoY, HuY, et al. Long-term efficacy and safety of omalizumab in patients with persistent uncontrolled allergic asthma: a systematic review and meta-analysis. Sci Rep. 2015;5:8191.
96. Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014;(1):CD003559.
97. Pitrez PM, de Souza RG, Roncada C, Heinzmann-Filho JP, Santos G, Pinto LA, et al. Impact of omalizumab in children from a middle-income country with severe therapy-resistant asthma: A real-life study. Pediatr Pulmonol. 2017;52(11):1408-13.
98. Fahy JV, Fleming HE, Wong HH, Liu JT, Su JQ, Reimann J, et al. The effect of an anti-IgE monoclonal antibody on the early- and late-phase responses to allergen inhalation in asthmatic subjects. Am J Respir Crit Care Med. 1997;155(6):1828-34.
99. Jones J, Shepherd J, Hartwell D, Harris P, Cooper K, Takeda A, et al. Omalizumab for the treatment of severe persistent allergic asthma. Health Technol Assess. 2009;13 Suppl 2:31-9.
100. Casale TB, Luskin AT, Busse W, Zeiger RS, Trzaskoma B, Yang M, et al. Omalizumab effectiveness by biomarker status in patients with asthma: Evidence from PROSPERO, a prospective real-world study. J Allergy Clin Immunol Pract. 2019;7(1):156-164.e1.
101. Limb SL, Starke PR, Lee CE, Chowdhury BA. Delayed onset and protracted progression of anaphylaxis after omalizumab administration in patients with asthma. J Allergy Clin Immunol. 2007;120(6):1378-81.
102. Cruz AA, Lima F, Sarinho E, Ayre G, Martin C, Fox H, et al. Safety of anti-immunoglobulin E therapy with omalizumab in allergic patients at risk of geohelminth infection. Clin Exp Allergy. 2007;37(2):197-207.
103. Giavina-Bianchi P, Giavina-Bianchi M, Agondi R, Kalil J. Administration of anti-IgE to a Churg-Strauss syndrome patient. Int Arch Allergy Immunol. 2007;144(2):155-8.
104. RambasekT, Kavuru MS. Omalizumab dosing via the recommended card versus use of the published formula. J Allergy Clin Immunol. 2006;117(3):708-9.
105. FitzGerald JM, Bleecker ER, Nair P, Korn S, Ohta K, Lommatzsch M, et al. Benralizumab, an anti-interleukin-5 receptor alpha monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA):a multicenter, double-blind, placebo-controlled phase 3 trial. Lancet. 2016;388:2128-41.
106. Bleecker ER, FitzGerald JM, Chanez P, Papi A, Weinstein SF, Barker P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting beta2-agonists (SIROCCO): a multicenter, placebo-controlled phase 3 trial. Lancet. 2016;388:2115-27.
107. Nair P, Wenzel S, Rabe KF, Bourdin A, Lugogo NL, Kuna P, et al. Oral glucocorticoid-sparing effect of benralizumab in severe asthma. N Engl J Med. 2017;376:2448-58.
108. Sehmi R, Lim HF, Mukherjee M, Huang C, Radford K, Newbold P, et al. Benralizumab attenuates airway eosinophilia in prednisone-dependent asthma. J Allergy Clin Immunol. 2018;141:1529-32e8.
109. Fasenra® Bula. Disponível em: https://www.astrazeneca.com.br/content/dam/az-br/Medicine/InfoFasenra/Fasenra_Bula_Profissional%20-%20FSN003.pdf. Acesso em março de 2019.
110. Hermosa JL, Sanchez CB, Rubio MC, Minguez MM, Walther JL. Factors associated with the control of severe asthma. J Asthma. 2010;47:124-30.
111. Corren J, Weinstein S, Janka L, Zangrilli J, Garin M. Phase 3 study of reslizumab in patients with poorly controlled asthma: effects across a broad range of eosinophil counts. Chest. 2016;150:799-810.
112. Castro M, Corren J, Pavord ID, Maspero J, Wenzel S, Rabe KF, et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med. 2018;378:2486-96.
113. Menzella F, Montanari G. Clinical usefulness of mepolizumab in severe eosinophilic asthma. Ther Clin Risk Manag. 2016:907-16.
114. Bel EH, Wenzel SE, Thompson PJ, Prazma CM, Keene ON, Yancey SW, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014;371:1189-97.
115. Haldar P, Brightling CE, Hargadon B, Gupta S, Monteiro W, Sousa A, et al. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med. 2009;360:973-84.
116. Haldar P, Brightling CE, Singapuri A, Hargadon B, Gupta S, Monteiro W, et al. Outcomes after cessation of mepolizumab therapy in severe eosinophilic asthma: a 12-month follow-up analysis. J Allergy Clin Immunol. 2014;133:921-3.
117. Shimoda T, Odajima H, Okamasa A, Kawase M, Komatsubara M, Mayer B, et al. Efficacy and safety of mepolizumab in Japanese patients with severe eosinophilic asthma. Allergol Int. 2017;66:445-51.
118. Lugogo N, Domingo C, Chanez P, Leigh R, Gilson MJ, Price RG, et al. Longterm efficacy and safety of mepolizumab in patients with severe eosinophilic asthma: a multi-center, open-label, phase IIIb study. Clin Ther. 2016;38: 2058-2070.e1.
119. Magnan A, Bourdin A, Prazma CM, Albers FC, Price RG, Yancey SW, et al. Treatment response with mepolizumab in severe eosinophilic asthma patients with previous omalizumab treatment. Allergy. 2016;71:1335-44.
120. Pavord ID, Korn S, Howarth P, Bleecker ER, Buhl R, Keene ON, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet. 2012;380:651-9.
121. Chupp GL, Bradford ES, Albers FC, Bratton DJ, Wang-Jairaj J, Nelsen LM, et al. Efficacy of mepolizumab add-on therapy on health-related quality of life and markers of asthma control in severe eosinophilic asthma (MUSCA): a randomised, double-blind, placebo-controlled, parallel-group, multicentre, phase 3b trial. Lancet Respir Med. 2017;5:390-400.
122. Farne HA, Wilson A, Powell C, Bax L, Milan SJ. Anti-IL5 therapies for asthma. Cochrane Database Syst Rev. 2017;9:CD010834.
123. Tsukamoto N, Takahashi N, Itoh H, Pouliquen I. Pharmacokinetics and pharmacodynamics of mepolizumab, an anti-interleukin 5 monoclonal antibody, in healthy Japanese male subjects. Clin Pharmacol Drug Dev. 2016;5:102-8.
124. Flood-Page PT, Menzies-Gow AN, Kay AB, Robinson DS. Eosinophil's role remains uncertain as anti-interleukin-5 only partially depletes numbers in asthmatic airway. Am J Respir Crit Care Med. 2003;167:199-204.
125. Galkin D, Liu MC, Chipps BE, Chapman KR, Muñoz X, Bergna MA, et al. Efficacy and safety of mepolizumab in uncontrolled patients with severe eosinophilic asthma following a switch from omalizumab (OSMO study): exacerbation and safety outcomes. J Allergy Clin Immunol. 2018;141:AB409.
126. Rabe KF, Nair P, Brusselle G, Maspero JF, Castro M, Sher L, et al. Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. N Engl J Med. 2018;378:2475-85.
127. Zayed Y, Kheiri B, Banifadel M, Hicks M, Aburahma A, Hamid K, et al. Dupilumab safety and efficacy in uncontrolled asthma: a systematic review and meta-analysis of randomized clinical trials. J Asthma. 2018 Oct 1:1-10. [Epub ahead of print].
128. Passalacqua G, Matucci A, Vultaggio A, Bagnasco D, Mincarini M, Maggi E, et al. The safety of monoclonal antibodies in asthma. Expert Opin Drug Saf. 2016;15:1087-95.
129. Bochner BS, Klunk DA, Sterbinsky SA, Coffman RL, Schleimer RP. IL-13 selectively induces vascular cell adhesion molecule-1 expression in human endothelial cells. J Immunol. 1995;154:799-803.
130. Conroy DM, Williams TJ. Eotaxin and the attraction of eosinophils to the asthmatic lung. Respir Res. 2001;2:150-6.
131. Castro M, Mathur S, Hargreave F, Boulet LP, Xie F, Young J, et al. Reslizumab for poorly controlled, eosinophilic asthma: a randomized, placebocontrolled study. Am J Respir Crit Care Med. 2011;184:1125-32.
132. Castro M, Zangrilli J, Wechsler ME, Bateman ED, Brusselle GG, Bardin P, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet Respir Med. 2015;3:355-66.
133. Bjermer L, Lemiere C, Maspero J, Weiss S, Zangrilli J, Germinaro M. Reslizumab for inadequately controlled asthma with elevated blood eosinophil levels: a randomized phase 3 study. Chest. 2016;150:789-98.
134. Mukherjee M, Aleman Paramo F, Kjarsgaard M, Salter B, Nair G, LaVigne N, et al. Weight-adjusted intravenous reslizumab in severe asthma with inadequate response to fixed-dose subcutaneous mepolizumab. Am J Respir Crit Care Med. 2018;197:38-46.
135. Henriksen DP, Bodtger U, Sidenius K, Maltbaek N, Pedersen L, Madsen H, et al. Efficacy, adverse events, and inter-drug comparison of mepolizumab and reslizumab anti-IL-5 treatments of severe asthma - a systematic review and meta-analysis. Eur Clin Respir J. 2018;5(1):1536097.
136. Pérez de Llano LA, Cosío BG, Domingo C, Urrutia I, Bobolea I, Valero A, et al. Efficacy and Safety of Reslizumab in Patients with Severe Asthma with Inadequate Response to Omalizumab: A Multicenter, Open-Label Pilot Study. J Allergy Clin Immunol Pract. 2019 Jan 21. pii: S2213-2198(19)30069-8. [Epub ahead of print].
137. Bateman ED, Zangrilli J, Germinaro M, Castro M. Association between early improvements in lung function and asthma control with reslizumab and the annual rate of asthma exacerbations. Am J Respir Crit Care Med. 2016;193:A7782.
138. Teva announces top-line results from phase III studies of subcutaneously administered reslizumab in patients with severe eosinophilic asthma; 2018. Available from: http://www.tevapharm.com/news/teva_announces_top_line_results_from_phase_iii_studies_of_subcutaneously_administered_reslizumab_in_patients_with_severe_eosinophilic_asthma_01_18.aspx. Acessado em março de 2019.
139. Murphy K, Jacobs J, Bjermer L, Fahrenholz JM, Shalit Y, Garin M, et al. Long-term safety and efficacy of reslizumab in patients with eosinophilic asthma. J Allergy Clin Immunol Pract. 2017;5:1572-81 e3.
140. Bula CIQ-40891 CINQAIR Full PI v003 and Patient Information 8.5x11 eletronic.indd Disponível em: https://www.cinqair.com/globalassets/cinqair/prescribinginformation.pdf. Acesso em maio de 2019.
141. Korenblat P, Kerwin E, Leshchenko I, Yen K, Holweg CTJ, Anzures-Cabrera J, et al. Efficacy and safety of lebrikizumab in adult patients with mild-to-moderate asthma not receiving inhaled corticosteroids. Respir Med. 2018;134:143-9.
142. Trial NCT02104674 at http://www.clinicaltrials.gov.
143. Ziegler SF. The role of thymic stromal lymphopoietin (TSLP) in allergic disorders. Curr Opin Immunol. 2010; 22(6):795-9.
144. Study NCT03347279. ClinicalTrials.gov website.
145. Study NCT03406078. ClinicalTrials.gov website.
146. Study NCT03706079. ClinicalTrials.gov website.
147. Study NCT03688074. ClinicalTrials.gov website.
148. Leung DY, Bieber T. Atopic dermatitis. Lancet. 2003;361:151-60.
149. Seguchi T, Cui CY, Kusuda S, Takahashi M, Aisu K, Tezuka T. Decreased expression of filaggrin in atopic skin. Arch Dermatol Res. 1996;288:442-6.
150. Howell MD, Parker ML, Mustelin T, Ranade K. Past, present, and future for biologic intervention in atopic dermatitis. Allergy. 2015;70:887-96.
151. Ruzicka T, Hanifin JM, Furue M, Pulka G, Mlynarczyk I, Wollenberg A, et al. Anti-interleukin-31 receptor A antibody for atopic dermatitis. N Engl J Med. 2017;376:826-35.
152. Deleanu D, Nedelea I. Biological therapies for atopic dermatitis: An update. Exp Ther Med. 2019;17:1061-7.
153. Romano C, Sellitto A, De Fanis U, Balestrieri A, Savoia A, Abbadessa S, et al. Omalizumab for difficult-to-treat dermatological conditions: Clinical and immunological features from a retrospective real-life experience. Clin Drug Investig. 2015;35:159-68.
154. Wang HH, Li YC, Huang YC: Efficacy of omalizumab in patients with atopic dermatitis: A systematic review and meta-analysis. J Allergy Clin Immunol. 2016;138:1719-22.
155. Iyengar SR, Hoyte EG, Loza A, Bonaccorso S, Chiang D, Umetsu DT, et al. Immunologic effects of omalizumab in children with severe refractory atopic dermatitis: A randomized, placebo-controlled clinical trial. Int Arch Allergy Immunol.2013;162:89-93.
156. Beck LA, Thaçi D, Hamilton JD, Graham NM, Bieber T, Rocklin R, et al. Dupilumab treatment in adults with moderate-to-severe atopic dermatitis. N Engl J Med. 2014;371:130-9.
157. Simpson EL, Bieber T, Guttman-Yassky E, Beck LA, Blauvelt A, Cork MJ, et al. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med. 2016;375:2335-48.
158. Blauvelt A, de Bruin-Weller M, Gooderham M, Cather JC, Weisman J, Pariser D, et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, doubleblinded, placebo-controlled, phase 3 trial. Lancet (London, England). 2017;389:2287-303.
159. Wang C, Kraus CN, Patel KG, Ganesan AK, Grando SA. Real-world experience of dupilumab treatment for atopic dermatitis in adults: a retrospective analysis of patients' records. Int J Dermatol. 2019 Jul 8. doi: 10.1111/ijd.14573. [Epub ahead of print].
160. He JQ, Chan-Yeung M, Becker AB, Dimich-Ward H, Ferguson AC, Manfreda J, et al. Genetic variants of the IL13 and IL4 genes and atopic diseases in at-risk children. Genes Immun. 2003;4:385-9.
161. Tazawa T, Sugiura H, Sugiura Y, Uehara M. Relative importance of IL-4 and IL-13 in lesional skin of atopic dermatitis. Arch Dermatol Res. 2004;295:459-64.
162. Kim BE, Leung DY, Boguniewicz M, Howell MD. Loricrin and involucrin expression is down-regulated by Th2 cytokines through STAT-6. Clin Immunol. 2008;126:332-7.
163. Khattri S, Shemer A, Rozenblit M, Dhingra N, Czarnowicki T, Finney R, et al. Cyclosporine in patients with atopic dermatitis modulates activated inflammatory pathways and reverses epidermal pathology. J Allergy Clin Immunol. 2014;133:1626-34.
164. Ultsch M, Bevers J, Nakamura G, Vandlen R, Kelley RF, Wu LC, et al. Structural basis of signaling blockade by anti-IL-13 antibody lebrikizumab. J Mol Biol. 2013;425:1330-9.
165. Hanania NA, Noonan M, Corren J, Korenblat P, Zheng Y, Fischer SK, et al. Lebrikizumab in moderate-to-severe asthma: pooled data from two randomised placebo-controlled studies. Thorax. 2015;70:748-56.
166. Hanania NA, Korenblat P, Chapman KR, Bateman ED, Kopecky P, Paggiaro P, et al. Efficacy and safety of lebrikizumab in patients with uncontrolled asthma (LAVOLTA I and LAVOLTA II): replicate, phase 3, randomised, double-blind, placebo-controlled trials. Lancet Respir Med. 2016;4:781-96.
167. Simpson EL, Flohr C, Eichenfield LF, Bieber T, Sofen H, Taïeb A, et. al. Efficacy and safety of lebrikizumab (an anti-IL 13 monoclonal antibody) in adults with moderate to severe atopic dermatitis inadequately controlled by topical corticosteroids: A randomized, placebo-controlled phase II trial (TREBE). J Am Acad Dermatol. 2018;78(5):863-71.
168. May RD, Monk PD, Cohen ES, Manuel D, Dempsey F, Davis NH, et al. Preclinical development of CAT-354, an IL-13 neutralizing antibody, for the treatment of severe uncontrolled asthma. Br J Pharmacol. 2012;166:177-93.
169. Wollenberg A, Howell MD, Guttman-Yassky E, Silverberg JI, Kell C, Ranade K, et al. Treatment of atopic dermatitis with tralokinumab, an anti-IL-13 mAb. J Allergy Clin Immunol. 2019;143(1):135-41.
170. Bilsborough J, Leung DY, Maurer M, Howell M, Boguniewicz M, Yao L, et al. IL-31 is associated with cutaneous lymphocyte antigen-positive skin homing T cells in patients with atopic dermatitis. J Allergy Clin Immunol. 2006;117:418-25.
171. Kabashima K, Furue M, Hanifin JM, Pulka G, Wollenberg A, Galus R, et al. Nemolizumab in patients with moderate-to-severe atopic dermatitis: randomized, phase II, long-term extension study. J Allergy Clin Immunol. 2018;142:1121-30.
172. MiharaR, KabashimaK, FurueM, NakanoM, RuzickaT. Nemolizumab in moderate to severe atopic dermatitis: n exploratory analysis of workproductivity and activity impairment in a randomized phase II study. J Dermatol. 2019 Jun 5, doi: 10.1111/1346-8138.14934. [Epub ahead of print].
173. Peng W, Novak N. Recent developments in atopic dermatitis. Curr Opin Allergy Clin. 2014;14:417-22.
174. Guttman-Yassky E, Brunner PM, Neumann AU, Khattri S, Pavel AB, Malik K, et al. Efficacy and safety of fezakinumab (an IL-22 monoclonal antibody) in adults with moderate-to severe atopic dermatitis inadequately controlled by conventional treatments: a randomized, double-blind, phase 2a trial. J Am Acad Dermatol. 2018;78:872-81.
175. Khattri S, Brunner PM, Garcet S, Finney R, Cohen SR, Oliva M, et al. Efficacy and safety of ustekinumab treatment in adults with moderate-to-severe atopic dermatitis. Exp Dermatol. 2017;26:28-35.
176. Fernández-Antón Martínez MC, Alfageme Roldán F, Ciudad Blanco C, Suárez Fernández R. Ustekinumab in the treatment of severe atopic dermatitis: A preliminary report of our experience with 4 patients. Actas Dermosifiliogr. 2014;105:312-3.
177. Shroff A, Guttman-Yassky E. Successful use of ustekinumab therapy in refractory severe atopic dermatitis. JAAD Case Rep. 2014;1:25-6.
178. Saeki H, Kabashima K, Tokura Y, Murata Y, Shiraishi A, Tamamura R, et al. Efficacy and safety of ustekinumab in Japanese patients with severe atopic dermatitis: a randomized, double-blind, placebo-controlled, phase II study. Br J Dermatol. 2017;177:419-27.
179. Simpson EL, Parnes JR, She D, Crouch S, Rees W, Mo M, et al. Tezepelumab, an anti-thymic stromal lymphopoietin monoclonal antibody, in the treatment of moderate to severe atopic dermatitis: A randomized phase 2a clinical trial. J Am Acad Dermatol. 2019;80(4):1013-21.
180. Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, et al. The EAACI/GA2 LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. The 2017 revision and update. Allergy. 2018;73:1145-6.
181. Kocatürk E, Zuberbier T. New biologics in the treatment of urticaria. Curr Opin Allergy Clin Immunol. 2018;18:425-31.
182. Maurer M, Altrichter S, Bieber T, Biedermann T, Bräutigam M, Seyfried S, et al. Efficacy and safety of omalizumab in patients with chronic urticaria who exhibit IgE against thyroperoxidase. J Allergy Clin Immunol. 2011;128:202-5.
183. Maurer M, Rosén K, Hsieh H-J, Saini S, Grattan C, Gimenéz-Arnau A, et al. Omalizumab for the Treatment of Chronic Idiopathic or Spontaneous Urticaria. N Engl J Med. 2013;368:924-35.
184. Saini SS, Bindslev-Jensen C, Maurer M, Grob J-J, Bülbül Baskan E, Bradley MS, et al. Efficacy and safety of omalizumab in patients with chronic idiopathic/spontaneous urticaria who remain symptomatic on H1 antihistamines: a randomized, placebo-controlled study. J Invest Dermatol. 2015;135:67-75.
185. Kaplan A, Ledford D, Ashby M, Canvin J, Zazzali JL, Conner E, et al. Omalizumab in patients with symptomatic chronic idiopathic/spontaneous urticaria despite standard combination therapy. J Allergy Clin Immunol. 2013;132:101-9.
186. Ensina LF, Valle SOR, Juliani AP, Galeane M, Vieira dos Santos R, Arruda LK, et al. Omalizumab in Chronic Spontaneous Urticaria: A Brazilian Real-Life Experience. Int Arch Allergy Immunol. 2016;169:121-4.
187. Tharp MD, Bernstein JA, Kavati A, Ortiz B, MacDonald K, Denhaerynck K, et al. Benefits and Harms of Omalizumab Treatment in Adolescent and Adult Patients With Chronic Idiopathic (Spontaneous) Urticaria: A Meta-analysis of" Real-world" Evidence. JAMA Dermatol. 2019;155:29-38.
188. Har D, Patel S, Khan DA. Outcomes of using omalizumab for more than 1 year in refractory chronic urticaria. Ann Allergy Asthma Immunol. 2015;115:126-9.
189. Ensina LF, de Lacerda AE, Machado LM de O, Camelo-Nunes I, Sole D. Long-term omalizumab therapy for refractory chronic spontaneous urticaria: a real-life experience. Ann Allergy Asthma Immunol. 2015;115:536.
190. Ensina LF, Cusato-Ensina AP, Camelo-Nunes IC, Sole D. Omalizumab as Third-Line Therapy for Urticaria During Pregnancy. J Investig Allergol Clin Immunol. 2017;27:326-7.
191. Gericke J, Metz M, Ohanyan T, Weller K, Altrichter S, Skov PS, et al. Serum autoreactivity predicts time to response to omalizumab therapy in chronic spontaneous urticaria. J Allergy Clin Immunol. 2017;139:1059-61.
192. Maurer M, Metz M, Brehler R, Hillen U, Jakob T, Mahler V, et al. Omalizumab treatment in patients with chronic inducible urticaria: A systematic review of published evidence. J Allergy Clin Immunol. 2018;141:638-49.
193. Arm JP, Bottoli I, Skerjanec A, Floch D, Groenewegen A, Maahs S, et al. Pharmacokinetics, pharmacodynamics and safety of QGE031 (ligelizumab), a novel high-affinity anti-IgE antibody, in atopic subjects. Clin Exp Allergy. 2014;44(11):1371-85.
194. Maurer M, Gimenez-Arnau A, Sussman G, Loeffler J, Barve A, Severin T, et al. Ligelizumab as add on therapy for patients with H1 antihistamine refractory chronic spontaneous urticaria: Primary results of a placebo and active controlled phase 2b dose finding study. Allergy. 2018;73(S105):837.
195. ClinicalTrials.gov [Internet]. Bethesda (MD): National Library of Medicine (US). Disponível em: https://clinicaltrials.gov/ct2/results?term=ligelizumab&cond=Urticaria. Acessado em março de 2019.
196. Harris JM, Maciuca R, Bradley MS, Cabanski CR, Scheerens H, Lim J, et al. A randomized trial of the efficacy and safety of quilizumab in adults with inadequately controlled allergic asthma. Respir Res. 2016;17:29.
197. Harris JM, Cabanski CR, Scheerens H, Samineni D, Bradley MS, Cochran C, et al. A randomized trial of quilizumab in adults with refractory chronic spontaneous urticaria. J Allergy Clin Immunol. 2016;138:1730-2.
198. Bangsgaard N, Skov L, Zachariae C. Treatment of Refractory Chronic Spontaneous Urticaria with Adalimumab. Acta Dermato-Venereologica. 2017;97:524-5.
199. Wilson LH, Eliason MJ, Leiferman KM, Hull CM, Powell DL. Treatment of refractory chronic urticaria with tumor necrosis factor-alfa inhibitors. J Am Acad Dermatol. 2011;64:1221-2.
200. Magerl M, Philipp S, Manasterski M, Friedrich M, Maurer M. Successful treatment of delayed pressure urticaria with anti-TNF-α. J Allergy Clin Immunol. 2007;119:752-4.
201. Virkud VY, Wang J, Shreffler WG. Enhancing the Safety and Efficacy of Food Allergy Immunotherapy: a Review of Adjunctive Therapies. Clin Rev Allergy Immunol. 2018;55:172-89.
202. Burk CM, Dellon ES, Steele PH, Virkud YV, Kulis M, Burks AW, et al. Eosinophilic esophagitis during peanut oral immunotherapy with omalizumab. J Allergy Clin Immunol Pract. 2017;5(2):498-501.
203. Wood RA, Kim JS, Lindblad R, Nadeau K, Henning AK, Dawson P, et al. A randomized, double-blind, placebo-controlled study of omalizumab combined with oral immunotherapy for the treatment of cow's milk allergy. J Allergy Clin Immunol. 2016;137(4):1103-1110 e11.
204. Frischmeyer-Guerrerio PA, Masilamani M, Gu W, Brittain E, Wood R, Kim J, Nadeau K, et al. Mechanistic correlates of clinical responses to omalizumab in the setting of oral immunotherapy for milk allergy. J Allergy Clin Immunol. 2017;140(4):1043-53.e8.
205. Hill DA, Grundmeier RW, Ramos M, Spergel JM. Eosinophilic Esophagitis Is a Late Manifestation of the Allergic March. J Allergy Clin Immunol Pract. 2018; 6:1528-33.
206. Dellon ES, Liacouras CA, Molina-Infante J, Furuta GT, Spergel JM, Zevit N, et al. Updated International Consensus Diagnostic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE Conference. Gastroenterology. 2018;155:1022-33.
207. Ko E, Chehade M. Biological Therapies for Eosinophilic Esophagitis: Where Do We Stand? Clin Rev Allergy Immunol. 2018; 55:205-16.
208. Krause K, Metz M, Makris M, Zuberbier T, Maurer M. The role of interleukin-1 in allergy-related disordes. Curr Opin Allergy Clin Immunol. 2012;12:477-84.
209. Rothenberg ME, WenT, Greenberg A, Alpan O, Enav B, Hirano I, et al. Intravenous anti-IL-13 mAb QAX576 for the treatment of eosinophilic esophagitis. J Allergy Clin Immunol. 2015;135(2):500-7.
210. Sastre J, Davila I. Dupilumab: A New Paradigm for the Treatment of Allergic Diseases. J Investig Allergol Clin Immunol. 2018;28(3):139-50.
211. Simons FE, Ardusso LR, Bilò MB, El-Gamal YM, Ledford DK, Ring J, et al. World allergy organization guidelines for the assessment and management of anaphylaxis. World Allergy Organ J. 2011;4:13-37.
212. Castells M. Diagnosis and management of anaphylaxis in precision medicine. J Allergy Clin Immunol. 2017;140:321-3.
213. Bernd LA, Sá AB, Watanabe AS, Castro AP, Solé D, Castro FM, et al. Practical guide to the management of anaphylaxis - 2012. Rev Bras Alerg Imunopatol. 2012;35:53-70.
214. Lombardi C, Canonica GW, Passalacqua G. Allergen immunotherapy as add-on to biologic agents. Curr Opin Allergy Clin Immunol. 2018;502-8.
215. Galera C, Soohun N, Zankar N, Caimmi S, Gallen C, Demoly P. Severe anaphylaxis to bee venom immunotherapy: efficacy of pretreatment and concurrent treatment with omalizumab. J Investig Allergol Clin Immunol. 2009;19:225-9.
216. Palgan K, Bartuzi Z, Gotz-Zbikowska M. Treatment with a combination of omalizumab and specific immunotherapy for severe anaphylaxis after a wasp sting. Int J Immunopathol Pharmacol. 2014;27:109-12.
217. Christensen MJ, Bindslev-Jensen C. Successful treatment with omalizumab in challenge confirmed exercise-induced anaphylaxis. J Allergy Clin Immunol Pract. 2017;5:204-6.
218. Ojaimi S, Harnett PR, Fulcher DA. Successfull carboplatin desensitization by using omalizumab and paradoxical diminution of total IgE levels. J Allergy Clin Immunol Pract. 2014;2:105-6.
219. Burguete-Cabanas MT, Fajardo-Ramirez OR, Yesaki R, Estrada-Maganas R, Salazar-Meza S, Rios-Chavez O, et al. Omalizumab for hypersensitive reaction to seminal plasma: a case report. Allergol Int. 2018;67:278-9.
220. Solé D, Silva LR, Cocco RR, Ferreira CT, Sarni RO, Oliveira LC, et al. Consenso Brasileiro sobre alergia alimentar: 2018-Parte 2-Diagnóstico, tratamento e prevenção. Arq Asma Alerg Immunol. 2018;2:39-82.
221. Bégin P, Dominguez T, Wilson SP, Bacal L, Mehrotra A, Kausch B, et al. Phase 1 results of safety and tolerability in a rush oral immunotherapy protocol to multiple foods using Omalizumab. Allergy Asthma Clin Immunol. 2014;10:7.
222. Casale TB. Status of immunotherapy: current and future. J Allergy Clin Immunol. 2004;113:1036-9.
223. Casale TB, Busse WW, Kline JN, Ballas ZK, Moss MH, Townley RG, et al. Omalizumab pretreatment decreases acute reactions after rush immuntherapy for ragweed-induced seasonal allergic rhinitis. J Allergy Clin Immunol. 2006;117:134-40.
224. Stelmach I, Majak P, Jerzynska J, Bojo M, Cichalewski L, Smejda K. Children with severe asthma can start allergen immunotherapy after controlling asthma with omalizumab:a case series from Poland. Arch Med Sci. 2015;11:901-4.
225. Broesby-Olsen S, Vestergaard H, Mortz CG, Jensen B, Havelund T, Hermann AP, et al. Omalizumab prevents anaphylaxis and improves symptoms in systemic mastocytosis; efficacy and safety observations. Allergy. 2018;73:230-8.
226. Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, et al. EPOS 2012: European position paper on rhinosinusitis and nasal polyps 2012:a summary for otorhinolaryngologists. Rhinology. 2012;50:1-12.
227. Liao B, Liu J-X, Li Z-Y, Zhen Z, Cao P-P, et al. Multidimensional endotypes of chronic rhinosinusitis and their association with treatment outcomes. Allergy. 2018;73:1459-69.
228. Cho SH, Bachert C, Lockey RF. Chronic rhinosinusitis phenotypes: an approach to better medical care for chronic rhinosinusitis. J Allergy Clin Immunol Pract. 2016;4:639-42.
229. Cho SW, Kim DW, Kim J-W, Lee CH, Rhee C-S. Classification of chronic rhinosinusitis according to a nasal polyp and tissue eosinophilia: limitation of current classification system for Asian population. Asia Pac Allergy. 2017;7:121-30.
230. Zhang Y, Gevaert E, Lou H, Wang X, Zhang L, Bachert C, Zhang N. Chronic rhinosinusitis in Asia. J Allergy Clin Immunol. 2017;140:1230-9.
231. Smith KA, Pulsipher A, Grabrielsen DA, Alt JA. Biologics in Chronic Rhinosinusitis: an update and thoughts for future directions. Am J Rhinol Allergy. 2018;32(5):412-23.
232. Kim DW, Cho SH. Emerging endotypes of chronic rhinosinusitis and its application to precision medicine. Allergy Asthma Immunol Res. 2017;9(4):299-306.
233. Schleimer RP. Immunopathogenesis of chronic rhinosinusitis and nasal polyposis. Annu Rev Pathol. 2017;12:331-57.
234. Poposki JA, Klinger AI, Tan BK, Soroosh P, Banie H, Lewis G, et al. Group 2 innate lymphoid cells are elevated and activated in chronic rhinosinusitis with nasal polyps. Immun Inflamm Dis. 2017;5(3):233-43.
235. Gurrola II J, Borish L. Chronic rhinosinusitis: endotypes, biomarkers, and treatment response. J Allergy Clin Immunol. 2017;140:1499-508.
236. Bachert C, Gevaert P, Hellings P. Biotherapeutics in chronic rhinosinusitis with and without nasal polyps. J Allergy Clin Immunol Pract. 2017;5(6):1512-6.
237. Pinto JM, Mehta N, DiTineo M, Wang J, Baroody FM, et al. A randomized, double blind, placebo-controlled trial of anti-IgE for chronic rhinosinusitis. Rhinology. 2010;48:318-24.
238. Gevaert P, Calus L, ZeleTV, Blomme K, De Ruyck N, Bauters W, et al. Omalizumab is effective in allergic and nonallergic patients with nasal polyps and asthma. J Allergy Clin Immunol 2013;131:110-6.
239. Bidder T, Sahota J, Rennie C, Lund VJ, Robinson DS, Kariyawasam HH. Omalizumab treats chronic rhinosinusitis with nasal polyps and asthma together - a real life study. Rhinology. 2018;56:42-5.
240. Massachusetts General Hospital and Genentech, Inc. Subcutaneous omalizumab for treatment of chronic rhinosinusitis with nasal polyps. ClinicalTrials.gov website. Disponível em: https://clinicaltrials.gov/ ct2/show/NCT01066104. Acesso em abril de 2019.
241. Hoffmann-La Roche. A clinical trial of omalizumab in participants with chronic rhinosinusitis with nasal polyps (POLYP 1). ClinicalTrials. gov website. Disponível em: https://clinicaltrials.gov/ct2/show/NCT03280550. Acesso em abril de 2019.
242. Hoffmann-La Roche. A clinical trial of omalizumab in participants with chronic rhinosinusitis with nasal polyps (POLYP 2). ClinicalTrials. gov website. Disponível em: https://clinicaltrials.gov/ct2/show/NCT03280537. Acesso em abril de 2019.
243. Hoffmann-La Roche. An extension study of omalizumab in participants with chronic rhinosinusitis with nasal polyps. ClinicalTrials.gov website. https://clinicaltrials.gov/ct2/show/NCT03478930. Acesso em abril de 2019.
244. Para AJ, Clayton E, Peters AT. Management of rhinosinusitis: an evidence based approach. Curr Opin Allergy Clin Immunol. 2016;16(4):383-9.
245. Gevaert P, Lang-Loidolt D, Lackner A, Stammberger H, Staudinger H, Van Zele T, et al. Nasal IL-5 levels determine the response to anti-IL-5 treatment in patients with nasal polyps. J Allergy Clin Immunol. 2006;118;1133-41.
246. Weinstein SF, Katial RK, Bardin P, Korn S, McDonald M, Garin M, et al. Effects of reslizumab on asthma outcomes in a subgroup of eosinophilic asthma patients with self-reported chronic rhinosinusitis with nasal polyps. J Allergy Clin Immunol Pract. 2019;7:589-96.
247. Tuttle KL, Buchheit KM, LaidlawTM, Cahill KN. A retrospective analysis of mepolizumab in subjects with aspirin-exacerbated respiratory disease. J Allergy Clin Immunol Pract. 2018;6(3):1045-7.
248. Bachert C, Sousa AR, Lund VJ, Scadding GK, Gevaert P, Nasser S, et al. Reduced need for surgery in severe nasal polyposis with mepolizumab: randomized trial. J Allergy Clin Immunol. 2017;140:1024-1031.e14.
249. Hagin D, ShachamY, Kivity S, Benor S. Mepolizumab for the treatment of aspirin-exacerbated respiratory disease associated with coronary spasm. J Allergy Clin Immunol Pract. 2019;7(3):1076-7.
250. Bleecker ER, Wechsler ME, FitzGerald JM, Menzies-Gow A, Wu Y, Hirsch I, et al. Baseline patient factors impact on the clinical efficacy of benralizumab for severe asthma. Eur Respir J. 2018;52:1800936.
251. Kyowa Hakko Kirin. Study of benralizumab (KHK4563) in patients with eosinophilic chronic rhinosinusitis. ClinicalTrials.gov website. Disponível em: https://clinicaltrials.gov/ct2/show/NCT02772419. Acesso abril de 2019.
252. AstraZeneca. Efficacy and safety study of benralizumab for patients with severe nasal polyposis (OSTRO). ClinicalTrials.gov website. Disponível em: https://clinicaltrials.gov/ct2/show/NCT03401229. Acesso em abril de 2019.
253. Chanez P, McDonald M, Garin M, Murphy K. Early decreases in blood eosinophil levels with reslizumab. J Allergy Clin Immunol. 2019;143:1653-5.
254. PhamT-H, Damera G, Newbold P, Ranade K. Reductions in eosinophil biomarkers by benralizumab in patients with asthma. Respir Med. 2016;111:21-9.
255. Flood-Page P, Swenson C, Faiferman I, Matthews J, Williams M, Brannick L, et al, A study to evaluate safety and efficacy of mepolizumab in patients with moderate persistent asthma. Am J Respir Crit Care Med. 2007;176:1062-107.
256. US Food and Drugs Administration. FDA approves first treatment for chronic rhinosinusitis with nasal polyps. Disponível em: www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-chronic-rhinosinusitis-nasal-polyps. Acesso em junho de 2019.
257. Bachert C, Mannent L, Naclerio RM, Mullol J, Ferguson BJ, Gevaert P, et al. Effect of subcutaneous dupilumab on nasal polyp burden in patients with chronic sinusitis and nasal polyposis: a randomized clinical trial. JAMA. 2016;315:469-79.
258. Bachert C, Hellings PW, Mullol J, Naclerio RM, Chao J, Amin N, et al. Dupilumab improves patient reported outcomes in patients with chronic rhinosinusitis with nasal polyps and comorbid asthma. J Allergy Clin Immunol. 2019;doi: https://doi.org/10.1016/j.jaip.2019.03.023.
259. Jonstam K, Swanson BN, Mannent LP, Cardell L-O, Tian N, et al. Dupilumab reduces local type 2 pro-inflammatory biomarkers in chronic rhinosinusitis with nasal polyposis. Allergy. 2019;74:743-52.
260. Liao B, Cao P-P, Zeng M, Zhen Z, Wang H, Zhang YN, et al. Interation of thymic stromal lymphopoietin, IL-33, and their receptors in epithelial cells in eosinophilic chronic rhinosinusitis with nasal polyps. Allergy. 2015;70:1169-80.
261. AnaptysBio, Inc. Etokimab in adults patients with chronic rhinosinusitis with nasal polyps (CRSwNP). ClinicalTrials.gov website. Disponível em: https://clinicaltrials.gov/ct2/show/NCT03614923. Acesso em abril de 2019.
262. Picard C, Bobby Gaspar H, Al-Herz W, Bousfiha A, Casanova JL, Chatila T, et al. International Union of Immunological Societies: 2017 Primary Immunodeficiency Diseases Committee Report on Inborn Errors of Immunity. J Clin Immunol. 2018;38:96-128.
263. Kilic SS, Kilicbay F. Interferon-alpha treatment of molluscum contagiosum in a patient with hyperimmunoglobulin E syndrome, Pediatrics. 2006;117:e1253-1255.
264. Al-Zahrani D, Raddadi A, Massaad M, Keles S, Jabara HH, ChatilaTA, et al. Successful interferon-alpha 2b therapy for unremitting warts in a patient with DOCK8 deficiency, Clin Immunol. 2014:153:104-8.
265. Böhm M, Luger TA, Bonsmann G. " Disseminated giant molluscum contagiosum in a patient with idiopathic CD4+ lymphocytopenia. Dermatology. 2008;217(3):196-8.
266. Lafaille FG, Pessach IM, Zhang SY, Ciancanelli MJ, Herman M, Abhyankar A, et al. Impaired intrinsic immunity to HSV-1 in human iPSC-derived TLR3-deficient CNS cells. Nature. 2012;491:769-73.
267. International Chronic Granulomatous Disease Cooperative Study Group. A controlled trial of interferon gamma to prevent infection in chronic granulomatous disease. N Engl J Med.1991;324(8):509-16.
268. Alangari AA, Al-Zamil F, Al-Mazrou A, Al-Muhsen S, Boisson-Dupuis S, Awadallah S, et al. Treatment of disseminated mycobacterial infection with high-dose IFN-gamma in a patient with IL-12Rbeta1 deficiency, Clin Dev Immunol. 2011;2011:691956.
269. Remiszewski P, Roszkowska-Sliz B, Winek J, Chapgier A, Feinberg J, Langfort R, et al. Disseminated Mycobacterium avium infection in a 20-year-old female with partial recessive IFNgammaR1 deficiency, Respiration. 2006; 73:375-8.
270. Marchand, I, Mahe E, Clerici T, Saiag P, Chevallier B. Disseminated BCG infection revealing X-linked severe combined immunodeficiency, Ann Dermatol Venereol. 2008;135:587-90.
271. Orange JS, Roy-Ghanta S, Mace EM, Maru S, Rak GD, Sanborn KB, et al. IL-2 induces a WAVE2-dependent pathway for actin reorganization that enables WASp-independent human NK cell function, J Clin Invest. 2011;121:1535-48.
272. Cunningham-Rundles C, Bodian C, Ochs HD, Martin S, Reiter-Wong M, Zhuo Z. Long-term low-dose IL-2 enhances immune function in common variable immunodeficiency, Clin Immunol. 2001;100:181-90.
273. Regent A, Autran B, Carcelain G, Cheynier R, Terrier B, Charmeteau-De Muylder B, et al. French Idiopathic CD4T Lymphocytopenia Study Group, Idiopathic CD4 lymphocytopenia: clinical and immunologic characteristics and follow-up of 40 patients. Medicine (Baltimore). 2014;93:61-72.
274. Orange JS, Brodeur SR, Jain A, Bonilla FA, Schneider LC, Kretschmer R, et al. Deficient natural killer cell cytotoxicity in patients with IKK-gamma/NEMO mutations. J Clin Invest. 2012;109:1501-9.
275. Chase NM, Verbsky JW, Hintermeyer MK, Waukau JK, Tomita-Mitchell A, Casper JT, et al. Use of combination chemotherapy for treatment of granulomatous and lymphocytic interstitial lung disease (GLILD) in patients with common variable immunodeficiency (CVID). J Clin Immunol. 2013;33:30-9.
276. Hennig C, Baumann U, Ilginus C, Horneff G, Foell J, Hansen G. Successful treatment of autoimmune and lymphoproliferative complications of patients with intrinsic B-cell immunodeficiencies with Rituximab. Br J Haematol. 2010;148:445-8.
277. Milone MC, Tsai DE, Hodinka RL, Silverman LB, Malbran A, Wasik MA, et al. Treatment of primary Epstein-Barr virus infection in patients with X-linked lymphoproliferative disease using B-cell-directed therapy. Blood. 2005; 105:994-6.
278. Pathak S, McDermott MF, Savic S. Autoinflammatory diseases: update on classification diagnosis and management. J Clin Pathol. 2017;70:1-8.
279. Havnaer A, Han G. Autoinflammatory disorders: a review and update on pathogenesis and treatment. Am J Clin Dermatol. 2019;20(4):539-64.
280. Lo B, Zhang K, Lu W, Zheng L, Zhang Q, Kanellopoulou C, et al. Autoimmune Disease. Patients with LRBA deficiency show CTLA4 loss and immune dysregulation responsive to abatacept therapy. Science. 2015;349:436-40.
281. Milner JD, Vogel TP, Forbes L, Ma CA, Stray-Pedersen A, Niemela JE, et al. Early-onset lymphoproliferation and autoimmunity caused by germline STAT3 gain-of function mutations. Blood. 2015;125:591-9.
282. Forbes LR, Vogel TP, Cooper MA, Castro-Wagner J, Schussler E, Weinacht KG, et al. Jakinibs for the treatment of immune dysregulation in patients with gain-of-function signal transducer and activator of transcription 1 (STAT1) or STAT3 mutations. J Allergy Clin Immunol. 2018;142:1665-9.
283. Moutsopoulos NM, Zerbe CS, Wild T, Dutzan N, Brenchley L, DiPasquale G, et al. Interleukin-12 and interleukin-23 blockade in leukocyte adhesion deficiency type 1. N Engl J Med. 2017;37(12):1141-6.
284. Seidel MG, Kindle G, Gathmann B, Quinti I, Buckland M, van Montfrans J, et al. The European Society for Immunodeficiencies (ESID) Registry Working Definitions for the Clinical Diagnosis of Inborn Errors of Immunity. J Allergy Clin Immunol Pract. 2019;7(6):1763-70.
285. Goudouris ES, Rego Silva AM, Ouricuri AL, Grumach AS, Condino-Neto A, Costa-Carvalho BT, et al. II Brazilian Consensus on the use of human immunoglobulin in patients with primaryimmunodeficiencies. Einstein (Sao Paulo). 2017;15(1):1-16.
286. Condino-Neto A, Costa-Carvalho BT, Grumach AS, King A, Bezrodnik L, Oleastro M, et al. Guidelines for the use of human immunoglobulin therapy in patients with primary immunodeficiencies in Latin America. Allergol Immunopathol (Madr). 2014;42(3):245-60.
287. Wasserman RL. Recombinant human hyaluronidase-facilitated subcutaneous immunoglobulin infusion in primary immunodeficiency diseases. Immunotherapy. 2017;9(12):1035-50.
288. Wasserman RL, Melamed I, Kobrynski L, Puck J, Gupta S, Doralt J, et al. Recombinant human hyaluronidase facilitated subcutaneous immunoglobulin treatment in pediatric patients with primary immunodeficiencies: long-term efficacy, safety and tolerability. Immunotherapy. 2016;8(10):1175-86.
289. Wasserman RL, Melamed IR, Stein MR, Jolles S, Norton M, Moy JN, et al. Evaluation of the Safety, Tolerability, and Pharmacokinetics of Gammaplex® 10% Versus Gammaplex® 5% in Subjects with Primary Immunodeficiency. J Clin Immunol. 2017;37(3):301-10.
290. Wasserman RL, Melamed I, Stein MR, Engl W, Sharkhawy M, Leibl H, et al. Long-term tolerability, safety, and efficacy of recombinant human hyaluronidase-facilitated subcutaneous infusion of human immunoglobulin for primary immunodeficiency. J Clin Immunol. 2016;36(6):571-82.
291. Costa-Carvalho BT, Grumach AS, Franco JL, Espinosa-Rosales FJ, Leiva LE, King A, et al. Attending to warning signs of primary immunodeficiency diseases across the range of clinical practice. J Clin Immunol. 2014;34(1):10-22.
292. Giavina-Bianchi P, Arruda LK, Aun MV, Campos RA, Chong-Neto HJ, Constantino-Silva RN, et al. Brazilian Guidelines for Hereditary Angioedema Management - 2017 Update Part 1: Definition, Classification and Diagnosis. Clinics. 2018;73:e310.
293. Zuraw BL. Hereditary angioedema with normal C1 inhibitor: four types and counting. J Allergy Clin Immunol. 2018;141:884-5.
294. Germenis AE, Speletas M. Genetics of hereditary angioedema revisited. Clin Rev Allergy Immunol. 2016;51:170-82.
295. Kaplan AP, Joseph K. Complement, kinins, and hereditary angioedema: mechanisms of plasma instability when C1 inhibitor is absent. Clin Rev Allergy Immunol. 2016;51:207-15.
296. Maurer M, Magerl M, Ansotegui I, Aygören-Pürsün E, Betschel S, Bork K, et al. The international WAO/EAACI guideline for the management of hereditary angioedema - The 2017 revision and update. Allergy. 2018;73:1575-96.
297. Perego F, Wu MA, Valerieva A, Caccia S, Suffritti C, Zanichelli A, et al. Expert Opin Biol Ther. 2019 Mar 26:1-10. doi: 10.1080/14712598.2019.1595581 [Epub ahead of print].
298. Giavina-Bianchi P, Arruda LK, Aun MV, Campos RA, Solé D, Grumach AS, et al. Diretrizes Brasileiras para o diagnóstico e tratamento do angioedema hereditário - 2017. Arq Asma Alerg Imunol. 2017;1:23-48.
299. Craig T, Zuraw B, Longhurst H, Cicardi M, Bork K, Grattan C, et al. Long-Term Outcomes with Subcutaneous C1-Inhibitor Replacement Therapy for Prevention of Hereditary Angioedema Attacks. J Allergy Clin Immunol Pract. 2019 Feb 15. pii: S2213-2198(19)30163-1.
300. Banerji A, Riedl MA, Bernstein JA, Cicardi M, Longhurst HJ, Zuraw BL, et al. Effect of Lanadelumab compared with placebo on prevention of hereditary angioedema attacks, a randomized clinical trial. JAMA. 2018;320(20):2108-21.
301. Cicardi M, Banerji A, Bracho F, Malbrán A, Rosenkranz B, Riedl M, et al. Icatibant, a new bradykinin-receptor antagonist, in hereditary angioedema. N Engl J Med. 2010;363:532-41.
302. Malbran A, Riedl M, Ritchie B, Smith WB, Yang W, Banerji A, et al. Repeat treatment of acute hereditary angioedema attacks with open-label icatibant in the FAST-1 trial. Clin Exp Immunol. 2014;177:544-53.
303. Lumry WR, Li HH, Levy RJ, Potter PC, Farkas H, Moldovan D, et al. Randomized placebo-controlled trial of the bradykinin B(2) receptor antagonist icatibant for the treatment of acute attacks of hereditary angioedema: the FAST-3 trial. Ann Allergy Asthma Immunol. 2011;107:529-37.
304. Maurer M, Aberer W, Bouillet L, Caballero T, Fabien V, Kanny G, et al. hereditary angioedema attacks resolve faster and are shorter after early icatibant treatment. PLoS ONE. 2013; 8 e53773.
305. Farkas H, Reshef A, Aberer W, Caballero T, McCarthy L, Hao J, et al. Treatment effect and safety of icatibant in pediatric patients with hereditary angioedema. J Allergy Clin Immunol Pract. 2017;5:1671-8.
306. Otani IM, Lumry WR, Hurwitz S, Li HH, Craig TJ, Holtzman NS, et al. Subcutaneous icatibant for the treatment of hereditary angioedema attacks: comparison of home self-administration with administration at a medical facility. J Allergy Clin Immunol Pract. 2017;5:442-7.
307. Craig TJ, Levy RJ, Wasserman RL, Bewtra AK, Hurewitz D, Obtulowicz K, et al. Efficacy of human C1 esterase inhibitor concentrate compared with placebo in acute hereditary angioedema attacks. J Allergy Clin Immunol. 2009;124:801-8.
308. Craig TJ, Bewtra AK, Bahna SL, Hurewitz D, Schneider LC, Levy RJ, et al. C1 esterase inhibitor concentrate in 1085 Hereditary Angioedema attacks - final results of the I. M. P. A. C. T.2 study. Allergy. 2011;66:1604-11.
309. Zuraw BL, Busse PJ, White M, Jacobs J, Lumry W, Baker J, et al. Nanofiltered C1 inhibitor concentrate for treatment of hereditary angioedema. N Engl J Med. 2010;363:513-22.
310. Zanichelli A, Azin GM, Cristina F, Vacchini R, Caballero T. Safety, effectiveness, and impact on quality of life of self-administration with plasma-derived nanofiltered C1 inhibitor (Berinert(R)) in patients with hereditary angioedema: the SABHA study. Orphanet J Rare Dis. 2018;13(1):51.
311. Longhurst H, Cicardi M, Craig T, Bork K, Grattan C, Baker J, et al. Prevention of hereditary angioedema attacks with a subcutaneous C1 inhibitor. N Engl J Med. 2017;376:1131-40.
312. Zuraw B, Cicardi M, Levy RJ, Nuijens JH, Relan A, Visscher S, et al. Recombinant human C1-inhibitor for the treatment of acute angioedema attacks in patients with hereditary angioedema. J Allergy Clin Immunol. 2010;126:821-7.
313. Riedl MA, Bernstein JA, Li H, Reshef A, Lumry W, Moldovan D, et al. Recombinant human C1-esterase inhibitor relieves symptoms of hereditary angioedema attacks: phase 3, randomized, placebo-controlled trial. Ann Allergy Asthma Immunol. 2014;112:163-9.
314. Reshef A, Moldovan D, Obtulowicz K, Leibovich I, Mihaly E, Visscher S, et al. Recombinant human C1 inhibitor for the prophylaxis of hereditary angioedema attacks: a pilot study. Allergy. 2013;68(1):118-24.
315. Riedl MA, Grivcheva-Panovska V, Moldovan D, Baker J, Yang WH, Giannetti BM, et al. Recombinant human C1 esterase inhibitor for prophylaxis of hereditary angio-oedema: a phase 2, multicentre, randomised, double-blind, placebo-controlled crossover trial. Lancet. 2017;390(10102):1595-602.
316. Li HH, Moldovan D, Bernstein JA, Reshef A, Porebski G, Stobiecki M, et al. Recombinant human-c1 inhibitor is effective and safe for repeat hereditary angioedema attacks. J Allergy Clin Immunol Pract. 2015;3(3):417-23.
317. Cicardi M, Levy RJ, McNeil DL, Li HH, Sheffer AL, Campion M, et al. Ecallantide for the treatment of acute attacks in hereditary angioedema. N Engl J Med. 2010;363:523-31.
318. Sheffer AL, Campion M, Levy RJ, Li HH, Horn PT, Pullman WE. Ecallantide (DX-88) for acute hereditary angioedema attacks: integrated analysis of 2 double-blind, phase 3 studies. J Allergy Clin Immunol. 2011;128:153-4.
319. Roth-Walter F, Adcock IA, Benito-Villalvilla C, Bianchini R, Bjermer L, Caramori G, Cari L, et al. Comparing biologicals and small molecule drug therapies for chronic respiratory diseases: An EAACI Taskforce on Immunopharmacology position paper. Allergy. 2019;74:432-48.
320. Mauger D, Apter AJ. Indirect treatment comparisons and biologics. J Allergy Clin Immunol. 2019;143:84-6.
321. Bauer RN, Monohar M, Singh AM, Jay DC, Nadeau KC. The Future of Biologics: Application for food allergy. J Allergy Clin Immunol. 2015;135:312-23.
322. Makris M, Papadavid E, Zuberbier T. The use of biologicals in cutaneous allergies - present and future. Curr Opin Allergy Clin Immunol. 2014;14:409-16.
323. Joly P, Mouquet H, Roujeau JC, D'Incan M, Gilbert D, Jacquot S, et al. A single cycle of rituximab for the treatment of severe pemphigus. N Engl J Med. 2007;357:545-52.
324. MabThera® (rituximabe) - Roche - Bula. Disponível em: http://www.anvisa.gov.br/datavisa/fila_bula/frmVisualizarBula.asp?pNuTransacao=19730032016&pIdAnexo=3645535. Acesso em junho 2019.
325. Arkwright PD. Anti-CD20 or anti-IgE therapy for severe chronic autoimmune urticarial. J Allergy Clin Immunol. 2009;123:510-1.
326. 326 Chakaravarty SD, Yee AF, Paget SA. Rituximab successfully treats refractory chronic autoimmune urticarial causes by IgE receptor autoantibodies. J Allergy Clin Immunol. 2011;128:1354-5.
327. Combalia A, Losno RA, Prieto-González S, Mascaró JM. Rituximab in Refractory Chronic Spontaneous Urticaria: an encouraging therapeutic approach. Skin Pharmacol Physiol. 2018;31:184-7.
328. Mallipeddi R, Grattan CE. Lack of response of severe steroid-dependent chronic urticarial to rituximab. Clin Exp Dermatol. 2007;32:333-4.
329. Kocatürk E, Maurer M, Metz M, Grattan C. Looking forward to new targeted treatments for chronic spontaneous urticarial. Clin Transl Allergy. 2017;7:1.
330. Gery I, Gershon RK, Waksman BH. Potentation of T-lymphocyte response to mitogens I. The responding cell. J Exp Med. 1972;136:128-42.
331. Gery I, Waksman BH. Potentation of T-lymphocyte response to mitogens II. The cellular source of potentating mediator(s). J Exp Med. 1972;136:143-55.
332. Dinarello CA, Renfer L, Wolff SM. Human leukocytic pyrogen:purification and development of a radioimmunoassay. Proc Nati Acad Sci USA. 1977;74:4624-7.
333. Dinarello CA. Immunological and inflammatory functions of the interleukin-1 family. Annu Rev Immunol. 2009;27:519-50.
334. Kineret, INN-anakinra - Europa EU - Bula. Disponível em: https://ec.europa.eu/health/documents/community-register/2016/20160602135155/anx_135155_pt.pdf. Acesso em junho de 2019.
335. Mitroulis I, Papadopoulos VP, Kostantinidis T, Ritis K. Anakinra supresses familial Mediterranean fever crises in a colchicine-resistant patient. Neth J Med. 2008;66:489-91.
336. de Koning HD, Bodar EJ, Simon A, van der Hilst JC, Netea MG, van der Meer JW. Beneficial response to anakinra and thalidomide in Schnitzler's syndrome. Ann Rheum Dis. 2006;65:542-4.
337. Bodar EJ, van der Hilst JC, Drenth JP, van der Meer JW, Simon A. Effect of etarnecept and anakinra on inflammatory attacks in the hyper-IgD syndrome: introducing a vaccination provocation model. Neth J Med. 2005;63:260-4.
338. Simon A, Bodar EJ, van der Hilst JC, van der Meer JW, Fiselier TJ, Cuppen MP, et al. Beneficial response to interleukin 1 receptor antagonist in traps. Am J Med. 2004;117:208-10.
339. Bodar EJ, Simon A, Visser M, van der Meer JW. Complete remission of severe idiopathic cold urticarial on intrleukin-I receptor antagonist (anakinra). Neth J Med. 2009;67:302-5.
340. Hsu LC, Ali SR, Mc Gillivay S, Tseng PH, Mariathasan S, Humke EW, et al. A NOD2-NALP1 complex mediates caspase-1-dependent IL-1beta secretion in response to Bacillus anthracis infection and muramyl dipeptide. Proc Nat Acad Sci USA. 2008;105:7803-8.
341. Gross O, Poeck H, Bscheider M, Dostert C, Hannesschläger N, Endres S, et al. Syk kinase signalling couples to the NIrp3 inflamasome for antifungal host defence. Nature. 2009;459:433-6.
342. Kanneganti TD, Body-Malapel M, Amer A, Park JH, Whitfield J, Franchi L, et al. Critical role for Cryopyrin/Nalp3 in activation of caspase-1 in response to viral infection and double-stranded RNA. J Biol Chem. 2006;281:36560-8.
343. Ilaris - Anvisa - Bula. Disponível em: http://www.anvisa.gov.br/datavisa/fila_bula/frmVisualizarBula.asp?pNuTransacao=17991412017&pIdAnexo=9080022. Acesso em junho de 2019.
344. Lenormand C, Lispker D. Efficiency of interleukin-1 blockade in refractory delayed-pressure urticarial. Ann Intern Med. 2012;157:599-600.
345. Rilonacept (Professional Patient Advice) - Drugs.com - Bula. Disponível em:https://www.drugs.com/ppa/rilonacept.html. Acesso em junho de 2019.
346. Liu L, Okada S, Kong X-F, Kreins AY, Cypowyj S, Abhyankar A, et al. Gain-of-function human STAT1 mutations impair IL-17 immunity and underlie chronic mucocutaneous candidiasis. J Exp Med. 2011; 208:1635-48.
347. Vargas-Hernández A, Mace EM, Zimmerman O, Zerbe CS, Freeman AF, Rosenzweig S, et al. Ruxolitinib partially reverses functional natural killer cell deficiency in patients with signal transducer and activator of transcription 1 (STAT1) gain-of-function mutations. J Allergy Clin Immunol. 2018;141:2142-55.
348. Clinical Trials: NIH: U. S. National Library of Medicine Disponível em: http://www.clinicaltrials.gov. Acesso em maio de 2019.
349. O'Callaghan J, Barry SP, Bermingham M, Morris JM, Griffin BT. Regulation of biosimilar medicines and current perspectives on interchangeability and policy. Eur J Clin Pharmacol. 2019;75:1-11.
350. Daller J. Biosimilars: a consideration of the regulation in the United States and European Union. Regul Toxicol Pharmacol. 2016;76:199-208.
351. Bonovas S, Peyrin-Biroulet L, Danese S. Clinical development of biologicals and biosimilars - safey concerns. Exp Rev Clin Pharmacol. 2017;10:567-9.
352. Ferrando M, Bagnasco D, Braido F, Varricchi G, Canonica GW. Biosimlars in allergic diseases. Curr Opin Allergy Clin Immunol. 2016;16:68-73.
353. 353 European Medicines Agency (EMA). Committee for Medicinal Products for Human Use. Guideline on similar biological medicinal products. Disponível em: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2014/10/WC500176768.pdf. Acesso em maio de 2019.
354. Food and Drug Administration (FDA). Quality considerations in demonstrating biosimilarity of a therapeutic protein product to a reference product, guidance for industry. Disponível em: http://www.fda.downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm291134.pdf. Acesso em maio de 2019.
355. Bui LA, Hurst S, Finch GL, Ingram B, Jacobs IA, Kirchhoff CF, et al. Key considerations in the preclinical development of biosimilars. Drug Discov Today. 2015; 20(Suppl 1):3.
356. European Medicines Agency (EMA). Committee for Medicinal Products for Human Use. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non clinical and clinical issues. Disponível em: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/01/WC500180219.pdf. Acesso em maio de 2019.
357. Weise M, Bielsky MC, De Smet K, Ehmann F, Ekman N, Giezen TJ, et al. Biosimilars: what clinicians should know. Blood. 2012;120:5111-7.
358. Weise M, Kurki P, Wolff-Holz E, Bielsky MC, Schneider CK. Biosimilars: the science of extrapolation. Blood. 2014;124:3191-6.
359. World Health Organization Guidelines on evaluation of similar biotherapeutic products (SBPs) 2009. Disponível em:http://www.who.int/biologicals/areas/biological_therapeutics/BIOTHERAPEUTICS_FOR_WEB_22APRIL2010.pdf. Acesso em maio de 2019.
360. ICH HarmonisedTripartite Guideline. Specifications:test procedures and acceptance criteria for biotechnological/biological products Q6B.1999. Disponível em:http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002824.pdf. Acesso em maio de 2019.
361. Cauchi R. State laws and legislation related to biologics medications and substitution of biosimilars (2018). Disponível em:http://www.ncsl.org/research/health/state-laws-and-legislation-related-to-biologic-medications-and-substitution-of-biosimilars.aspx. Acesso em maio/2019.
362. Cohen HP, Blauvelt A, Rifkin RM, Danese S, Gokhale SB, Woollett G. Switching reference medicines to biosimilars: a systematic literature review of clinical outcomes. Drugs. 2018;78:463-78.
363. European Medicines Agency (EMA) Press release: European Medicines Agency recommends approval of first two monoclonal antibody biosimilars (2013). Disponível em: http://www.ema.europa.eu/docs/en_GB/document_library/Press_release/2013/06/WC500144941.pdf. Acesso em maio de 2019.
364. Food and Drug Administration (FDA) FDA News Release: FDA approves Inflectra, a biosimilar to Remicade (2016). Disponível em: https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm494227.htm. Acesso em maio de 2019.
365. Boone NW, Liu L, Romberg-Camps MJ, Duijsens L, Houwen C, van der Kuy PHM, et al. The nocebo effect challenges the non-medical infliximab switch in practice. Eur J Clin Pharmacol. 2018;74:655-61.
366. Jorgensen KK, Olsen IC, Goll GL, Lorentzen M, Bolstad N, Haavardsholm EA, et al. Switching from originator infliximab to biosimilar CT-P13 compared with maintained treatment with originator infliximab (NOR-SWITCH): a 52-week, randomised, double-blind, non-inferiority trial. Lancet. 2017;389:2304-16.